一次食物中毒相关的侵袭性大肠杆菌分子分型分析
2015-05-09熊长辉刘晓青徐晓倩
熊长辉,杨 梦,刘晓青,徐晓倩,王 鹏,袁 辉
一次食物中毒相关的侵袭性大肠杆菌分子分型分析
熊长辉,杨 梦,刘晓青,徐晓倩,王 鹏,袁 辉
目的 对一起食物中毒分离的病原菌进行鉴定、毒力基因检测及分子分型。方法 利用生化试验、血清学试验对病原菌进行鉴定,用普通PCR和real-time PCR对病原菌进行毒力基因检测,用PFGE对其同源性进行分析。结果 分离的12份病原菌均为EscherichiacoliI,血清型为EIEC O136K78,12份病原菌均携带uid、ipaH基因,其中5份检测携带vir基因。PFGE电泳图谱显示12株病原菌带型完全相同,表明来源于同一克隆株。结论 分子生物学技术与传统方法的有机结合对侵袭性大肠埃希菌的快速鉴定及分子分型具有重要意义。
侵袭性大肠埃希菌;分子分型;PCR;脉冲场凝胶电泳
致泻性大肠埃希菌是引起人体以腹泻症状为主的全球性疾病的常见病原菌,是目前世界公认人畜共患的引起食源性疾病的重要病原菌[1]。根据研究显示,35.7%的腹泻患儿粪便标本中有致泻性大肠埃希菌, 以产毒性大肠埃希菌、侵袭性大肠埃希菌和致病性大肠埃希菌为主,在我国绝大多数地区致泻大肠埃希菌均位于儿童腹泻病原菌的前3位[2-4]。
1 材料与方法
1.1 菌株来源
1.1.1 实验菌株 一起食物中毒分离菌株12株。
1.1.2 参考菌株 EIEC阳性菌株号 CMCC44825 中国药品生物制品检定所。
1.2 主要试剂及耗材 API 20E生化鉴定试剂盒(bioMerieux)、PCR引物合成(上海生工生物公司)、TaqDNA 聚合酶和dNTPs(TaKaRa)、致泻性大肠诊断血清(宁波天润),致泻性大肠 real-time PCR检测试剂盒(深圳市生科源技术有限公司),XbaI内切酶(TaKaRa),一次性Falcon 2054试管(BD公司),一次性50 mL screw-cap tube(BD公司), SeaKem Gold Agarose(瑞士Lonza公司),普通琼脂糖(GENE 公司)。
1.3 主要仪器 微量高速离心机(德国eppendorf)、PCR 扩增仪(Bio-Rad)、自动凝胶成像仪(Bio-Rad)、脉冲场凝胶电泳系统 CHEF MAPPER(Bio-Rad),real-time PCR仪(ABI 7300),细菌浊度仪(bioMerieux),超净工作台(中国苏净安泰SW-CJ-2FD)、 培养箱(日本EYELA SLI-1200)、高速冷冻离心机(德国SIGMA 3-18K)、生物安全柜(美国Thermo)。
1.4 方法
1.4.1 生化鉴定 从三糖铁上挑取菌苔按API 20 E使用操作说明书操作。
1.4.2 血清玻片凝集实验 挑取三糖铁琼脂培养物,用致泻性大肠的多价O血清作玻片凝集实验,然后用该多价血清所包含的O单价血清作玻片凝集实验。
1.4.3 PCR检测方法
1.4.3.1 PCR扩增引物(表1)

表1 引物序列
1.4.3.2 菌株模板制备 采用热裂解法制备DNA 模板。热裂解法: 挑取菌落于100 μL去离子水的eppendorf管中,放于金属裂解仪中100 ℃ 15 min 后, 12 000 r/min离心5 min,取上清即为PCR 扩增模板。
1.4.3.3 PCR 操作方法 PCR反应总体积为25 μL,在0.2 mL eppendorf管中依次加入:10×PCR Buffer 2.5 μL;dNTPS(每种dNTP溶液终浓度为0.2 mmol/L) 0.5 μL;引物F( 20 μmol/L) 、引物R(20 μmol/L)各1 μL; Taq 酶0.5 μL;去离子水17.5 μL;模板2 μL。
反应程序:预变性94 ℃ 5 min。变性94 ℃ 30 s,退火 30 s,延伸72 ℃ 1.5 min, 30 个循环;最后72℃延伸5 min。
1.4.4 荧光PCR 反应试剂和特异性引物/探针均由深圳市生科源技术有限公司提供。反应体系总体积为25 μL,内含0.05 mol/L MgCl2,0.2 mol/L dNTPs及特异性引物/探针(各0.5 mol/L)的Tris-EDTA缓冲液(0.01 mol/L PH8.0),DNA 模板为5 μL。反应条件为:50 ℃ 2 min, 95 ℃ 3 min,在95 ℃ 5 s,55 ℃ 60 s条件下循环40次,55 ℃ 60 s阶段结束时在FAM通道采集荧光信号。所有毒力基因的检测均设有阴、阳性对照及空白对照。
1.4.5 PFGE 参照PulseNet China标准试验方案。
2 结 果
2.1 生化鉴定 12株菌API 20E生化结果一致(见表2),编码为1044552,经查验为EscherichiacoliI。

表2 API 20E生化结果
2.2 血清玻片凝集实验 经血清玻片凝集实验,所有菌株均为EIEC O多价Ⅱ血清及O136K78单价血清凝集。
2.3 PCR鉴定结果 12株菌的PCR结果如表3,电泳图谱见图1~3。
2.4 荧光PCR结果 用深圳市生科源技术有限公司提供的试剂进行检测,其中12株菌实验结果均为EIEC阳性,扩增曲线见图4 。

表3 PCR结果

图1 uid 引物扩增产物电泳结果
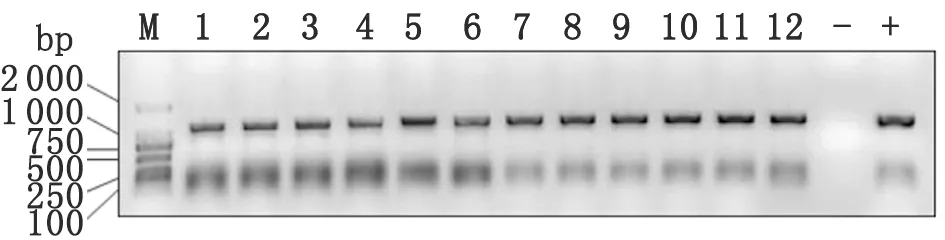
图2 vir 引物扩增产物电泳结果

图4 real-time PCR 扩增曲线
2.5 PFGE 经过PFGE图谱(图5)基因组同源性分析发现,12株分离菌均来自同一个克隆。
3 讨 论
食源性疾病并不随经济发展技术进步而减少或消失,世界范围内食品安全恶性事件接连发生,食源性疾病未能受到有效控制。近年来,全球食源性疾病发病率呈不断上升的趋势。致泻大肠埃希菌引发的肠道感染疾病越来越多,在肠道病原菌中所占比重已超过志贺菌成为最常见的腹泻病原菌[5-6]。快速检测和鉴定病原菌, 是及时有效地指导临床用药、控制与预防传染病传播的重要手段,随着科学技术和分子生物学的发展,利用五类致泻性大肠埃希菌特异基因进行检测和鉴别的PCR及real-time PCR方法得到广泛应用[7-9]。使人们逐渐重视大肠杆菌所引起的腹泻[10]和食物中毒[11]等疾病。PCR是近十多年来应用最广的分子生物学方法,在食源性致病菌的检测中均是以其遗传物质高度保守的核酸序列设计特异引物进行扩增。其大量研究表明,PCR在对食品中病原微生物的确证试验方面与传统培养方法相比至少具有相同的灵敏度,而多数情况下则表现出更高的灵敏度,阳性检出率更高,而且检测周期大为缩短。从传统意义上讲,检测食源性病原菌的方法主要依赖于培养基对存活的细胞进行选择分离和传代。虽然这种方法很有效,但却耗时耗力,完成一次检测通常需要几天时间。而生化试验只能将已分离菌鉴定至是否属于大肠杆菌,不能区分是致病还是普通非致病大肠杆菌,血清学方法易受人为因素干扰和产品的质量问题影响,使得进行细菌鉴定时常会误检和漏检,给致泻性大肠埃希菌的检测和研究带来不便。利用PCR及real-time PCR方法可以补充传统方法的不足,它具有快速、简便、灵敏度高的特点。本次实验的12株病原菌用普通PCR均检出 uid、ipaH基因,其中5株还检出vir基因。用real-time PCR检测12株菌均可确定为含有ipaH基因的EIEC(实验试剂中只设计有ipaH基因引物/探针)。
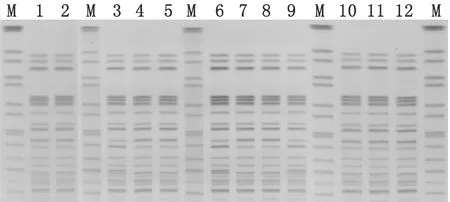
图5 PFGE电泳图谱
PFGE分型技术是目前分子生物学实验室技术除基因测序外在重复性、特异性、分辨力、准确度上最好的方法之一,其能够在基因组水平上对细菌的变异特征进行分析,是以病原菌分析为基础的监测网络内用于相互比较和利用的技术方法,可以从分子水平研究细菌的遗传和变异情况, 由于不同菌株的电泳图谱具有高度特异性,用目视即可观察到不同大小的限制性片段形成的条带,如采用扫描和电脑分析,则更能准确、快速地识读和比较基因组的变异情况,从而识别特异的菌株。无论发达国家还是发展中国家,食源性疾病和传染病的发生率仍居高不下,在人类疾病中占据很大的比例。在发生食源性疾病或传染病时,及时确定病原体,并在此基础上对不同来源的病原体进行比较,是确定传染源、从根本上控制疾病的必需条件。本次实验利用PFGE对所检测的菌株进行同源分析,结果显示12株菌均来自于同一克隆。分子生物学技术对致泻性大肠杆菌的快速鉴定及分子分型,有效的指导临床用药,及时救治生命,预防食物中毒,保障公众健康具有重大意义。在今后的疾病预防控制工作中,针对食物中毒,应用不同的实验方法进行比对分析,用分子流行病学对其生物学特性做进一步研究,以便查找传染来源、分析传播链,加强监控和阻断,以达到预防和控制疾病的目的。
[1]Yang XJ, Wu QP, Zhang JM, et al. Studies on detection ofSalmonellaspp. andEscherichiacoliO157 in meat and other animal products by multiplex PCR assay[J]. Microbiol China, 2008, 35(3): 470-474.(in Chinese)
[2]Wyoming JH. Traveler’s diarrhea a 50-year perspective. Proceedings of a conference organized by the International Society of Travel Medicine[J].Clin Infect Dis, 2005, 41(8): 547.
[3]You JA, Zhao ZH. Children with diarrhea etiology and clinical analysis[J]. J Pract Med, 2006, 22(15): 1797-1798.(in Chinese) 游锦安,赵卓辉.儿童腹泻病病原学及临床分析[J].实用医学杂志, 2006, 22(15): 1797-1798.
[4]Guo JY, Hu XR, Zhang CC. Children diarrhea monitoring data analysis in rural area in Fei County, 2003-2005[J]. Chin J Rural Med Pharm, 2008, 15(6): 70-71.(in Chinese) 郭景阳, 胡秀荣, 张传成. 费县农村2003-2005年度儿童腹泻监测资料分析[J].中国乡村医药杂志,2008,15(6):70-71.
[5]Roberto V, Maricel V, Rossana L, et al. Multiplex PCR for diagnosis of enteric infections associated with diarrh eagenicEscherichiacoli[J]. Clin Microbiol, 2004, 42(4): 1787-1789.
[6]Shi Q, Huang XM, Li CY, et al. Study on status of diarrhoeaE.coliinfection in the diarrhoeal disease research[J]. Chin J Health Lab Technol, 2005,15(1): 5-8.(in Chinese) 时全,黄新明,李朝阳,等.致泻大肠埃希菌感染在腹泻病中地位的研究[J].中国卫生检验杂志,2005,15(1): 5-8.
[7]Ding YR, Shi Q, LI CY, et al. Relationship with diarrhea and diarrheagenicE.coliin the water distribution[J]. Chin J Zoonoses, 2005,21(11): 968-971. (in Chinese) 丁业荣,时全,李朝阳,等.致泻大肠埃希菌在水源水中的分布与腹泻病关系的研究[J].中国人兽共患病杂志,2005,21( 11) : 968-971.
[8]Guion CE, Ochoa TJ, Walker CM, et al. Detection of diarrheagenicEscherichiacoliby use of melting curve analys is and real-time multiplex PCR[J]. Clin Microbio, 2008, 46(5): 1752-17571.
[9]Fedio WM, Jinneman KC, Yoshitomi KJ, et al. Detection ofE.coliO157:H7 in raw ground beef by Pathatrix immunomagnetic separation, real-time PCR and cultural methods[J]. Food Microbiol, 2011, 148(2): 87-92.
[10]Bueris V, Sircili MP, Taddei CR, et al. Detection of diarrheagenicEscherichiacolifrom children with and without diarrhea in Salvador, Bahia, Brazil[J]. Mem Inst Oswaldo Cruz, 2007, 102(7): 839-844.
[11]Zhang Q, Zhao W. A survey of the food poisoning caused by pathogenicEcoli[J]. China Public Health, 2001, 17(7): 635. (in Chinese) 张群, 赵巍. 一起致病性大肠杆菌所致食物中毒的调查报告 [J]. 中国公共卫生, 2001, 17(7) : 635.
Yuan Hui, Email: jxcdcyuanhui@126.com
Genotype identification and laboratory examination of EIEC from a case of food contamination
XIONG Chang-hui,YANG Meng,LIU Xiao-qing,XU Xiao-qian,WANG Peng,YUAN Hui
(JiangxiProvincialCenterforDiseaseControlandPrevention,Nanchang330029,China)
We conducted the identification, virulence gene detection and the characteristics of molecular typing of the pathogen in a food poisoning outbreak. The pathogens were confirmed by bacteria isolation, identification, biochemical tests and serologic tests, and then PCR and real-time PCR methods were used to detect virulence factors and molecular typing of pathogens. After the genome of the pathogens was digested by restricted enzymeXbaI, the electrophoresis fingerprint was obtained by PFGE, and homology analysis was performed. Results showed that the separation of 12 pathogenic bacteria wereEscherichiacoliI and serotype O136K78, which carrying the uid and ipaH genes and five strains including vir gene. The strains of EIEC were isolated from the patients, which had the same PFGE pattern. It is very great significance of the combination of molecular biology technology and the traditional method of identification and molecular classification in EIEC, the studies showed its important value in clinical diagnosis and epidemiological investigation.
EIEC; molecular classification; PCR; PFGE
10.3969/cjz.j.issn.1002-2694.2015.08.013
袁辉,Email:jxcdcyuanhui@126.com
江西省疾病预防控制中心传染病预防控制所,南昌 330029
R378
A
1002-2694(2015)08-0747-04
2015-01-07;
2015-03-19
