蔗糖水解反应速率常数测定方法的改进
2015-05-08田志美宋崇富田友华刘昭第师瑞娟崔玉民
田志美,宋崇富,田友华,刘昭第,师瑞娟,张 坤,崔玉民
(1.阜阳师范学院 化学化工学院,安徽 阜阳 236041; 2.山东省昌乐二中,山东 昌乐 262400 )
·实 验 技 术·
蔗糖水解反应速率常数测定方法的改进
田志美1,宋崇富1,田友华2,刘昭第1,师瑞娟1,张 坤1,崔玉民1
(1.阜阳师范学院 化学化工学院,安徽 阜阳 236041; 2.山东省昌乐二中,山东 昌乐 262400 )
文中探讨了测定蔗糖水解反应速率常数的优化方法,发现读取旋光度后按复测键再次读数并取平均值计算得到的速率常数结果与理论值符合较好。在优化方法基础上研究了盐酸浓度和温度的改变对反应速率常数的影响。得到随催化剂浓度的增大和温度的升高,速率常数k随之变大。根据阿累尼乌斯公式,求出蔗糖水解反应活化能为108 kJ/mol,与文献值完全吻合,表明该改进的实验方法是合理的。
蔗糖水解;优化方法;速率常数;活化能
蔗糖水解反应速率常数的测定是物理化学中一个典型的一级动力学实验,是高等学校化学专业和材料化学专业必开的物理化学教学实验之一[1]。速率常数是温度的函数,随温度的改变而发生变化。由于本实验所选用的WZZ-1S数字式自动旋光仪只能测定常温下的旋光度值,在本文中,我们采用恒温水浴温热旋光管中蔗糖溶液的方法测定定温下蔗糖水解反应的旋光度。在WZZ-1S数字式自动旋光仪上有复测键,确定温度和催化剂时,采用平行测定两组数据或者通过复测测定数据这两种采集数据方法,得到速率常数,并比较哪种数据采集方法更合适。
已有相关论文讨论蔗糖水解反应速率常数酸度和温度的关系[2],实验数据处理方法的改进等[3-5],但对数据采集方法方面的讨论少见报道。在本文中,主要探讨了测定反应速率常数的数据采集方法;在此方法基础上,改变催化剂盐酸浓度,得出速率常数随催化剂浓度增大而增大;最后,改变温度,发现随着温度的升高,速率常数上升。依据阿累尼乌斯公式,利用Origin6.1软件作图求出蔗糖水解反应的活化能Ea。
1 原理
蔗糖在水中转化为葡萄糖与果糖,其反应为:
(1)
根据旋光度与浓度的关系,可用旋光度代替浓度,得:
ln(αt-α终) = -kt+ ln(α0-α终)
(2)
以ln(αt-α终)对t作图可得一直线,从直线斜率即可求得反应速率常数k。
得出不同温度下速率常数k值后,利用阿累尼乌斯方程:
lnk= -Ea/RT+ 常数
(3)
以lnk对1/T作图,从直线斜率求出蔗糖水解反应活化能Ea。
2 实验
2.1 实验仪器与材料
WZZ-1S数字式自动旋光仪(上海浦东物理光学仪器厂);SYP-Ⅲ玻璃恒温水浴(南京桑力电子设备厂);盐酸(分析纯,上海中试化工总公司);蔗糖(分析纯,上海山浦化工有限公司)。
2.2 实验方法
将恒温水浴调节到303.15 K± 0.01 K。在2个烧杯内,分别加入25 mL蒸馏水和25 mL盐酸,放入水浴中恒温10~15 min。称取5 g蔗糖,加入已经恒温的蒸馏水中,使蔗糖完全溶解。蔗糖溶解后,加入已经恒温的盐酸,一边加入一边搅拌, 反应体系中盐酸浓度为1 mol/L,使其充分反应,当盐酸加入一半时开始计时。用反应液润洗样品管2~3次,再向样品管中加入反应液,用滤纸将样品管外的水擦干净后,放入旋光仪,测量各时间的旋光度。在反应开始后2~3 min内测定第一个数据,此后每隔3 min读取一个读数。在读取第一个读数后,取出样品管,放入303.15 K的水浴中恒温160 s,再取出样品管,用滤纸将样品管外的水擦干,放入旋光仪读取第二个数,往后重复此操作依次读数,直至反应时间为45 min为止。在此期间,将剩余的反应液置于333.15 K的水浴内恒温45 min,用来测量α终。
按照上述步骤,平行测定一次盐酸浓度为1 mol/L时蔗糖水解反应的旋光度。在每次读数后,按下复测键,读取复测值。测定结果如表1所示。

表1 旋光度(ln[(α1+α2)/2-α终]与ln[(α2+αf)/2-α终])随时间t变化关系表
将两组数α1,α2取平均值,再以ln[(α1+α2)/2-α终]对t作图,见图1(a);将测得的α2与复测值αf取平均值,再以ln[(α2+αf)/2-α终]对t作图,见图1(b)。从图1中可以得出k1=
0.023 39 min-1,k2=0.023 63 min-1。与文献值k=0.025 5 min-1[6]比较,发现读数后按复测键得到的结果更接近理论值。所以,后面的实验我们均采取这种方法进行实验。
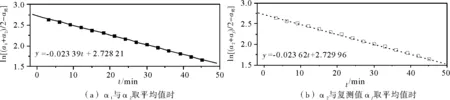
图1 反应温度为303.15 K,反应体系中HCl浓度为1 mol/L时,旋光度与t的关系图
2.3 改变催化剂浓度研究速率常数变化
将恒温水浴调节到303.15 K± 0.01 K,按上述操作步骤,读取读数后按复测键再次读数。
以ln[(αt+αf)/2-α终]对t作图,从斜率得到速率常数。重复操作完成反应体系中盐酸浓度分别为1.5mol/L, 2 mol/L的实验。温度为303.15 K± 0.01 K时,相应的速率常数列于表2。

表2 盐酸浓度与反应速率常数的关系表
注:*反应体系中盐酸的浓度
从表2可以看出,速率常数随催化剂浓度的增加而增大。
2.4 改变温度研究速率常数的变化及测定反应活化能
在改变温度的实验中,反应体系中盐酸浓度为1.5 mol/L。按照上述实验步骤,完成295.15 K,299.15 K,307.15 K下蔗糖水解实验。303.15 K 盐酸浓度为1.5 mol/L时速率常数从表2得出,为0.048 24 min-1。
以ln[(αt+αf)/2-α终]对t作图,从斜率得到各温度下的速率常数k,列于表3。

表3 不同反应温度与反应速率常数的关系表
从表3看出,盐酸浓度为1.5 mol/L,速率常数随温度的升高而增大。
lnk与1/T的关系如图2所示。

图2 lnk与1/T的关系图
得到速率常数k后,由阿累尼乌斯公式lnk=-Ea/RT+常数,以lnk对1/T作图,由斜率求得蔗糖水解反应活化能Ea。从图2可以得出,蔗糖水解反应活化能Ea=108 kJ/mol,与文献值完全吻合[7]。
3 结束语
在每次读取旋光度后,再次按下复测键读取复测值,两次数值取平均值后计算得到的速率常数更接近理论值。所以,可以采取这种采集数据的方法进行蔗糖水解实验。可用恒温水浴温热旋光管的方法得到不同温度下反应的旋光度值,进而得到不同温度下蔗糖水解反应的速率常数。速率常数k随催化剂浓度的升高逐渐增大,随温度的升高逐渐增大。通过计算,得出了蔗糖水解反应的活化能Ea=108 kJ/mol,与文献值完全吻合。
[1]复旦大学.物理化学实验[M].3版.北京:高等教育出版社,2003:94-98.
[2]赵云强.蔗糖转化速率常数与酸度和温度的关系[J].贵州师范大学学报:自然科学版,2000,18(4):84-86.
[3]周从山,杨涛.蔗糖水解实验数据处理新方法[J].实验科学与技术,2008,6(4):46-48.
[4]艾佑宏,吴慧敏,吴琼.蔗糖水解实验数据处理方法的改进[J].化学研究,2007,18(1):80-83.
[5]陈文娟,胡治元.“蔗糖水解反应速率常数测定”实验数据处理的改进[J].洛阳工业高等专科学校学报,2004,14(3):41-42.
[6]陈元发,佴如庆,陈全斌,等.蔗糖转化速率常数与酸浓度关系方程的确立[J].广西师范大学学报,1993,11(4):57-61.
[7] 王立斌,陈福忠.蔗糖水解反应速率常数测定实验的改进[J].通化师范学院学报,2004,25(8):37-38.
如果把学生的热情激发出来,那么学校所规定的功课就会被当作一种礼物来领受。
——爱因斯坦
Improvement of the Determination Method of the Reaction Rate Constant of Sucrose Hydrolysis
TIAN Zhimei1, SONG Chongfu1, TIAN Youhua2, LIU Zhaodi1, SHI Ruijuan1, ZHANG Kun1, CUI Yumin1
(1.College of Chemistry and Chemical Engineering, Fuyang Normal College, Fuyang 236041, China;2.Shandong Changle NO.2 High School, Changle 262400, China )
We performed the optimization method of determination of sucrose hydrolysis rate constant. We found that the rate constant obtained by reading optical rotation by repeating again to obtain average values of optical rotation in accordance with literature result. On the basis of the optimization method, we studied the influence of the concentration of hydrochloric acid and temperature on the reaction rate constant. With the increasing of the catalyst concentration and temperature, the rate constantkbecame bigger. According to the Arrhenius formula, the sucrose hydrolysis reaction activation energy is 108 kJ/mol, which is the same as the literature value. This indicates that the improved experimental method is reasonable.
sucrose hydrolysis; optimization method; rate constant; activation energy
2013-12-06;修改日期: 2014-05-13
安徽省高校省级自然科学研究基金资助项目(KJ2013Z256);安徽省省级科研机构校级委托专项基金资助课题(2013HJJC02, 2011HJJC04 YB);阜阳师范学院博士科研启动基金资助项目;国家级大学生创新创业训练计划基金资助项目(2013103 71018)。
田志美(1981-),女,硕士,助理实验师,研究方向:物理化学及实验教学研究。
宋崇富(1979-),男,博士,副教授,研究方向:分析化学。
O643;TQ031.5
A
10.3969/j.issn.1672-4550.2015.04.001
