脑缺血大鼠脾质量指数与神经功能缺损评分及脑梗死体积的相关性
2015-05-07李丹丹王爱红
王 辛,马 茜,李丹丹,王爱红
0 引 言
脑卒中具有高发病率、高致残率和高死亡率的特点,其中,缺血性卒中约占85%[1],多由大脑中动脉阻塞所致。近年来,随着对缺血后继发性脑损伤机制的深入研究,免疫炎症反应已受到广泛关注。脾作为外周免疫调节的蓄水池,脑缺血后,相关炎性标记物(炎性细胞、细胞因子等)应激性的表达增加,不仅作用于脾组织,也可经血液循环,在缺血区募集活化,加重脑损伤[2]。越来越多的研究表明,脾在卒中后脑损伤的发生、发展中发挥重要作用,但是,两者间是否具有潜在联系,目前报道不多。本研究通过建立永久性大脑中动脉闭塞(permanent occlusion of the middle cerebral artery,pMCAO)模型,动态观察脾质量指数与神经功能缺损评分、脑梗死体积的变化规律,探讨其相关性。
1 材料与方法
1.1 实验动物及分组 SPF 级健康雄性SD 大鼠30 只,体重为(300±20)g,由南京中医药大学动物实验中心提供[许可证号:SCXK(京)2012-0001]。大鼠均适应性饲养7 d,自由摄食、饮水、饲养环境温度19 ~26 ℃,湿度40%~70%,通风良好,自然昼夜节律光照。根据随机数字表法将大鼠分为假手术组(颈部切开,钝性分离大鼠右侧颈总动脉、颈内动脉和颈外动脉后即缝合,不做进一步手术处理)、缺血3 d 组和缺血7 d 组(应用线栓法制成大鼠pMCAO模型),每组10 只。
1.2 实验试剂和仪器 氯化三苯基四氮唑(2,3,5-triphenyltet razolium chloride,TTC,美国Sigma 公司);电子天平(上海浦春计量仪器有限公司);大脑中动脉阻塞线栓(北京沙东生物技术有限公司);脑切片模具(深圳瑞沃德生命科技有限公司);恒温隔水培养箱(上海精宏实验设备有限公司);Histostar包埋机、Finesse E+手动切片机(美国Thermo 公司);BX41 显微镜(日本OLYMPUS 公司)。
1.3 实验方法
1.3.1 pMCAO 大鼠模型的制备 术前禁食12 h后,根据改良线栓法[3]阻塞大鼠右侧大脑中动脉制备永久性脑缺血模型。具体步骤:①10%(体积分数)水合氯醛(3.5 mL/kg)腹腔注射麻醉,仰卧位固定大鼠;②颈部正中备皮消毒后,行(30 ~40)mm纵向切口,钝性分离各层肌肉和筋膜后,暴露颈动脉三角,分离右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA),避免损伤迷走神经;③手术线结扎CCA 和ECA 的远心端,在ICA近心端挂线、系活结后,用微动脉夹暂时阻断ICA血流;④在距CCA 分叉处上端约3 mm 处剪小口,将直径0.28 mm 的线栓插入CCA 后系紧活结,松微动脉夹,继续将线栓由CCA 经ICA 缓慢推至大脑中动脉,深度约18 ~20 mm,遇阻力即停止插线,注意避免插入翼腭动脉;⑤剪去暴露在血管外的剩余线栓后,逐层缝合皮下组织及皮肤。造模过程中注意保温,室温维持在25 ℃。
1.3.2 神经功能缺损评分 采用Zea-longa[4]评分法,于大鼠造模清醒时、缺血3 d 和7 d 时间点分别进行神经功能缺损评分。0 分:无神经缺损症状;1分:无法完全伸展左侧前肢;2 分:行走时向左侧转圈;3 分:行走时向左侧倾倒;4 分:不能自发行走,痉挛、昏睡、意识丧失。术后清醒时评分在1 ~3 分表示造模成功;0 分和4 分表示造模失败,剔除。
1.3.3 脾质量指数的检测 脑缺血后3 d 和7 d,称取大鼠体重,无菌条件下在动物左下腹部切约30×40 mm 的切口,迅速取脾,去除表面脂肪和筋膜,用预冷的等渗盐水冲净,滤纸吸干后称重、记录脾质量,计算脾质量指数。计算公式:
脾质量指数=脾质量/体重(mg/g)
1.3.4 脑梗死病灶体积测定 脑缺血后3 d 和7 d,行神经功能缺损评分后,大鼠断头取脑,等渗盐水冲净,放入-20 ℃冰冻20 min,取出置于大鼠脑模具中,自视交叉水平做等距离连续5 片的冠状切片(片厚2 mm)。将切片放于37 ℃1%TTC 溶液中,避光孵育30 min,为保证脑片染色均匀,每隔10 min翻动一次。染色后脑片置于4%多聚甲醛中固定24 h,拍照,利用Image-Pro Plus 5.0 图像处理软件计算每张切片患侧脑梗死面积和对侧全脑面积。计算公式[5]:
脑梗死体积百分比(%)=患侧梗死面积/对侧全脑面积×100%
1.3.5 脑组织病理学检查 脑缺血后3 d 和7 d,各组随机取4 只大鼠,4%多聚甲醛行心脏灌注后,迅速断头取脑。分离大脑皮质,置于4%的多聚甲醛中固定24 h 后石蜡包埋,制成厚4 μm 石蜡切片,行HE 染色,光化学显微镜下观察脑组织形态结构。
1.4 统计学分析 采用SPSS17.0 软件进行数据分析,正态分布计量资料用均数±标准差)表示,2 组间均数比较采用t 检验,多组间均数比较采用方差分析(One-way ANOVA);非正态分布计量资料采用中位数M(P25,P75)表示,2 组间比较采用Wilcoxon 非参数检验。相关性分析时,符合正态分布时用偏相关系数描述,不符合正态分布时用Spearman 相关系数描述。以P≤0.05 为有统计学意义。
2 结 果
2.1 各组大鼠脾质量指数的比较 与假手术组、缺血7 d 组脾质量指数[(1.90±0.22)mg/g、(1.62±0.58)mg/g]比较,缺血3 d 组[(0.87±0.59)mg/g]明显下降,差异有统计学意义(P <0.05),见图1。

图1 各组大鼠脾质量指数的比较Figure 1 Comparison of the spleen mass index among the three groups of rats
2.2 各组大鼠神经功能缺损评分的比较 假手术组无神经功能缺损症状。大鼠术后清醒时,缺血3 d组和缺血7 d 组均出现不同程度的神经功能障碍,但差异无统计学意义(P >0.05);术后相应时点,缺血7 d 组神经功能缺损评分较缺血3 d 组下降,差异有统计学意义(P <0.05),见表1。
2.3 各组大鼠脑梗死体积比较 TTC 染色显示正常脑组织呈红色,梗死区为白色。假手术组脑组织均为红色,无梗死灶;缺血3 d 组和缺血7 d 组梗死明显,且多位于大脑皮层、纹状体等部位。与缺血7 d 组脑梗死体积比较,缺血3 d 组增大,差异有统计学意义(P=0.029)。见表1。
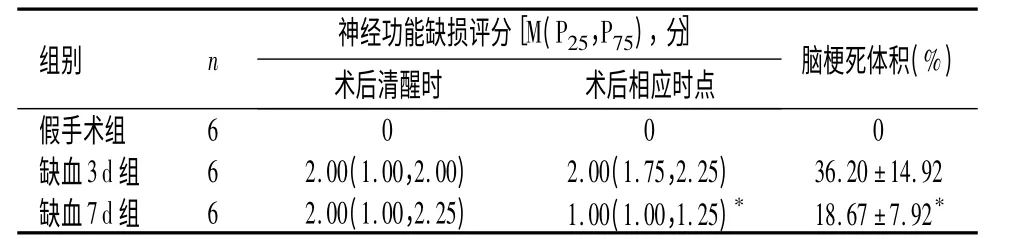
表1 各组大鼠神经功能缺损评分的比较Table 1 Comparison of neurological dysfunction scores among the three groups of rats
2.4 各组大鼠脑组织病理形态学改变 假手术组大脑实质各层结构清晰,神经细胞未见肿胀、空泡变性,核正常,血管未见出血及淋巴细胞聚集的现象。与缺血7 d 组比较,缺血3 d 组大脑皮层和海马内出现大量神经元坏死,神经元数目明显减少,细胞核显著固缩,胞体缩小变形,间质水肿,血管周间隙明显增宽,见图2。
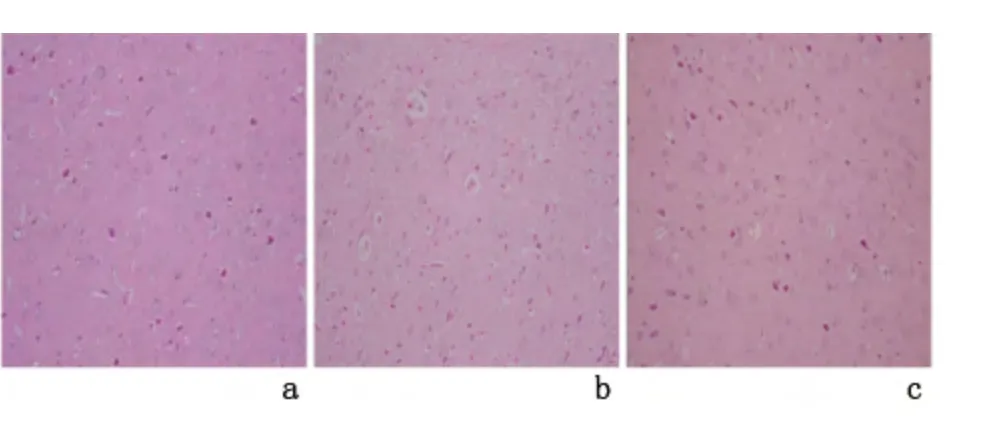
图2 各组大鼠脑组织病理变化(HE ×200)Figure 2 Pathological changes in the brain tissues of the three groups of rats(HE ×200)
2.5 大鼠脾质量指数与神经功能缺损评分、脑梗死体积百分比的相关性 相关分析显示,脾质量指数与神经功能缺损评分、脑梗死体积百分比呈负相关(r=-0.851,P=0.019;r=-0.717,P=0.013)。
3 讨 论
近年来研究发现,脑缺血后所造成的脑组织损害以及血-脑屏障的破坏,可能引起机体免疫功能失衡[6]。脾作为机体“免疫-神经-内分泌”调控网络的重要组成部分,是免疫细胞(淋巴细胞、巨噬细胞、树突状细胞等)和细胞因子(趋化因子、补体等)定居的主要场所。脑损伤早期,中枢通过交感神经系统分泌的儿茶酚胺与脾α、β 肾上腺素受体结合,导致脾宿主细胞凋亡,脾萎缩[7]。既往研究发现,脾切除术可以显著减小脑梗死体积,改善神经功能缺损症状[8-9]。因此,维持脾的正常生理功能,对于缓解卒中后脑损伤具有积极意义。大量研究表明,脾形态与脾功能密切相关[10-13],且由于脾血流量丰富,其早期病变多表现为脾体积的改变[14],故本研究进一步将脾体积作为判断其生理功能的外在标志。
大量研究表明,脑损伤后外周免疫功能的改变具有时间依赖性,多以缺血3 d 最明显,且持续时间长达数周[15-16],故本研究选择缺血3、7 d 时间点进行观测。与假手术组比较,缺血3 d 组大鼠脾质量指数明显下降(P <0.01),这说明脑缺血后,外周脾免疫功能遭到破坏,最终导致脾萎缩的发生,这与以往研究结果一致[17]。同时,Gendron 等[18]指出,脑缺血7 d 时,中枢分泌的去甲肾上腺素水平降低,对脾正常生理功能的拮抗作用减弱,这可能是本实验中缺血7 d 组脾质量指数下降不明显的原因之一。
神经功能缺损评分和脑梗死体积不仅是判断脑缺血模型造模成功的金标准,也是脑损伤后神经功能康复的关键[19]。本研究通过建立接近临床脑缺血患者的pMCAO 大鼠模型[20],观察发现,缺血3 d组和缺血7 d 组均呈现神经功能缺损症状、脑组织梗死灶明显,证明了本模型的成功复制。近年来研究发现,脑损伤后神经功能的恢复具有时间依赖性,通过建立局灶性脑缺血小鼠模型发现[21],Longa 神经功能缺损评分在1、4、7 d 呈下降的趋势;在脑缺血再灌注大鼠模型中也发现[22],神经功能评分随着时间的延长逐渐改善。本实验结果亦显示,与缺血3 d 组比较,缺血7 d 组大鼠神经功能缺损评分和脑梗死体积有好转倾向(P <0.05)。分析导致这一结果的原因可能是:①大鼠的神经结构更为原始,具有较强的再生修复能力;②缺血7 d 时,大鼠脑血管侧枝循环重塑,梗死侧脑组织实现脑血流再通。
脑血流量灌注不足、能量代谢障碍等病理生理改变,最终导致神经细胞不可逆性坏死和神经功能受损[23-24],这已成为缺血性脑损伤发展变化的核心以及影响预后的主要因素。不同时点动物模型均呈现大脑皮质神经元的坏死、细胞核固缩和间质水肿等病理改变,且缺血3 d 组较缺血7 d 组损伤明显。
以神经功能缺损评分和脑梗死体积百分比作为分层因素,分析发现脾质量指数越低,神经功能缺损症状越严重,脑梗死体积越大,提示脾质量指数可能反映缺血性脑损伤的严重程度,这恰好反映了脾生理功能与脑损伤间的潜在联系,故对于脑缺血后脾体积的变化需提高重视。
综上所述,本研究通过将脾体积作为判断脾生理功能演变的外在标志,初步证实了脑缺血后,外周脾与中枢脑损伤的关系,这将为临床通过脾的靶向治疗促进脑缺血患者神经功能的康复提供了理论依据,但针对脾与脑损伤后相互作用的内在分子机制的研究仍需进一步深入探讨。
[1] Beal CC.Gender and stroke symptoms:a review of the current literature[J].J Neurosci Nurs,2010,42(2):80-87.
[2] Deng G,Carter J,Traystman RJ,et al.Pro-inflammatory T-lymphocyte rapidly infiltrate into the brain and contribute to neuronal injury following cardiac arrest and cardiopulmonary resuscitation[J].J Neuroimmunol,2014,274(1-2):132-140.
[3] Uluç K,Miranpuri A,Kujoth GC,et al.Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat[J].J Vis Exp,2011,48(48):1-4.
[4] Longa EZ,Weistein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5] Hernández-Jiménez M,Hurtado O,Cuartero MI,et al.Silent information regulator 1 protects the brain against cerebral ischemic damage[J].Stroke,2013,44(8):2333-2337.
[6] 李 茜,陈兴东.急性脑缺血对机体免疫系统的影响[J].医学研究生学报,2013,26(6):654-657.
[7] Ajmo CT Jr,Collier LA,Leonardo CC,et al.Blockade of adrenoreceptors inhibits the splenic response to stroke[J].Exp Neurol,2009,218(1):47-55.
[8] Zhang BJ,Men XJ,Lu ZQ,et al.Splenectomy protects experimental rats from cerebral damage after stroke due to anti-inflammatory effects[J].Chin Med J(Engl),2013,126(12):2354-2360.
[9] Dotson AL,Wang J,Saugstad J,et al.Splenectomy reduces infarct volume and neuroinflammation in male but not femal mice in experimental stroke[J].J Neuroimmunol,2015,15(278):289-298.
[10] Balato N,Napolitano M,Ayala F,et al.Nonalcoholic fatty liver disease,spleen and psoriasis:New aspects of low-grade chronic inflammation[J].World J Gastroenterol,2015,21(22):6892-6897.
[11] 朱晓健,李 翔,游 泳,等.外源性VEGF 促小鼠造血干细胞动员[J].中国实验血液学杂志,2014,22(1):154-159.
[12] Cao Y,Hao L,Han CH,et al.Protective effects of Wusen Erlian granules in experimental model of viral myocarditis[J].Cell Biochem Biophys,2015,71(2):1129-1133.
[13] 丁 妍,周向毅,崔 莉,等.灵芝多糖对辐射损伤小鼠的防护作用[J].医学研究生学报,2014,27(11):1152-1155.
[14] 杨伟力,李军宅.肋单元法与脾指数法评估脾脏大小的比较[J].中国当代医药,2014,21(2):129-131.
[15] Jin R,Yang G,Li G.Inflammatory mechanisms in ischemic stroke:role of inflammatory cells[J].J Leukoc Biol,2010,87(5):779-789.
[16] Kim MS,Yan J,Wu W,et al.Rapid linkage of innate immunological signals to adaptive immunity by the brain-fat axis[J].Nat Immunol,2015,16(5):523-533.
[17] Seifert HA,Hall AA,Chapman CB,et al.A transient decrease in spleen size following stroke corresponds to splenocyte release into systemic circulation[J].J Neuroimmune Pharmacol,2012,7(4):1017-1024.
[18] Gendron A,Teitelbaum J,Cossette C,et al.Temporal effects of left versus right middle cerebral artery occlusion on spleen lymphocyte subsets and mitogenic response in Wistar rats[J].Brain Res,2002,955(1-2):85-97.
[19] 王柳清,邵 蓓,林真珍,等.大鼠大脑中动脉近端及远端阻塞脑缺血模型的脑梗死体积和行为学差异比较[J].中国临床神经科学,2013,21(3):259-263.
[20] Hossmann KA.The two pathophysiologies of focal brain ischemia:implications for translational stroke research[J].J Cereb Blood Flow Metab,2012,32(7):1310-1316.
[21] 刘家兰,邓礼娟,原欢欢,等.小鼠局灶性脑缺血模型行为学指标相关性研究[J].中国药理学通报,2012,28(3):430-435.
[22] 王荣亮,刘小蒙,张 营,等.大鼠局灶性脑缺血后神经功能评分与脑梗死体积相关性分析[J].首都医科大学学报,2013,34(1):69-74.
[23] Beretta S,Cuccione E,Versace A,et al.Cerebral collateral flow defines topography and evolution of molecular penumbra in experimental ischemic stroke[J].Neurobiol Dis,2015,74:305-313.
[24] 陈玉玺,王晓莉,牟青杰,等.骨髓间充质干细胞对脑缺血大鼠星形胶质细胞影响的实验研究[J].医学研究生学报,2013,26(6):564-567.
