微波消融与手术切除结直肠癌肝转移的疗效比较*
2015-05-06宋鹏远孙亚红郭亚盛立军
宋鹏远 孙亚红 郭亚 盛立军
微波消融与手术切除结直肠癌肝转移的疗效比较*
宋鹏远 孙亚红**郭亚 盛立军①
(山东省医学科学院附属医院内五科,济南250031)
目的比较结直肠癌肝转移瘤行微波消融(microwave ablation,MA)与肝切除手术治疗的疗效。方法回顾性分析2010年10月~2014年2月62例结直肠癌肝转移,其中肝转移灶MA治疗28例(MA组),手术切除34例(手术组),比较2组无病生存期(DFS)、生存期(OS)、并发症、住院时间及费用。结果MA组住院时间(5.9±0.9)d,显著短于手术组(11.8±6.9)d(t=-4.487,P=0.001);MA组治疗费用(2.9±0.5)万元,显著少于手术组(5.5±0.8)万元(t= 14.949,P=0.000);MA组重度并发症发生率0,显著低于手术组26.5%(9/34)(Fisher's检验,P=0.003)。MA组与手术组累积无病生存率差异无统计学意义(log-rankχ2检验:χ2=2.010,P=0.156);MA组与手术组累积生存率差异无统计学意义(log-rankχ2检验:χ2=0.307,P=0.580)。结论MA治疗结直肠癌肝转移微创、经济、安全有效,治疗效果不逊于手术治疗。
微波消融;手术切除;结直肠癌;肝转移
结直肠癌肝转移是影响结直肠癌预后的重要因素之一,也是导致患者死亡的主要原因。结直肠肝转移手术切除被认为是目前唯一能治愈肝转移的方法,但随着现代影像设备性能的提高及肿瘤微创手术的发展和创新,以微波和射频为代表的热消融治疗肝癌或肝转移瘤应运而生,在肿瘤综合治疗中逐渐受到重视。本研究回顾性分析山东省医学科学院附属医院和山东省肿瘤医院2010年10月~2014年2月87例(分别46、41例)结直肠癌肝转移灶行微波消融(microwave ablation,MA)或肝切除治疗的临床资料,旨在为结直肠癌肝转移患者选择合理的治疗方案提供依据。
1 临床资料与方法
1.1 一般资料
87例均为结直肠癌根治性手术切除后经影像学证实仅发生肝脏部位转移,且肝穿刺活检病理证实转移灶来自于结直肠,同时符合:①单个肿瘤直径≤5 cm,或肿瘤数量≤3个,最大直径≤3㎝;②无脉管癌栓,邻近器官侵犯;③肝功能分级A或B级,或内科治疗达到该标准;④KPS评分0~1分,且无手术或微波治疗禁忌;⑤MA及手术切除后4周 MRI、增强CT或超声造影示病灶达到完全消融或根治性切除。排除25例肿瘤直径>5 cm、消融不完全、术后未在我院随访和辅助化疗的患者,最终62例纳入本研究,其中MA治疗28例(消融组),肝切除34例(手术组)。选择MA治疗患者:①年龄偏大;②既往有手术史,拒绝再次手术;③心肺功能欠佳,不能耐受手术。2组患者性别、肿瘤大小和数目、Child-Pugh分级、肝转移时间、病理类型均无统计学差异(P>0.05),年龄有统计学差异(P<0.05),见表1。
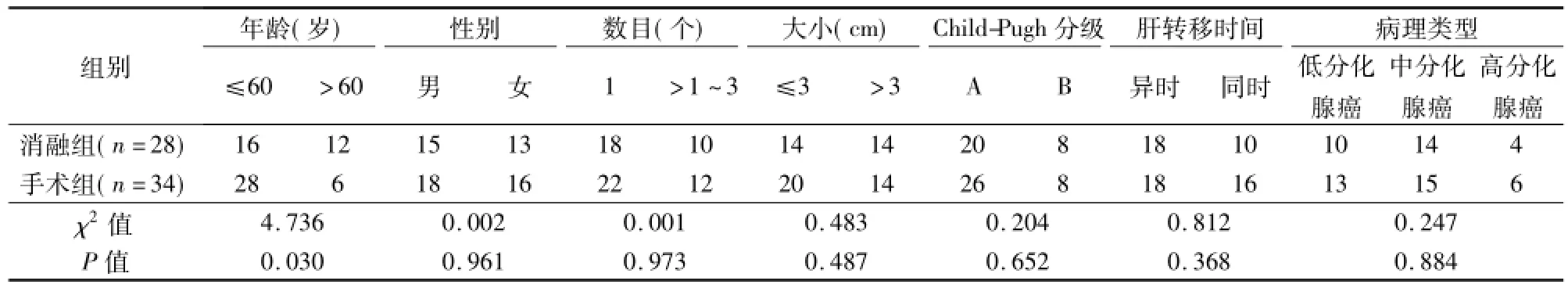
表1 2组一般资料比较
1.2 方法
1.2.1 仪器设备南京康友公司KY-2000型微波多功能治疗仪(YZB/国0099-2006),微波频率2450 MHz,输出功率10~100 W,连续可调。德国西门子公司64排螺旋CT。百盛魅力90彩色多普勒超声诊断仪,深圳迈瑞M5彩色多普勒超声诊断仪。
1.2.2 术前准备常规强化CT评价肿瘤大小、位置、数目;术前常规检查,排除MA及手术禁忌,向患者及家属讲明治疗的风险和并发症,征得其同意后签署MA治疗或手术知情同意书。
1.2.3 治疗方法消融组:采用外接心电监护,并建立静脉通道。根据B超或CT确定进针入路。避开肝门区血管、门静脉主干及左右支、胆囊、胆管及肋骨等邻近的骨骼,尽可能沿肿瘤长轴进针,确定进针角度及深度。2%利多卡因局部麻醉穿刺点,在B超或CT引导下将微波电极穿刺至预定部位。因超声引导无射线损伤、能有效避开主要胆管及血管、经济、操作简便等优点,优先选择超声引导,超声显示不清时选择CT引导。多角度重复B超或CT确定微波消融电极位置无误后,连接微波消融治疗仪及水循环冷却仪。微波频率2450 MHz,采用微波功率50~60 W、时间5~8 min。消融范围应超过肿瘤边缘0.5~1.0 cm,确保肿瘤组织充分坏死。病灶直径≤3 cm,单根电极消融即可;病灶直径>3 cm,考虑到2根微波电极同时消融且保持有效距离,2个电极热场相互叠加,形成更大的凝固坏死范围[1],采用同时植入双电极消融,电极之间距离选择不超过1.5 cm。术后5~7 d行超声造影或强化CT检查,如果消融不完全[强化CT显示病灶周边呈现较病灶中央(消融完全)密度较高影]再次补充消融,若影像学检查提示再次消融仍达不到完全消融或可能出现较严重并发症者放弃再次消融治疗,选用其他治疗方法。手术组:全身麻醉,开腹手术,根据肿瘤情况采用规则性肝切除或不规则性肝切除,完全切除肉眼所见肿瘤,术后病理示切缘无残留肿瘤,达到根治性切除。2组术前或术后均应用FOLFOX、XELOX方案辅助化疗。
1.3 疗效评价
1.3.1 影像学评价首先采用增强CT评价疗效,消融病灶或切除周边无强化为消融完全或切除完全。对增强CT评价存在异议病灶再采用MRI或超声造影进一步评价疗效。术后4周左右复查,以后每3~6个月复查1次。
1.3.2 随访观察每月B超、肝功能检查,每3个月行增强CT或MRI检查。随访时间3~40个月。随访患者肝转移病灶及原发病灶控制情况,无进展时间及生存时间,术中、术后并发症。
1.3.3 并发症一般分为轻度并发症和重度并发症[2]。轻度并发症:A级,无须治疗,无不良后果;B级,需要少许治疗,无不良后果,包括仅需12 h的医学观察。重度并发症:C级,需要治疗,住院时间延长<48 h;D级,需要大量治疗,增加医护级别,住院时间延长>48 h;E级,导致较长时间的后遗症;F级,死亡。
1.4 统计学处理
采用统计学SPSS 17.0统计软件包进行数据处理,正态分布的计量资料用x±s表示,采用独立样本t检验,计数资料采用χ2检验。2组无病生存期(disease-free survival,DFS)和生存率比较采用log-rankχ2检验,并绘制Kaplan-Meier曲线。P<0.05为差异有统计学意义。
2 结果
2.1 影像学评价局部疗效
消融组28例42个肝转移病灶首次MA治疗达到完全消融有22例36个病灶,其中18例(24个病灶)肿瘤直径<3.0 cm首次完全消融率83.3% (15/18),10例(12个病灶)肿瘤直径3.0~5.0 cm首次完全消融率70.0%(7/10);未达到完全消融6例经补充消融术均达到完全消融。在首次不完全消融的病灶中,3例因病灶位于较大的门静脉与肝动脉分支处而未能获得首次完全消融;2例因病灶形态不规则;1例因病灶靠近胆囊,为保护胆囊首次消融时间短,未达到首次完全消融。手术组出血量200~2100 ml,(801.4±125.9)ml;手术时间180~360 min,(234.3±102.3)min。1个月后常规强化CT示25例肿瘤切除完全,9例CT显示手术切缘不清,MRI显示均达到完全切除。
2.2 并发症
消融组未发生严重并发症,手术组≥C级并发症9例,发生率26.5%(9/34),消融组显著低于手术组(Fisher's检验,P=0.003)。消融组术中疼痛18例,其中3例术中应用吗啡10 mg肌注,其余患者均可耐受至治疗结束;迷走神经兴奋1例,术中出现心率下降,给予阿托品0.5 mg皮下注射,待生命体征平稳后完成治疗;1例白细胞11.2×109/L且中性粒比值81%,伴有发热,抗感染对症处理后恢复正常;13例AST、ALT较术前升高1.5~2.5倍,加强保肝治疗1周后逐渐恢复。手术组胸腔积液4例,肝周积液2例,经输注人血白蛋白,调整电解质平衡,使用利尿剂后逐渐消退;肝周脓肿1例,超声引导下脓肿引流灌洗后逐渐消失;胆管炎及切口感染各1例,加强抗感染治疗后好转。2组患者住院时间、费用比较见表2。

表2 2组住院时间、治疗费用的比较(x±s)
2.3 2组术后无病生存率和生存率比较
消融组与手术组累积无病生存率无统计学差异(log-rankχ2检验:χ2=2.010,P=0.156),Kaplan-Meier曲线见图1;消融组与手术组累积生存率差异无统计学意义(log-rankχ2检验:χ2=0.307,P= 0.580),Kaplan-Meier曲线见图2。
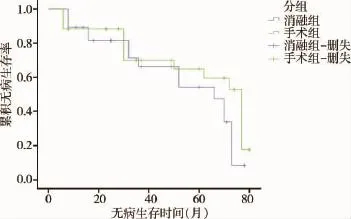
图1 消融组与手术组无病生存率比较的Kaplan-Meier曲线
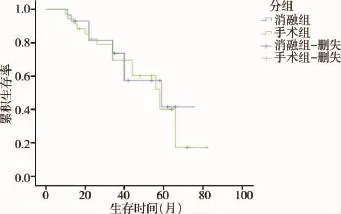
图2 消融组与手术组生存率比较的Kaplan-Meier曲线
3 讨论
结直肠癌在全世界的发病率处于恶性肿瘤第3位[3],我国结直肠癌的发病率和病死率均保持上升趋势,且逐步呈现年轻化,3/4的患者确诊时已属于晚期[4,5]。肝脏是结直肠癌最常见转移部位,且结直肠癌的肝转移是影响结直肠癌预后的重要因素之一,也是导致患者死亡的主要原因[6]。肝转移癌自然生存时间短,且预后较差,既往被认为晚期而放弃治疗[7]。结直肠癌肝转移行手术切除后可使5年生存率达到30%~50%,手术切除仍是肝转移癌唯一获得长期生存的治疗措施[8];未能手术切除的结肠癌伴肝转移患者自然生存期为3~7个月,中位生存期为6个月[9],应用全身化疗中位生存期为9个月。有20%~25%的患者适合手术治疗,即使肝转移瘤能达到R0切除,术后2年复发率高达50%~70%[10,11]。
MA主要机制是利用微波的热效应和肿瘤不耐热的特性,使肿瘤组织发生凝固性坏死,同时破坏肿瘤血供,达到原位灭活或局部根治的目的。微波除热凝固效应外,还有增强机体免疫功能的作用[12]。临床前瞻性随机对照和回顾性比较研究的结果均显示,局部消融治疗(主要是RFA或MA)可获得与手术切除治疗小肝癌相近的远期生存疗效[13]。对于结直肠癌肝转移灶,MA有望成为肿瘤综合治疗的有效手段。Shibata等[14]对30例大肠癌肝转移行腹腔镜MA(14例)和传统手术治疗(16例),手术组1、2、3年累积生存率分别为71%、57%、14%,MA组分别为69%、56%、23%,他们认为MA是大肠癌肝转移的一种新选择。随着消融技术成熟及消融设备的不断完善,特别2004年以来,硬质裂隙水冷式消融电极问世,使MA具有穿刺更简便、中心碳化区减少、消融范围更大、凝固形态更规则。MA能否替代手术切除成为晚期结直肠癌肝转移的首选治疗手段已经成为该领域的研究热点之一[15~18]。
本研究通过回顾性分析晚期结直肠癌肝转移患者接受MA与手术切除为主的综合治疗疗效,结果显示2组DFS、生存率差异均无统计学意义(P>0.05),但2组住院时间、重度并发症发生率、住院费用有统计学差异(P<0.05)。由于MA比手术切除微创、重复性好、操作简便、节约医疗资源、更经济,为一部分患者提供了新的治疗方法。本研究选取的转移灶直径≤5 cm,主要考虑由于肿瘤直径5 cm是一个公认的分水岭,由于本研究旨在探讨肝转移灶≤5 cm患者MA治疗的作用与地位,因此,在制定纳入标准时主要参考目前MA适应证。
是否MA可取代手术切除结直肠癌肝转移,由于不同消融设备,病例选择和疗效评价标准不一致,文献报道结果差异较大,随访时间短,缺乏系统的资料,远期疗效更有待于进一步观察和研究。随着肿瘤治疗理念的转变、临床治疗模式的发展,局部消融治疗结直肠癌肝转移可能成为有效的治疗手段之一。本研究为回顾性分析,且病例数少,说服力固然欠佳,但可为以后开展前瞻性随机对照研究提供有意义的参考。
1梁萍,董宝玮,于晓玲,等.双电极植入式微波辐射三维热场的研究.中华超声影像学杂志,1999,8(4):255-258.
2陈敏山,陈敏华.原发性肝癌局部消融治疗的专家共识.临床肿瘤学杂志,2011,16(1):70-73.
3 Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014.CA Cancer J Clin,2014,64(1):9-29.
4 Chen WQ,Zeng HM,Zheng RS,et al.Cancer incidence and mortality in china,2007.Chin J Cancer Res,2012,24(1):1-8.
5 Chalya PL,McHembe MD,Mabula JB,et al.Clinicopathological patterns and challenges of management of colorectal cancer in a resource limited setting:a Tanzanian experience.World J Surg Oncol,2013,11:88.
6 Parkin DM.Global cancer statistics in the year 2000.Lancet Oncol,2001,2(9):533-543.
7方桦,王兴元,王金万,等.300例结直肠癌肝转移患者的临床预后分析.中华肿瘤杂志,2009,31(3):220-222.
8梁建伟,周志祥.伴远处转移结直肠癌的外科治疗.中国医刊,2007,42(6):9-11.
9 Schiesser M,Chen JW,Maddern GJ,et al.Perioperative morbidity affects long-term survival in patients following lover resection for colorectal metastases.J Gastrointest Surg,2008,12(6):1054-1060.
10周皎琳,邱辉忠.结直肠癌肝转移的治疗现状及进展.癌症进展杂志,2005,3(3):243-248.
11张亮,王立刚,范卫军,等.CT引导下水循环冷却式微波刀消融治疗结直肠癌肝转移瘤.当代医学,2009,15(11):169-172.
12马宽生.肝癌微创治疗的疗效评价.中国微创外科杂,2005,5 (2):88-90.
13樊嘉,王征.原发性肝癌综合治疗新进展.国际肿瘤学杂志,2013,33(2):73-74.
14 Shibata T,Niinobu T,Ogata N,et al.Microwave coagulation therapy for multiple hepatic metastases from colorectal carcinoma.Cancer,2000,89(2):276-284.
15姚全军,黎海亮,郭晨阳,等.CT引导微波治疗难治性结直肠癌肝转移的临床研究.实用医学杂志,2012,28(15):2565-2567.
16刘英俊,郑云,蒋怡洲,等.超声引导下微波消融治疗肝转移癌38例.中国普外科学文献(电子版),2011,5(5):6-8.
17柯文波,李民,熊俊,等.不能手术切除的结直肠癌肝转移微波消融治疗体会.中国医刊,2011,46(10):61-63.
18金仲田,彭志润,朱卫华,等.超声引导下经皮微波消融治疗肝转移癌的临床疗效分析.中国普外基础与临床,2010,17(3):29-32.
Microwave Ablation Versus Surgical Resection of Colorectal Cancer Liver Metastasis:Comparison of Clinical Efficacy
Song Pengyuan,SunYahong,GuoYa,etal.Fifth
DepartmentofInternalMedicine,AffiliatedHospitalofShandongAcademyofMedical Sciences,Jinan250031,China
:SunYahong,E-mail:sunyahong0915@163.com
ObjectiveTo compare the efficacy of microwave ablation(MA)and surgical resection of colorectal cancer liver metastasis.MethodsA retrospective analysis was made on 62 cases of colorectal cancer liver metastasis from October 2010 to February 2014,including 28 cases of MA treatment and 34 cases of surgical resection.Comparison was conducted between the two groups on disease-free survival(DFS),overall survival(OS),severe complications,hospitalization time and expenses.ResultsThe hospitalization time in the MA group(5.9±0.9 d)was significantly shorter than that in the surgery group(11.8±6.9 d,t= -4.487,P=0.001).In the MA group,the costs of treatment was 29000±5000yuan,which was significantly less than that in the surgery group(55000±8000yuan,t=14.949,P=0.000).No severe complications occurred in the MA group,which was significantly less than that in the surgical group(9/34,26.5%,P=0.003).No significant difference was found in DFS(χ2= 2.010,P=0.156)or OS(χ2=0.307,P=0.580)between the two groups.Conclusions MA for colorectal cancer liver metastasis is a minimally invasive,economical,safe and effective method.Its therapeutic effect is comparable to surgery treatment.
Microwave ablation;Surgical resection;Colorectal cancer;Liver metastasis
R735
A
:1009-6604(2015)10-0887-04
10.3969/j.issn.1009-6604.2015.10.007
2015-01-11)
(
2015-04-23)
(责任编辑:李贺琼)
山东省医学科学院面上项目(2012)年第6号
**通讯作者,E-mail:sunyahong0915@163.com
①(山东省肿瘤医院肿瘤科,济南250031)
