JAK2/STAT3信号通路介导小鼠骨性关节炎中软骨细胞代谢和抗氧化应激的研究
2015-04-28李旭升李慎松常彦峰高展望张航向
刘 军,甄 平,李旭升,李慎松,田 琦,常彦峰,高展望,张航向,陈 慧*
(1兰州军区兰州总医院全军骨科中心,兰州 730050;2第四军医大学西京医院老年病科,西安 710032)
骨性关节炎(osteoarthritis,OA)是以局部关节疼痛、肿胀、畸形为临床特征,致使患者活动能力受限的慢性关节软骨退行性病变[1],可导致软骨下骨质增生,进而严重影响日常工作和生活。其在>65岁的老年人中发病率日趋增高,据世界卫生组织(World Health Organization,WHO)报道,65~70岁的老年人OA的患病率接近62%,>70岁的人群中接近70%[2]。我国老龄化社会的快速到来将使我国成为世界上OA患病人数最多的国家之一。随着医疗技术的发展和全民医保的覆盖,OA患者的生活和生存状况更加受到重视。持续的软骨细胞凋亡、滑膜炎和骨破坏等致使OA患者病情进行性加重,面临的选择只有人工膝关节表面置换手术。
Janus酪氨酸蛋白激酶/信号转导子和转录激活子蛋白(Janus activated tyrosine kinase/signal transducer and activator of transcription,JAK/STAT)是近年来发现的重要的细胞内信号转导通路家族。JAK家族成员包括JAK1、JAK2、JAK3、和酪氨酸激酶2(tyrosine kinase 2,TYK2),主要存在于人体细胞质中,与同在细胞质中的STAT家族的7个成员(包括STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6)共同参与炎症反应、氧化应激、细胞损伤和凋亡等密切相关的重要通路[3]。
本实验主要通过JAK2/STAT3信号通路与OA中软骨细胞凋亡的相关性以及其对软骨细胞线粒体抗氧化应激能力影响的研究,为临床中西医治疗OA提供新的思路和依据。
1 材料与方法
1.1 药品和试剂
C57BL/6小鼠(雄性,10只,体质量10.25~15.70g,平均12.55g)由第四军医大学动物实验中心提供;还包括SC-39100(JAK2/STAT3通路激动剂)、二甲基亚砜(dimethylsulfoxide,DMSO)、胰蛋白酶(Sigma-Aldrich公司,美国);蛋白酶抑制剂、p-JAK2抗体、p-STAT3抗体、β-激动蛋白(β-actin)抗体(Santa Cruz公司,美国);下丘脑调节性多肽(hypothalamic regulatory peptides,HRP);羊抗小鼠、羊抗兔和兔抗羊IgG二抗(北京中杉金桥公司);改良Eagle培养基(Dulbecco’s modified eagle medium,DMEM)低糖培养液(Hyclone公司,美国);胎牛血清(fetal bovine serum,FBS,杭州四季青公司);无血清细胞冻存培养基(RPMI1640;Gibco公司,美国);RIPA蛋白质裂解液(Promab公司,美国);蛋白上样缓冲液(上海碧云天生物公司);线粒体提取盒(武汉博士德生物公司)。
1.2 实验小鼠骨性关节炎模型制备
将10只小鼠随机分为两组,每组5只。任选一组小鼠腹腔麻醉后,乙醇消毒,于解剖显微镜下进行无菌手术操作。用眼科剪沿膝关节内侧纵向剪开皮肤、黏膜(避免剪断附着于黏膜上的血管),使内侧副韧带暴露;换用维纳斯剪在视野中央的内侧副韧带做一小切口,在内侧副韧带切口处划断半月板上下缘的关节囊,用神经剥离子钩出内侧半月板并剪断,切口留下剪断的内侧副韧带及半月板;消毒后依次进行缝合作为实验组(OA模型组),另外1组5只正常生长的小鼠做为对照组。3周后同时脱颈处死OA模型组和对照组小鼠,并分别提取两组膝关节组织待用。
1.3 软骨细胞提取及培养
将分别分离的两组小鼠的膝关节滑膜组织置于培养瓶中,再分别放置于1mg/ml胶原酶Ⅰ的HEPES液(4-羟乙基哌嗪乙磺酸、MgSO40.8mmol/L、NaCl 116.0mmol/L、KC1 5.4mmol/L、NaH2PO410.0mmol/L、葡萄糖5.1mmol/L,pH7.3)中消化,重复消化3次,每次3~5min。用含10%血清的DMEM溶液终止消化,置于低速离心机中以1000转/min进行离心5min。弃去上清液,用含10%血清和0.01mmol/L的DMEM溶液重悬细胞。用筛网(200目)过滤没有贴壁的细胞,去除未消化的组织块。收集过滤的细胞悬液,进行细胞计数,按照实验要求种入不同的培养瓶或者培养板中。
1.4 实验细胞分组
对照组和实验组(OA模型组)分别取对数生长期细胞,以每孔2×105/ml接种于多聚赖氨酸包被的96孔板中,于37℃、5%CO2培养箱中进行孵育,24h内细胞达到80%~90%融合后,用含体积分数0.01%FBS的DMEM孵育细胞24h,使细胞同步化。观察JAK2/STAT3通路各指标在上述两组中的表达,并在两组中加入JAK2/STAT3通路激动剂以观测相关指标的变化;同时观察两组小鼠线粒体氧化应激指标表达情况。本实验共分为4组:对照组(细胞取自正常生长小鼠);OA模型组(细胞取自实验组小鼠);OA模型+SC-39100组(细胞取自实验组小鼠加SC-39100激动剂);对照+SC-39100组(细胞取自正常生长小鼠加SC-39100激动剂)。
1.5 蛋白印迹法检测p-JAK2、p-STAT3、Bcl2、Bax蛋白表达
将裂解后的细胞悬液置于4℃低温离心机中离心15min,12 000转/min。取离心后上清液,一部分用二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白定量,另一部分按照4∶1的体积比加入上样缓冲液,沸水中煮7min。蛋白印迹法(Western blotting)检测的具体方法为取30µg总蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,并电转移至硝酸纤维素膜(nitrocellulose membrane,NC膜)上。根据预染Marker提示,将NC膜按照分子量剪成不同条带,用含有p-JAK2、p-STAT3、Bcl-2蛋白、Bax蛋白和β-actin(1∶1000)一抗的洗涤缓冲液(Tris buffered saline with Tween,TBST)4℃孵育过夜。过夜后,用TBST溶液摇床洗3次,每次10min。然后用1:5000的对应二抗孵育条带2h。再次TBST摇床洗3次后用电化学发光(electrochemical luminescence,ECL)液进行曝光显影,Bio-Rad照相系统拍照,并用所带电脑软件进行条带灰度值的分析。
1.6 Western blotting检测琥珀酸脱氢酶、细胞色素c氧化酶蛋白表达
分别用线粒体提取试剂盒提取不同实验分组的线粒体,再用Western blotting检测线粒体氧化应激指标琥珀酸脱氢酶(succinate dehydrogenase,SDH)和细胞色素c氧化酶(cytochromec oxidase,COX),方法同1.5。
1.7 线粒体中丙二醛的测定
软骨细胞接种、用药处理步骤同1.3及1.4项。以0.25%的胰酶消化、收集细胞,待超声波打碎细胞后,根据试剂盒说明书加入检测试剂,用721分光光度计测定吸光度值(A),用考马斯亮蓝法进行蛋白质定量测定,校正计算丙二醛(malondialdehyde,MDA)的含量及活性。
1.8 统计学方法
采用SPSS16.0统计学软件进行统计分析,所有实验数据均以±s 表示,计量资料采用t检验进行组间比较。P<0.05表示差异具有统计学意义。
2 结 果
2.1 检测各组软骨细胞p-JAK2、p-STAT3表达水平
与对照组比较,OA模型组p-JAK2和p-STAT3的表达水平偏低(P<0.05),表明OA模型组中JAK2/STAT3信号通路受到抑制;与OA模型组比较,OA+SC-39100组可显著增加p-JAK2和p-STAT3的表达水平(P<0.05);对照+SC-39100组与OA+SC-39100组比较,p-JAK2和p-STAT3的表达水平偏低(P<0.05);对照+SC-39100组与对照组比较,两组p-JAK2和p-STAT3的表达水平差异无统计学意义(P>0.05;图1,图2)。
2.2 检测各组软骨细胞Bcl-2蛋白表达水平
与对照组比较,OA模型组Bcl-2蛋白的表达水平偏低(P<0.05),表明OA模型组中软骨细胞凋亡水平增高;与OA模型组比较,OA+SC-39100组可显著增加Bcl-2蛋白的表达水平(P<0.05),表明加入JAK2/STAT3信号通路激动剂后,抑凋亡水平升高;对照+SC-39100组与OA+SC-39100组比较,Bcl-2蛋白的表达水平偏低(P<0.05);对照+SC-39100组与对照组比较,两组Bcl-2蛋白的表达水平差异无统计学意义(P>0.05,图3)。
2.3 检测各组软骨细胞Bax蛋白表达水平
与对照组比较,OA模型组Bax蛋白的表达水平偏高(P<0.05),表明OA模型组中软骨细胞凋亡水平增高;与OA模型组比较,OA+SC-39100组的Bax蛋白的表达水平降低,差异有统计学意义(P<0.05),表明SC-39100可显著降低Bax蛋白的表达水平,抑制软骨细胞凋亡;OA+SC-39100组与对照+SC-39100组比较,Bax蛋白的表达水平偏高,差异有统计学意义(P<0.05);对照+SC-39100组与对照组比较,两组Bax蛋白的表达水平差异无统计学意义(P>0.05,图4)。

图1 各组软骨细胞p-JAK2的表达水平Figure 1 The expression of p-JAK2 in cartilage cells of each group
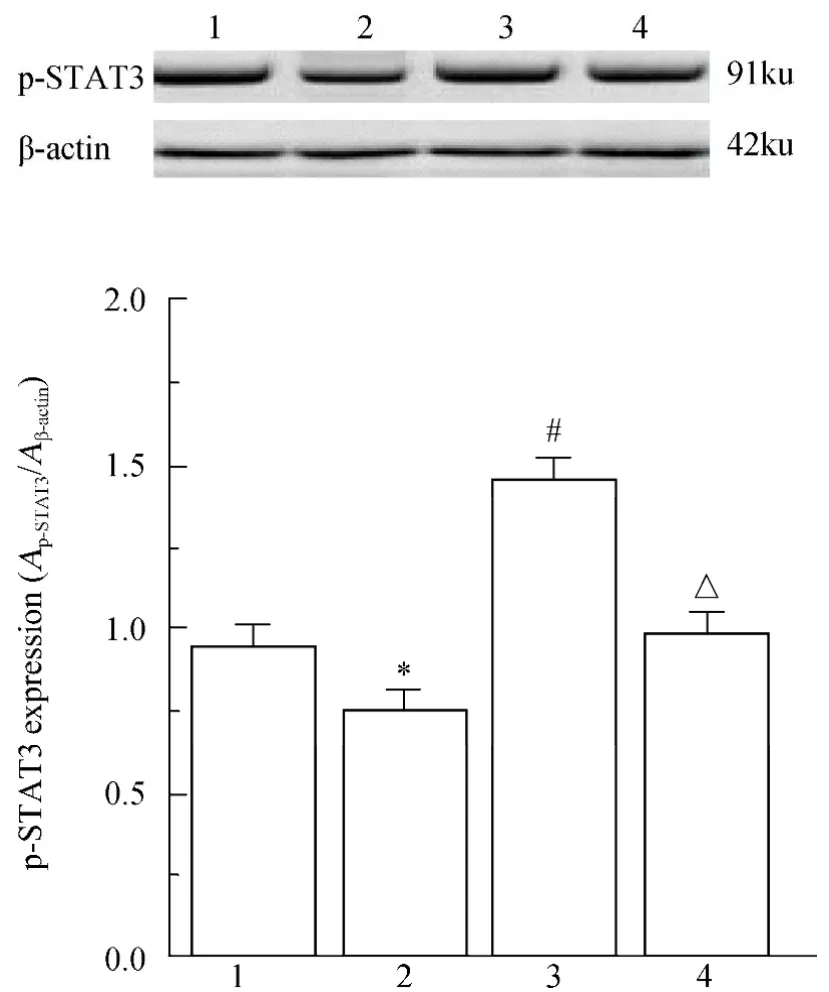
图2 各组软骨细胞p-STAT3的表达水平Figure 2 The expression of p-STAT3 in cartilage cells of each group

图3 各组软骨细胞Bcl-2蛋白的表达水平Figure 3 The expression of Bcl-2 in cartilage cells of each group
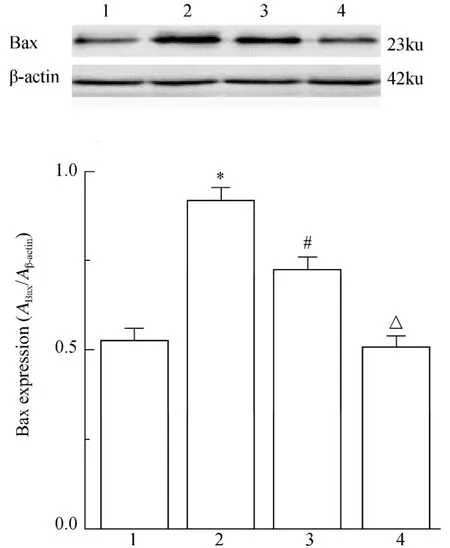
图4 各组软骨细胞Bax蛋白的表达水平Figure 4 The expression of Bax in cartilage cells of each group
2.4 检测各组软骨细胞线粒体中SDH和COX表达水平
与对照组比较,OA模型组SDH和COX的表达水平偏低(P<0.05),表明OA模型组中线粒体抗氧化应激能力下降;与OA模型组比较,OA+SC-39100组SDH和COX的表达水平显著增加(P<0.05),提示加入JAK2/STAT3信号通路激动剂后,软骨细胞线粒体抗氧化应激能力提高;与OA+SC-39100组比较,对照+SC-39100组中SDH和COX的表达水平偏低(P<0.05);对照+SC-39100组与对照组比较,两组的SDH和COX的表达水平差异无统计学意义(P>0.05;图5,图6)。
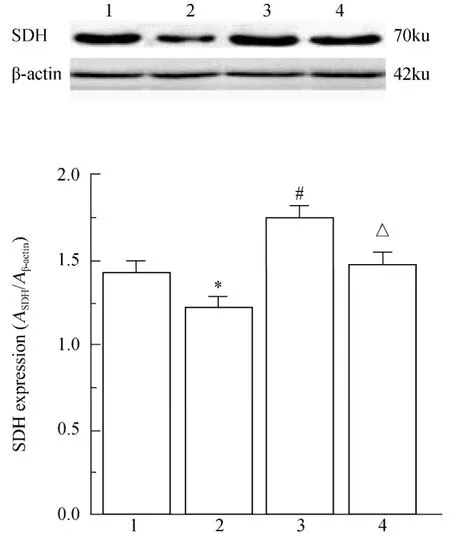
图5 各组软骨细胞线粒体中SDH的表达Figure 5 The expression of SDH in cartilage cells mitochondria of each group

图6 各组软骨细胞线粒体中COX的表达水平Figure 6 The expression of COX in cartilage cells mitochondria of each group
2.5 测定各组软骨细胞线粒体MDA表达水平
与对照组比较,OA模型组的MDA含量偏高(P<0.05),表明OA模型组中线粒体氧化应激损伤增加;与OA模型组比较,OA+SC-39100组MDA的含量显著降低(P<0.05),提示加入JAK2/STAT3信号通路被激活后,软骨细胞线粒体氧化应激损伤受到抑制;OA+SC-39100组与对照+SC-39100组比较,OA+SC-39100组的MDA的含量偏高(P<0.05);对照+SC-39100组与对照组比较,MDA的含量差异无统计学意义(P>0.05;图7)。
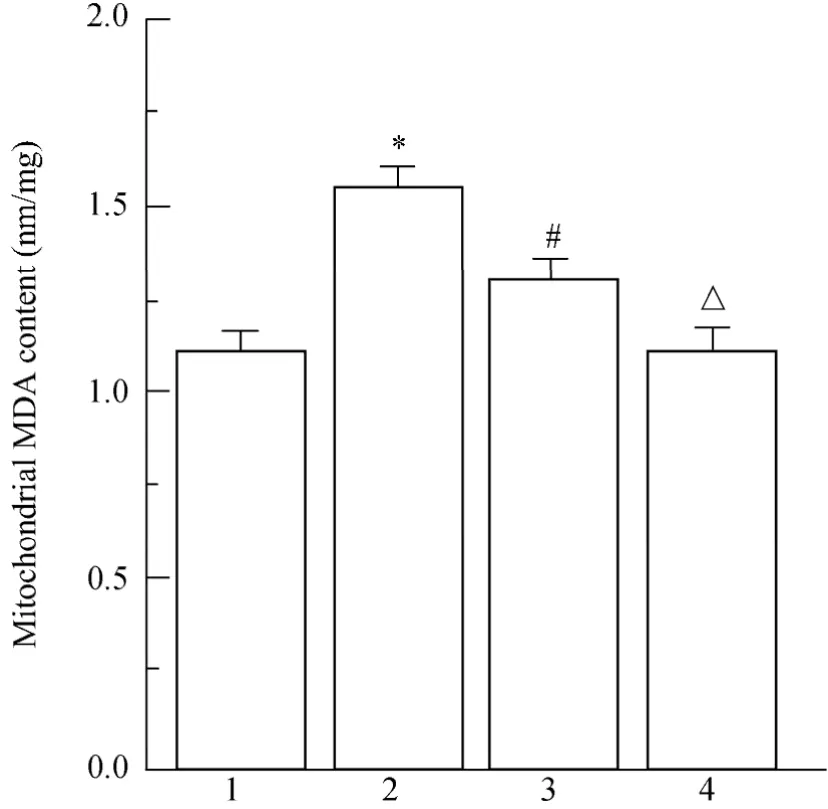
图7 各组软骨细胞线粒体MDA的含量Figure 7 The mitochondrial MDA content in cartilage cells of each group
3 讨 论
OA是一种严重影响老年人生活质量和危害老年人健康的慢性退行性骨关节疾病[4]。在全球最常见的三大老年性疾病——脑血管疾病、骨质疏松症和老年性骨关节病中位居首位[5]。随着老年人群的寿命延长和对生活质量要求的提高,OA已得到全社会的重视。我科近年来收治的大量OA患者中绝大多数唯一的治疗方式为单膝或双膝人工关节表面置换手术,因而,我们尝试从机制上对OA加以研究,以期为探索OA的发生发展和临床治疗提供新的解决思路。
本实验中我们建立小鼠OA模型后,进行软骨细胞分组检测JAK2/STAT3信号通路相关指标p-JAK2、p-STAT3,细胞凋亡指标Bcl-2蛋白、Bax蛋白以及线粒体氧应激指标SDH和COX,发现与对照组相比,OA模型组中p-JAK2和p-STAT3表达偏低(P<0.05);但当加入JAK2/STAT3信号通路激动剂SC-39100后,OA+SC-39100组中p-JAK2和p-STAT3表达增高,与对照组和OA模型组比较均有统计学意义(P<0.05)。与对照组相比,OA模型组中抑制凋亡的Bcl-2蛋白表达水平偏低(P<0.05),凋亡指标Bax蛋白表达水平偏高,表明OA模型组中软骨细胞凋亡明显;OA+SC-39100组中Bcl-2蛋白的表达增高、Bax蛋白的表达降低(P<0.05),提示激活后的JAK2/STAT3信号通路可抑制软骨细胞凋亡。SDH和COX均为抗氧化应激的指标,MDA为过氧化反应的氧化终产物,在OA模型组中,SDH和COX的表达均偏低(P<0.05),而MDA的含量偏高(P<0.05);在OA+SC-39100组中SDH和COX的表达增加(P<0.05),MDA的含量降低(P<0.05),表明JAK2/STAT3信号通路的活化可缓解软骨细胞氧化应激损伤,维持线粒体功能,有利于软骨细胞正常生长。
JAK/STAT信号通路家族对多种疾病的发生、发展过程有重要的调控作用[6]。Terrell等[7]发现炎症因子白细胞介素-6(interleukin-6,IL-6)通过活化JAK/STAT信号通路促进心肌肥厚。Park等[8]发现JAK/STAT信号通路介导了氧化应激引起的肺上皮细胞合成表面活性物质的减少。Wen等[9]发现抑制JAK/STAT信号通路可以减轻缺血-再灌注损伤(ischemia-reperfusion injury,IRI)引起的肠黏膜细胞损伤和凋亡。肾脏疾病研究中发现,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)间接激活JAK/STAT通路,促进肾小球系膜细胞增生,从而导致糖尿病性肾病[10]。阻断AngⅡ可阻止高血糖引起的JAK/STAT信号通路激活[11]。肝脏疾病的研究发现,STAT的活化对于抗肝炎病毒感染、控制炎症、修复损伤,和抗肿瘤发生都有重要意义[12]。临床研究发现,应用抗IL-6受体抗体抑制STAT3的激活可改善类风湿性关节炎(rheumatoid arthritis,RA)的炎症反应[13]。IL-l0通过STAT3转导信号以发挥作用于巨噬细胞的抗炎作用[14]。Isomaki等[15]建立的RA动物模型研究报道STAT3功能失调会改变关节炎过程。
氧化应激损伤参与多种疾病的发展进程,可导致组织细胞损伤和死亡[16]。减轻氧化应激损伤可以改善细胞功能状态,有利于细胞生长、增殖[17]。线粒体氧化损伤包括通透性改变、肿胀、氧化磷酸化解耦联以及促凋亡蛋白的释放[8]。近来的研究证实JAK2/STAT3信号通路的激活或抑制对氧化应激损伤和线粒体功能有显著影响[18]。
综上所述,OA的渐进性发展过程与JAK2/STAT3信号通路存在密切联系,选择特异性阻断JAK2/STAT3信号通路是否是一个可行的防治OA的手段,值得我们进一步探索研究。
【参考文献】
[1]Iriberri I,Candrian C,Freehill MT,et al.Anatomic shoulder replacement for primary osteoarthritis in patients over 80 years[J].Acta Orthop,2015,86(3):298-302.
[2]Monfoulet LE,Philippe C,Mercier S,et al.Deficiency of G-protein coupled receptor 40,a lipid-activated receptor,heightensin vitro- andin vivo-induced murine osteoarthritis[J].Exp Biol Med(Maywood),2015,Jan 13.pii:1535370214565078.
[3]Luan HF,Zhao ZB,Zhao QH,et al.Hydrogen sulfide postconditioning protects isolated rat hearts against ischemia and reperfusion injury mediated by the JAK2/STAT3 survival pathway[J].Braz J Med Biol Res,2012,45(10):898-905.
[4]Yaligod V,Raj DG,Sharma AB,et al.Dual release paracetamol in osteoarthritis of knee:a randomized controlled clinical trial[J].J Clin Diagn Res,2014,8(11):LC11-LC15.
[5]Balmaceda CM.The impact of ethnicity and cardiovascular risk on the pharmacologic management of osteoarthritis:a US perspective[J].Postgrad Med,2015,127(1):51-56.
[6]Das A,Salloum FN,Durrant D,et al.Rapamycin protects against myocardial ischemia-reperfusion injury through JAK2-STAT3 signaling pathway[J].J Mol Cell Cardiol,2012,53(6):858-869.
[7]Terrell AM,Crisostomo PR,Wairiuko GM,et al.JAK/STAT/SOCS signaling circuits and associated cytokine-mediated inflammation and hypertrophy in the heart[J].Shock,2006,26(3):226-234.
[8]Park SK,Dahmer MK,Quasney MW.MAPK and JAK-STAT signaling pathways are involved in the oxidative stress-induced decrease in expression of surfactant protein genes[J].Cell Physiol Biochem,2012,30(2):334-346.
[9]Wen SH,Li Y,Li C,et al.Ischemic postconditioning during reperfusion attenuates intestinal injury and mucosal cell apoptosis by inhibiting JAK/STAT signaling activation[J].Shock,2012,38(4):411-419.
[10]Mondal G,Barui S,Saha S,et al.Tumor growth inhibition through targeting liposomally bound curcumin to tumor vasculature[J].J Control Release,2013,172(3):832-840.
[11]Saydmohammed M,Joseph D,Syed V.Curcumin suppresses constitutive activation of STAT-3 by up-regulating protein inhibitor of activated STAT-3(PIAS-3)in ovarian and endometrial cancer cells[J].JCell Biochem,2010,110(2):447-456.
[12]Guarani V,Deflorian G,Franco CA,etal.Acetylation-dependent regulation of endothelial Notch signalling by the SIRT1 deacetylase.[J].Nature,2011,473(7346):234-238.
[13]Palanivel JA,Macbeth AE,Chetty NC,et al.An insight into JAK-STAT signalling in dermatology[J].Clin Exp Dermatol,2014,39(4):513-518.
[14]Norman P.Selective JAK Inhibitors in development for rheumatoid arthritis[J].Expert Opin Investig Drugs,2014,23(8):1067-1077.
[15]Isomäki P,Junttila I,Vidqvist KL,et al.The activity of JAK-STAT pathways in rheumatoid arthritis:constitutive activation of STAT3 correlates with interleukin 6 levels[J].Rheumatology(Oxford),2015,54(6):1103-1113.
[16]Schmeisser H,Bekisz J,Zoon KC.New function of typeⅠ IFN:induction of autophagy[J].J Interferon Cytokine Res,2014,34(2):71-78.
[17]Jonchère B,Bélanger A,Guette C,et al.STAT3 as a new autophagy regulator[J].JAKSTAT,2013,2(3):e24353.
[18]Gao B,Wang H,Lafdil F,et al.STAT Proteins-key regulators of anti-viral responses,inflammation,and tumorigenesis in the liver[J].J Hepatol,2012,57(2):430-441.
