肉瘤中 FGFR 信号通路研究进展
2015-04-25周文雅王国文杨蕴杨吉龙
周文雅 王国文 杨蕴 杨吉龙
肉瘤是来自于神经、肌肉、脂肪和骨骼等间叶组织的少见的恶性肿瘤,它可以发生于全身各处,尤其好发于肢体深部组织。在成人恶性肿瘤中肉瘤只占 1%,而在儿童肿瘤中占 21%[1]。在肉瘤中,软组织肉瘤占肉瘤的大部分,原发恶性骨肿瘤只占 10% 左右[2]。由于这种疾病发病率低,亚型繁多,加上疾病进展迅速和病灶易复发转移而导致预后不良。另外,传统的治疗方式如手术、化疗和放疗等对肉瘤效果有限,因此新的治疗方式如靶向治疗等逐渐开展并取得一定的成功,如帕唑帕尼、舒尼替尼、克唑替尼等靶向药物在肉瘤中得到应用[3-4]。成纤维细胞生长因子 ( fibroblast growth factor,FGF ) 和成纤维细胞生长因子受体 ( fibroblast growth factor receptor,FGFR ) 信号通路在调节正常细胞的生长、存活、分化以及新生血管等一系列的生理过程中起着重要的作用,同时也在肿瘤的发展中起着一定的作用[5-6]。因此,研究 FGF / FGFR 在肿瘤演进中的作用将有助于针对 FGFR 的靶向治疗药物的开发[5]。现就 FGF / FGFR 家族、FGFR 信号通路、肉瘤中 FGFR 的研究进展和肉瘤中 FGFR 抑制剂的研究现状概述如下。
一、FGFs
FGFs 几乎在所有组织中均有表达,可通过刺激多种间叶和上皮细胞的有丝分裂参与生长发育、伤口愈合和肿瘤新生物的形成[7]。迄今为止,已经发现了 23 种FGF,其中有 18 种 ( FGF1-10 和 16-23 ) 是促有丝分裂的信号分子,都能与 FGFR 结合。生理状态下,FGFRs 与FGFs 的结合需要硫酸乙酰肝素蛋白多糖 ( heparan sulfate proteoglycans,HSPG ) 参与,HSPG 可以促进 FGFRs 二聚体的形成同时保护配体不被降解[8]。
FGFs 促进肿瘤的形成主要是通过与 FGFR 受体特异性结合后激活了特异性 FGFR 信号通路起作用的。目前发现的与人类肿瘤有关的 FGFs 包括 FGF-1,-2,-3,-4,-5,-10,-17,-18,-19[7]。有研究表明 FGF-1 ( 酸性FGF ) 和 FGF-2 ( 碱性 FGF ) 及其受体,可以通过自分泌和旁分泌途径促进恶性肿瘤的生长[7,9]。其中,FGF-2 在多种恶性肿瘤中均有涉及如乳腺癌、胰腺癌、非小细胞肺癌、膀胱癌、头颈部肿瘤、前列腺癌、肝细胞癌、恶性黑色素瘤以及星形细胞瘤[10-18]。而目前在恶性肿瘤中关于FGF-11,-16 的研究甚少。
二、FGFRs
典型 FGFR 蛋白包括细胞外配体结合区域、跨膜区和细胞内的酪氨酸激酶区三部分,其中细胞外区包含 3 个免疫球蛋白 ( Ig ) 样区,而细胞内区是细胞内信号传导的区域。酸性盒子位于 Ig-I 和 Ig-II 之间,与 Ig-I 结合在受体自我抑制中起作用。Ig-II 和 Ig-III 组成了配体的结合位点[19]。FGFR 家族包括 4 个酪氨酸激酶受体 FGFR-1、-2、-3 和 -4,由于 Ig-III 样结构域的剪切体的不同使得FGFR 有 7 种不同的亚型 ( FGFR1b,FGFR1c,FGFR2b,FGFR2c,FGFR3b,FGFR3c 和 FGFR4 ),因此配体与受体结合特异性具有多样性[8,20]。每一种 FGFR 都可以被几种不同的 FGFs 激活,在多数情况下 FGFs 也可以激活多个FGF 受体,如 FGF-1 可以激活所有的 FGF 受体,但例外的是 FGF-7 只能激活 FGFR2b 一种受体[21-22]。
值得一提的是 FGFR-5 受体。研究发现 FGFR-5 蛋白 ( FGFR-5 基因编码 ) 与已知的 FGFRs 相比较缺少一个细胞内的酪氨酸激酶位点,且只有一种亚型 FGFR5γ,该亚型只包含 D1 和 D2 两个胞外结构域[23]。FGFR-5 曾被认为是一种诱骗受体可以抑制 FGFs 与其它 FGFRs 产生的生物学效应,然而 Silva 等的最新研究表明 FGFR-5 并不是一种诱骗受体,而是通过影响与配体有关和无关的细胞外调节蛋白激酶 1 / 2 ( ERK1 / 2 ) 信号通路的活性来起作用的[23-24]。
三、FGF / FGFR 信号通路 (图 1)
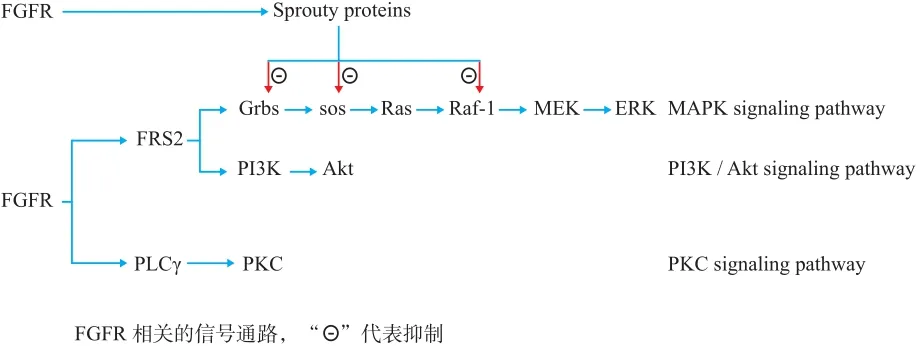
图1 FGF / FGFR 信号通路的作用机制模式图Fig.1 A model to depict the mechanism of FGF / FGFR signaling pathway
FGFRs 在 HSPGs 的协助下与 FGFs 结合使得自身磷酸化而被激活,激活的 FGFRs 又使细胞内激酶相互靠近,相互磷酸化,从而激活下游一系列的相关信号通路如磷脂肌醇 ( phosphatidylinositol signal pathway ) 和丝裂原活化蛋白激酶 ( mitogen-activated protein kinase,MAPK )、磷脂酰肌醇-3 激酶 / Akt ( phosphoinositide 3-kinase-Akt,PI3K / Akt ) 等信号通路,最终影响细胞的有丝分裂和分化[25]。参与促进 FGFR 信号通路调节的胞内蛋白包括磷脂酶 Cγ ( phospholipase Cγ,PLCγ )、成纤维生长因子受体底物 2 ( fibroblast growth factor receptor substrate2,FRS2 )、Src 同源结构域 2 / 含转化蛋白 B ( src homology 2 domaincontaining transforming protein B,Shb )、Src 酪氨酸激酶( Src tyrosine kinase )、磷酸化核糖体蛋白 S6 激酶 ( ribosome S6 protein kinase,RSK )、信号传导与转录活化因子 ( signal transducer and activator of transcription,STATs ) 和信号接头蛋白 ( CT10 regulator of kinase,Crk )[8,26]。有研究表明生长因子受体结合蛋白 2 ( GRB2 ) 可结合磷酸化的 FGR2 激活Ras / MAPK 信号通路和 PI3K 信号通路[26]。活化的 FGFRs能够通过一系列的信号转导发挥促进细胞增殖和调节凋亡及调节细胞迁移等作用[8]。激活的 FGFR 通过两种调节分子来调节信号的输出,一种是负调节分子如 Sprouty 蛋白,丝裂素活化蛋白激酶磷酸酶 3 ( MAPK phosphatase 33 )和 FGF 类似表达物 ( similar expression to FGF,Sef )[27-29]。Sprouty 蛋白可以通过与生长因子受体结合蛋白 2 ( growth factor receptor-bound protein 2,Grb2 ) 结合解耦联下游的FGF 信号通路[27]。SPRED2,是一个与 Sprouty 相关的蛋白,其与晚期内蛋白质 NBR1 [ 与 BRCA1 ( 乳腺癌 1 号基因 ) 相邻 ] 接触后通过促进 FGFRs 进入溶酶体内降解以减弱 FGF 信号通路的作用[30]。另外一种是正调节分子如FLRT3 ( 纤连蛋白富含亮氨酸的跨膜蛋白 3 ) 以及 FLRT1和 FLRT2,在小鼠模型中证实,几乎所有的 FLRTs 均可以与 FGFR1 相互作用,而 FLRTs 又能由 FGF2 激活的 FGF信号通路激活,共同参与小鼠胚胎的发育[31-32]。
四、肉瘤中 FGFR 信号通路的研究及其临床意义
1. 骨肉瘤:骨肉瘤是最常见的原发性骨肿瘤,其肺转移率高,预后差并且好发于儿童和青少年[33]。在骨肉瘤中已经发现了 FGFR-1、FGFR-2 和 FGFR-3 基因的突变[34]。另一项研究表明在 10 种骨肉瘤细胞系 ( OS229、OS232、OS231、OS238、OS242、OS252、OS290、OS293、OS308 和 OS311 ) 中均发现了 FGFR-2 和 FGFR-3受体的低表达[35]。研究发现在骨肉瘤罕见的组织类型中FGFR-1 的基因扩增的比例是不一致的,而且在治疗中对新辅助化疗治疗效果差的患者中有 18.5% 的患者检测到FGFR-1 基因的扩增,而在新辅助化疗治疗效果好的患者中均未检测到 FGFR-1 基因的突变,这意味着 FGFR-1 基因的状态也许是患者治疗效果好坏的一个因素,仍需要进一步的研究证实[36]。
2. 软骨肉瘤:软骨肉瘤是第二常见的原发性恶性骨肿瘤,由于其对化疗和放疗耐药,因此广泛手术切除目前是其惟一有效的治疗方式[37]。目前认为 FGF 和其受体FGFR 对软骨细胞的生长起负调节作用。Sahni 等[38]研究表明 FGFs 可以通过激活 STST1 来抑制软骨生长的,其中p21 在抑制软骨细胞的增殖中也发挥着一定作用。在兔软骨肉瘤细胞中发现 FGF2 能够抑制细胞周期 G1 期的进展从而抑制细胞的增殖,其作用机理至少部分是通过 p21 的诱导、细胞周期素 E-周期素依赖性激酶 2 蛋白的失活和pRB 蛋白的激活调节的[39]。此外,FGFR3 突变激活导致了软骨发育不全和相关的软骨发育[40]。有研究人员通过免疫组织化学技术,在 42 例低分化型,23 例透明细胞型和23 例间充质型软骨肉瘤组织中,均发现了 FGFR-3 的高表达以及 HSPG 结合位点的异常[41]。
3. 横纹肌肉瘤:横纹肌肉瘤是一种儿童常见的软组织肉瘤,常见的两种类型是胚胎性横纹肌肉瘤 ( eRMS ) 和腺泡状横纹肌肉瘤 ( aRMS )。最近有研究发现,7.5% 的 RMS中 FGFR-4 存在多个突变位点,其突变多聚集于激酶编码区,其中发现 N535K 和 V550E 两个位点的突变可以促进受体的自身磷酸化,在 RMS 中高表达的 FGFR4 与高临床分期和不良预后有关,但是实验证实 FGFR4 的高表达并不是由其基因的扩增导致的,具体的机制仍需进一步的研究[42]。在 eRMS 和 aRMS 两种类型的横纹肌肉瘤中均表达FGFR-4,但 aRMS 中表达较高。在体外实验中,aRMS 细胞中发现 FGFR-4 是抗凋亡蛋白 BCL2L1 表达所必须的,这点在 eRMS 细胞中却没有观察到,而 FGFR-4 功能的缺失均能抑制两种类型细胞的增殖。这意味着 FGFR-4 在横纹肌肉瘤的不同亚型中作用途径可能不同[43]。值得一提的是在横纹肌肉瘤中还发现有 FGFR1-FOXO1 融合基因的改变[44]。因此,FGFR-4 在 RMS 中可能起着致癌基因的作用,是治疗 RMS 的潜在靶点。
4. 脂肪肉瘤:脂肪肉瘤是一组异质性强的间质性肉瘤,包括四种亚型,分别是去分化脂肪肉瘤 ( DDLS ),黏液性脂肪肉瘤和多形性脂肪肉瘤及非特指的脂肪肉瘤。FRS2 是一种适配器蛋白,在 FGFR 信号通路中起着重要作用。多项研究显示脂肪肉瘤中 FRS2 存在基因的扩增及蛋白的高表达,且在 75% FRS2 阳性的高级别脂肪肉瘤中发现了 FGFR / FRS2 信号通路的激活,在三个高级别脂肪肉瘤细胞系 ( FU-DDLS-1、LiSa-2 和 SW872 ) 中也有类似的发现[45-46]。更重要的是利用 FGFR 选择性抑制剂 NVPBGJ-398 有效地抑制了其中两种细胞系的生长,同时也抑制了 FGFR 信号通路的传导。这些研究表明 FRS2 可能是治疗恶性脂肪肉瘤的一个重要靶点[46]。
5. 滑膜肉瘤:滑膜肉瘤是属于软组织的恶性肿瘤,主要发生于青壮年,其发生机制仍未知[2]。最近在滑膜肉瘤细胞系中发现多个 FGF 基因均有表达如 FGF-2,FGF-8,FGF-9,FGF-11 和 FGF-18,其中 FGF-8 在所有的细胞系均有促进生长的作用。研究表明在滑膜肉瘤中 FGF的生长刺激作用是通过细胞外调节蛋白激酶 ( extracellular regulated protein kinases 1 / 2,ERK1 / 2 ) 起作用,在滑膜肉瘤中 FGF2 信号分子可以诱发细胞外信号调节激酶( ERK1 / 2 ) 的磷酸化,使用 FGFR 抑制剂能引起了磷酸化的 ERK1 / 2 下调,而用 ERK 激酶抑制剂也能够抑制滑膜肉瘤的生长[47]。这些研究为滑膜肉瘤的发病机制提供了一定的理论基础。
6. 其它肉瘤:Girnita 等[48]发现 bFGF 信号通路通过上调 EWS / FLI-1 蛋白可以维持尤文氏肉瘤细胞的恶性表型。此外,在尤文氏肉瘤中 b-FGF 信号通路所诱导的细胞死亡与 p21 和 p53 蛋白的上调,PCNA 和 cyclin A 的下调以及激活的 pRb1 蛋白的减少有关[49]。在皮肤纤维瘤( DF ) 的上皮细胞区域发现了 FGFR-3,FGF-2 和 FGFR-4的过表达,而没有发现 FGF-1 和 FGF-9 的表达[50]。另外还有研究表明 FGF-2,单独或与血小板衍生生长因子( PDGF-B ) 和血管内皮生长因子受体 3 ( VEGFR-3 ) 一起参与血管生成过程,是广泛切除非胃肠道间质瘤软组织肉瘤的一个重要的独立的阴性的指标[51]。
五、FGFR 信号通路抑制剂及其在肉瘤中的应用
FGFR 信号通路的改变参与了多种恶性肿瘤和疾病的病理生理学过程,因此,FGFR 信号通路分子在疾病的靶向治疗中可能有一定的作用,如 FGFR 抑制剂如小分子受体抑制剂在肉瘤的靶向治疗有着较好的前景。最近的一项在纤维肉瘤移植的 C3H / HeN 老鼠模型中的研究表明异体的 MSC 通过 FGF2 / FGFRA 信号通路选择性的迁移到肿瘤部位,而在其它组织器官并没有发现 MSC,此外一氧化氮合成酶 ( iNOS ) 蛋白通过 MSC 载体能在一定程度上抑制体内、体外肿瘤的生长。Regorafenib ( BAY 73-4506,瑞格非尼 ),一种口服二苯脲多重激酶抑制剂靶向作用于 VEGFR1-3、TIE2、PDGFR-beta、FGFR 以及KIT、RET 和 RAF。目前,Regorafenib 在转移性软组织肉瘤的多国、随机、安慰剂对照的 II 期试验 ( REGOSARC,NCT01900743 ) 已经启动,该研究对象为至少接受过多柔比星 ( 或其它蒽环类 ) 1 个疗程的转移性软组织肉瘤患者。对于横纹肌肉瘤的患者来说,FGFR4 是一个好的治疗靶点,在最近的一个研究中发现 FGFR4 抑制剂 Ponatinib( AP24534 ) 可以通过增加细胞的凋亡来抑制表达野生型或突变型的 FGFR4 横纹肌肉瘤细胞系的生长,这在一个表达突变型 FGFR4 的横纹肌肉瘤的老鼠模型中得到验证。因此,Ponatinib ( AP24534 ) 可能是横纹肌肉瘤的一个可能有效的靶向治疗药物[52-53]。
总之,FGFRs 信号通路是通过 FGFs 与 FGFRs 相结合发挥作用的,其可以激活细胞内的多个信号通路如磷酸肌醇、MAPK 和 PI3K / Akt 等,这些信号通路相互作用参与细胞的生长、增殖、分化和血管生成等多方面的调节。近年来 FGFRs 信号通路在肿瘤中的研究日益增多,在肉瘤中越来越多的研究表明 FGFR 信号通路的改变不仅有基因水平的改变如基因突变等,还有蛋白水平的改变如蛋白的过表达和缺失等,这些改变与肉瘤的发生发展预后有着密切的关系。通过 FGFRs 在肉瘤发生发展过程中机理的揭示,为肉瘤的治疗提供了新思路,与 FGFRs 相关的治疗方法和药物有望为肉瘤患者的治疗带来新的希望。
[1] Burningham Z, Hashibe M, Spector L, et al. The epidemiology of sarcoma. Clin Sarcoma Res, 2012, 2(1):14.
[2] Christopher DM, Fletcher JAB, Pancras CW. Hogendoorn,Frodrik Mertens. WHO Classification of Tumours of Soft Tissue and Bone. 1 ed. Lyon: IARC, 2013.
[3] Patel SR. Fifty Years of Advances in Sarcoma Treatment:Moving the Needle from Conventional Chemotherapy to Targeted Therapy. Am Soc Clin Oncol Educ Book, 2014:259-262.
[4] Martin-Liberal J, Benson C, Judson I. New Drugs in Sarcomas.Expert Opin Pharmacother, 2014, 15(2):221-229.
[5] Korc M, Friesel RE. The Role of Fibroblast Growth Factors in Tumor Growth. Curr Cancer Drug Targets, 2009, 9(5):639-651.
[6] Wesche J, Haglund K, Haugsten EM. Fibroblast Growth Factors and Their Receptors in Cancer. Biochem J, 2011, 437(2):199-213.
[7] Kwabi-Addo B, Ozen M, Ittmann M. The Role of Fibroblast Growth Factors and Their Receptors in Prostate Cancer. Endocr Relat Cancer, 2004, 11(4):709-724.
[8] Beenken A, Mohammadi M. The Fgf Family: Biology,Pathophysiology and Therapy. Nat Rev Drug Discov, 2009,8(3):235-253.
[9] Takahashi JA, Fukumoto M, Igarashi K, et al. Correlation of Basic Fibroblast Growth Factor Expression Levels with the Degree of Malignancy and Vascularity in Human Gliomas.J Neurosurg, 1992, 76(5):792-798.
[10] Lindner V, Majack RA, Reidy MA. Basic Fibroblast Growth Factor Stimulates Endothelial Regrowth and Proliferation in Denuded Arteries. J Clin Invest, 1990, 85(6):2004-2008.
[11] Halaban R. Growth Factors and Melanomas. Semin Oncol,1996, 23(6):673-681.
[12] Bian XW, Du LL, Shi JQ, et al. Correlation of Bfgf, Fgfr-1 and Vegf Expression with Vascularity and Malignancy of Human Astrocytomas. Anal Quant Cytol Histol, 2000, 22(3):267-274.
[13] Relf M, LeJeune S, Scott PA, et al. Expression of the Angiogenic Factors Vascular Endothelial Cell Growth Factor,Acidic and Basic Fibroblast Growth Factor, Tumor Growth Factor Beta-1, Platelet-Derived Endothelial Cell Growth Factor,Placenta Growth Factor, and Pleiotrophin in Human Primary Breast Cancer and Its Relation to Angiogenesis. Cancer Res,1997, 57(5):963-969.
[14] Yamanaka Y, Friess H, Buchler M, et al. Overexpression of Acidic and Basic Fibroblast Growth Factors in Human Pancreatic Cancer Correlates with Advanced Tumor Stage.Cancer Res, 1993, 53(21):5289-5296.
[15] Berger W, Setinek U, Mohr T, et al. Evidence for a Role of Fgf-2 and Fgf Receptors in the Proliferation of Non-Small Cell Lung Cancer Cells. Int J Cancer, 1999, 83(3):415-423.
[16] Gazzaniga P, Gandini O, Gradilone A, et al. Detection of Basic Fibroblast Growth Factor Mrna in Urinary Bladder Cancer:Correlation with Local Relapses. Int J Oncol, 1999, 14(6):1123-1127.
[17] Dellacono FR, Spiro J, Eisma R, et al. Expression of Basic Fibroblast Growth Factor and Its Receptors by Head and Neck Squamous Carcinoma Tumor and Vascular Endothelial Cells Am J Surg, 1997, 174(5):540-544.
[18] Huang X, Yu C, Jin C, et al. Forced Expression of Hepatocyte-Specific Fibroblast Growth Factor 21 Delays Initiation of Chemically Induced Hepatocarcinogenesis. Mol Carcinog,2006, 45(12):934-942.
[19] Olsen SK, Ibrahimi OA, Raucci A, et al. Insights into the Molecular Basis for Fibroblast Growth Factor Receptor Autoinhibition and Ligand-Binding Promiscuity. Proc Natl Acad Sci U S A, 2004, 101(4):935-940.
[20] Johnson DE, Williams LT. Structural and Functional Diversity in the Fgf Receptor Multigene Family. Adv Cancer Res, 1993,60:1-41.
[21] Ornitz DM, Xu J, Colvin JS, et al. Receptor Specificity of the Fibroblast Growth Factor Family. J Biol Chem, 1996, 271(25):15292-15297.
[22] Duchesne L, Tissot B, Rudd TR, et al. N-Glycosylation of Fibroblast Growth Factor Receptor 1 Regulates Ligand and Heparan Sulfate Co-Receptor Binding. J Biol Chem, 2006,281(37):27178-27189.
[23] Sleeman M, Fraser J, McDonald M, et al. Identification of a New Fibroblast Growth Factor Receptor, Fgfr5. Gene, 2001,271(2):171-182.
[24] Silva PN, Altamentova SM, Kilkenny DM, et al. Fibroblast Growth Factor Receptor Like-1 (Fgfrl1) Interacts with Shp-1 Phosphatase at Insulin Secretory Granules and Induces Beta-Cell Erk1/2 Protein Activation. J Biol Chem, 2013, 288(24):17859-17870.
[25] Haugsten EM, Wiedlocha A, Olsnes S, et al. Roles of Fibroblast Growth Factor Receptors in Carcinogenesis. Mol Cancer Res,2010, 8(11):1439-1452.
[26] Eswarakumar VP, Lax I, Schlessinger J. Cellular Signaling by Fibroblast Growth Factor Receptors. Cytokine Growth Factor Rev, 2005, 16(2):139-149.
[27] Martinez N, Garcia-Dominguez CA, Domingo B, et al.Sprouty2 Binds Grb2 at Two Different Proline-Rich Regions,and the Mechanism of Erk Inhibition Is Independent of This Interaction. Cell Signal, 2007, 19(11):2277-2285.
[28] Li C, Scott DA, Hatch E, et al. Dusp6 (Mkp3) Is a Negative Feedback Regulator of Fgf-Stimulated Erk Signaling During Mouse Development. Development, 2007, 134(1):167-176.
[29] Kovalenko D, Yang X, Nadeau RJ, et al. Sef Inhibits Fibroblast Growth Factor Signaling by Inhibiting Fgfr1 Tyrosine Phosphorylation and Subsequent Erk Activation. J Biol Chem,2003, 278(16):14087-14091.
[30] Mardakheh FK, Yekezare M, Machesky LM, et al. Spred2 Interaction with the Late Endosomal Protein Nbr1 Down-Regulates Fibroblast Growth Factor Receptor Signaling. J Cell Biol, 2009, 187(2):265-277.
[31] Bottcher RT, Pollet N, Delius H, et al. The Transmembrane Protein Xflrt3 Forms a Complex with Fgf Receptors and Promotes Fgf Signalling. Nat Cell Biol, 2004, 6(1):38-44.
[32] Haines BP, Wheldon LM, Summerbell D, et al. Regulated Expression of Flrt Genes Implies a Functional Role in the Regulation of Fgf Signalling During Mouse Development. Dev Biol, 2006, 297(1):14-25.
[33] Ottaviani G, Jaffe N. The Etiology of Osteosarcoma. Cancer Treat Res, 2009, 152:15-32.
[34] Baird K, Davis S, Antonescu CR, et al. Gene Expression Profiling of Human Sarcomas: Insights into Sarcoma Biology.Cancer Res, 2005, 65(20):9226-9235.
[35] Hassan SE, Bekarev M, Kim MY, et al. Cell Surface Receptor Expression Patterns in Osteosarcoma. Cancer, 2012, 118(3):740-749.
[36] Fernanda Amary M, Ye H, Berisha F, et al. Fibroblastic Growth Factor Receptor 1 Amplification in Osteosarcoma Is Associated with Poor Response to Neo-Adjuvant Chemotherapy. Cancer Med, 2014, 3(4):980-987.
[37] Leddy LR, Holmes RE. Chondrosarcoma of Bone. Cancer Treat Res, 2014, 162:117-130.
[38] Sahni M, Ambrosetti DC, Mansukhani A, et al. Fgf Signaling Inhibits Chondrocyte Proliferation and Regulates Bone Development through the Stat-1 Pathway. Genes Dev, 1999,13(11):1361-1366.
[39] Aikawa T, Segre GV, Lee K. Fibroblast Growth Factor Inhibits Chondrocytic Growth through Induction of P21 and Subsequent Inactivation of Cyclin E-Cdk2. J Biol Chem, 2001, 276(31):29347-29352.
[40] Webster MK, Donoghue DJ. Fgfr Activation in Skeletal Disorders: Too Much of a Good Thing. Trends Genet, 1997,13(5):178-182.
[41] van Oosterwijk JG, Meijer D, van Ruler MA, et al. Screening for Potential Targets for Therapy in Mesenchymal, Clear Cell,and Dedifferentiated Chondrosarcoma Reveals Bcl-2 Family Members and Tgfbeta as Potential Targets. Am J Pathol, 2013,182(4):1347-1356.
[42] Taylor JGt, Cheuk AT, Tsang PS, et al. Identification of Fgfr4-Activating Mutations in Human Rhabdomyosarcomas That Promote Metastasis in Xenotransplanted Models. J Clin Invest,2009, 119(11):3395-3407.
[43] Crose LE, Etheridge KT, Chen C, et al. Fgfr4 Blockade Exerts Distinct Antitumorigenic Effects in Human Embryonal Versus Alveolar Rhabdomyosarcoma. Clin Cancer Res, 2012, 18(14):3780-3790.
[44] Liu J, Guzman MA, Pezanowski D, et al. Foxo1-Fgfr1 Fusion and Amplification in a Solid Variant of Alveolar Rhabdomyosarcoma. Mod Pathol, 2011, 24(10):1327-1335.
[45] Wang X, Asmann YW, Erickson-Johnson MR, et al. High-Resolution Genomic Mapping Reveals Consistent Amplification of the Fibroblast Growth Factor Receptor Substrate 2 Gene in Well-Differentiated and Dedifferentiated Liposarcoma. Genes Chromosomes Cancer, 2011, 50(11):849-858.
[46] Zhang K, Chu K, Wu X, et al. Amplification of Frs2 and Activation of Fgfr/Frs2 Signaling Pathway in High-Grade Liposarcoma. Cancer Res, 2013, 73(4):1298-1307.
[47] Ishibe T, Nakayama T, Okamoto T, et al. Disruption of Fibroblast Growth Factor Signal Pathway Inhibits the Growth of Synovial Sarcomas: Potential Application of Signal Inhibitors to Molecular Target Therapy. Clin Cancer Res, 2005,11(7):2702-2712.
[48] Girnita L, Girnita A, Wang M, et al. A Link between Basic Fibroblast Growth Factor (Bfgf) and Ews/Fli-1 in Ewing’s Sarcoma Cells. Oncogene, 2000, 19(37):4298-4301.
[49] Westwood G, Dibling BC, Cuthbert-Heavens D, et al. Basic Fibroblast Growth Factor (Bfgf)-Induced Cell Death Is Mediated through a Caspase-Dependent and P53-Independent Cell Death Receptor Pathway. Oncogene, 2002, 21(5):809-824.
[50] Ishigami T, Hida Y, Matsudate Y, et al. The Involvement of Fibroblast Growth Factor Receptor Signaling Pathways in Dermatofibroma and Dermatofibrosarcoma Protuberans. J Med Invest, 2013, 60(1-2):106-113.
[51] Kilvaer TK, Valkov A, Sorbye SW, et al. Fibroblast Growth Factor 2 Orchestrates Angiogenic Networking in Non-Gist Sts Patients. J Transl Med, 2011, 9:104.
[52] Ettrich TJ, Seufferlein T. Regorafenib. Recent Results Cancer Res, 2014, 201:185-196.
[53] Li SQ, Cheuk AT, Shern JF, et al. Targeting Wild-Type and Mutationally Activated Fgfr4 in Rhabdomyosarcoma with the Inhibitor Ponatinib (Ap24534). PLoS One, 2013, 8(10):e76551.
