无溶剂一锅法合成新型8-芳基-7,8-二氢-[1,3]二氧戊环并[4,5-g]喹啉-6(5H)- 酮类化合物
2015-04-23吴晓霞
吴晓霞
(南京晓庄学院生物化工与环境工程学院,江苏南京 211171)
2-喹啉酮类化合物是一类重要的天然产物,具有良好的生物活性[1-2],如抗癌、抗菌、抗病毒、抗骨质疏松和治疗心血管等[3-7]。其合成方法受到研究人员的广泛关注[8-10]。现有方法虽然产率较高,但存在原料昂贵、反应复杂、反应时间长和毒性大等缺陷。
为简化反应流程,减少环境污染,本文采用微波辅助,经三组分[3,4-亚甲二氧基苯胺(1),2,2-二甲基-1,3-二氧六环-4,6-二酮(3)和取代芳醛(2a~2j)]无溶剂一锅法[11]合成了10个新型的8-芳基-7,8-二氢-[1,3]二氧戊环并[4,5-g]喹啉-6(5H)-酮类化合物(4a ~4j,Scheme 1),产率75.7% ~ 83.5%,其结构经1H NMR,FT-IR,ESI-MS和元素分析表征。以4a为例,对合成4a~4j的反应条件进行了优化。合成4a的最佳反应条件为:1 2 mmol,r[n(1)∶n(2a)∶n(3)=1 ∶1 ∶1],于50 ℃ /450 W 反应15 min。
1 实验部分
1.1 仪器与试剂
XT-4型熔点仪(温度未校正);AM 5600-300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet 5700型傅立叶红外光谱仪(KBr压片);Finnigan LCQ型液质联用仪;PE 2400型元素分析仪;CEM-Discover型微波合成仪。

Scheme 1
1,2a~2j和3,分析纯,百灵威试剂;其余所用试剂均为分析纯。
1.2 4a~4j的合成通法
在反应瓶中加入1 0.264 g(2 mmol),2a~2j 2 mmol和3 0.3 g(2 mmol),搅拌使其混合均匀;转移至微波反应仪内,于50℃/450 W反应15 min。冷却至室温,放置0.5 h后经硅胶柱层析[洗脱剂:V(正己烷)∶V(乙酸乙酯)=2∶1]纯化得淡棕色固体4a,4b和棕色固体4c~4j。
8-(2-羟基苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4a):产率77.6%,m.p.217 ℃ ~ 219 ℃;1H NMR δ:2.92 ~ 2.97(m,2H,7-H),4.55(t,1H,8-H),5.39(s,1H,OH),6.11(s,2H,OCH2),6.35(s,1H,ArH),6.61(s,1H,ArH),7.14 ~7.28(m,4H,ArH),8.28(s,1H,NH);FT-IR ν:3 317,3 167,2 891,1 689,1 589,1 315,1 254,1 180,932 cm-1;ESI-MS m/z:283[M+];Anal.calcd for C13H13NO4:C 67.84,H 4.63,N 4.94;found C 67.95,H 4.55,N 4.88。
8-(2-氟苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4b):产率 80.7%,m.p.195 ℃ ~ 197 ℃;1H NMR δ:2.91 ~ 2.98(m,2H,7-H),4.51(t,1H,8-H),6.09(s,2H,OCH2),6.30(s,1H,ArH),6.55(s,1H,ArH),7.11 ~7.25(m,4H,ArH),8.31(s,1H,NH);FT-IR ν:3 202,3 061,2 853,1 682,1 517,1 335,1 154,980 cm-1;ESI-MS m/z:285[M+];Anal.calcd for C16H12NO3F:C 67.36,H 4.24,N 4.91;found C 67.42,H 4.21,N 4.97。
8-(2-氯苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4c):产率 84.7%,m.p.200 ℃ ~ 202 ℃;1H NMR δ:2.90 ~ 2.98(m,2H,7-H),4.58(t,1H,8-H),6.07(s,2H,OCH2),6.32(s,1H,ArH),6.51(s,1H,ArH),7.17 ~7.32(m,4H,ArH),8.25(s,1H,NH);FT-IR ν:3 198,3 043,2 793,1 671,1 495,1 317,1 182,991 cm-1;ESI-MS m/z:301[M+];Anal.calcd for C16H12NO3Cl:C 63.69,H 4.01,N 4.64;found C 63.82,H 4.07,N 4.79。
8-(2-溴苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4d):产率 76.8%,m.p.208 ℃ ~ 210 ℃;1H NMR δ:2.93 ~ 2.99(m,2H,7-H),4.58(t,1H,8-H),6.07(s,2H,OCH2),6.35(s,1H,ArH),6.57(s,1H,ArH),7.23 ~7.41(m,4H,ArH),8.22(s,1H,NH);FT-IR ν:3 241,3 075,2 819,1 659,1 503,1 379,1 209,1 096,934 cm-1;ESI-MS m/z:345[M+];Anal.calcd for C16H12NO3Br:C 55.51,H 3.49,N 4.05;found C 55.60,H 3.44,N 4.01。
8-(4-叔丁基苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4e):产率75.9%,m.p.221 ℃ ~ 223 ℃;1H NMR δ:2.28(s,9H,CH3in But),2.93 ~3.01(m,2H,7-H),4.56(t,1H,8-H),6.17(s,2H,OCH2),6.33(s,1H,ArH),6.58(s,1H,ArH),7.28 ~7.37(m,4H,ArH),8.38(s,1H,NH);FT-IR ν:3 207,3 007,2 847,1 679,1 564,1 327,1 174,932,878 cm-1;ESI-MS m/z:323[M+];Anal.calcd for C20H21NO3:C 74.28,H 6.55,N 4.33;found C 74.41,H 6.49,N 4.28。
8-(2,4-二氟苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4f):产率77.6%,m.p.232 ℃ ~ 234 ℃;1H NMR δ:2.88 ~3.03(m,2H,7-H),4.50(t,1H,8-H),6.12(s,2H,OCH2),6.48(s,1H,ArH),6.61(s,1H,ArH),6.74 ~7.18(m,3H,ArH),8.69(s,1H,NH);FT-IR ν:3 306,3 048,2 926,1 661,1 553,1 408,1 352,1 189,1 063,985,834 cm-1;ESI-MS m/z:303[M+];Anal.calcd for C16H11NO3F2:C 63.37,H 3.66,N 4.62;found C 63.25,H 3.65,N 4.69。
8-(2,4-二氯苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4g):产率79.1%,m.p.253 ℃ ~ 255 ℃;1H NMR δ:2.88 ~3.01(m,2H,7-H),4.52(t,1H,8-H),6.09(s,2H,OCH2),6.44(s,1H,ArH),6.62(s,1H,ArH),6.85 ~7.29(m,3H,ArH),8.61(s,1H,NH);FT-IR ν:3 327,3 105,2 918,1 667,1 541,1 448,1 312,1 217,1 186,1 074,934,871 cm-1;ESI-MS m/z:335[M+];Anal.calcd for C16H112NO3Cl2:C 57.16,H 3.31,N 4.17;found C 57.27,H 3.35,N 4.24。
8-(2-氨基苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4h):产率83.3%,m.p.207 ℃ ~ 209 ℃;1H NMR δ:2.93 ~ 3.05(m,2H,7-H),4.65(t,1H,8-H),5.32(s,2H,NH2),6.05(s,2H,OCH2),6.22(s,1H,ArH),6.49(s,1H,ArH),7.28 ~7.39(m,4H,ArH),8.32(s,1H,NH);FT-IR ν:3 217,3 174,2 793,1 672,1 369,1 180,932 cm-1;ESI-MS m/z:282[M+];Anal.calcd for C16H14N2O3:C 68.07,H 5.01,N 9.92;found C 68.19,H 5.07,N 9.86。
8-(2-甲氧基苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4i):产率79.1%,m.p.223 ℃ ~ 225 ℃;1H NMR δ:2.85~ 2.96(m,2H,7-H),3.83(s,3H,OCH3),4.61(t,1H,8-H),6.02(s,2H,OCH2),6.37(s,1H,ArH),6.49(s,1H,ArH),7.21 ~7.38(m,4H,ArH),8.51(s,1H,NH);FT-IR ν:3 323,3 126,2 845,1 666,1 283,1 084,957,881,803;ESI-MS m/z:297[M+];Anal.calcd for C17H15NO4:C 68.68,H 5.09,N 4.71;found C 68.59,H 5.14,N 4.77。
8-(4-甲基苯基)-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]喹啉-6(5H)-酮(4j):产率 80.1%,m.p.204 ℃ ~206 ℃;1H NMR δ:2.03(s,3H,CH3),2.89 ~2.98(m,2H,7-H),4.56(t,1H,8-H),6.13(s,2H,OCH2),6.29(s,1H,ArH),6.51(s,1H,ArH),7.37 ~7.51(m,4H,ArH),8.23(s,1H,NH);FT-IR ν:3 257,3 195,2 790,1 673,1 244,1 125,913,848 cm-1;ESI-MS m/z:281[M+];Anal.calcd for C17H15NO3:C 72.58,H 5.37,N 4.98;found C 72.65,H 5.31,N 4.95。
2 结果与讨论
2.1 合成
以4a的合成为例,考察了反应时间,反应温度,溶剂和反应方式对4a产率的影响,寻找最佳反应条件。
(1)反应时间
1 2 mmol,r[n(1)∶n(2a)∶n(3)=1 ∶1 ∶1],反应温度50℃,其余反应条件同1.2,考察反应时间对4a产率的影响,结果见表1。

表1 反应时间对4a产率的影响*Table 1 Effect of reaction time on yield of 4a
由表1可见,反应时间为5 min时,4a产率较低(12.1%);反应时间延长至15 min,产率最高(77.3%);继续延长反应时间,产率反而降低,其可能原因在于:反应时间太长,副反应增加,产率降低。因此,最佳反应时间为15 min。
(2)反应温度
1 2 mmol,r=1 ∶1 ∶1,反应时间15 min,其余反应条件同2.1(1),考察反应温度对4a产率的影响,结果见表2。
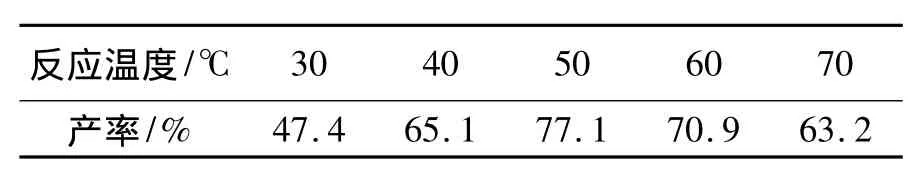
表2 反应温度对4a产率的影响*Table 2 Effect of reaction temperature on yield of 4a
由表2可见,随着反应温度升高,4a产率逐渐提高;当反应温度为 50℃时,产率最高(77.1%);继续升高温度,产率反而下降。其可能原因也在于温度过高,副反应增加。因此,最佳反应温度为50℃。
(3)溶剂和反应方式
1 2 mmol,r=1 ∶1 ∶1,于50 ℃反应15 min,其余反应条件同2.1(1),考察溶剂和反应方式对4a产率的影响,结果见表3。

表3 溶剂和反应方式对4a产率的影响*Table 3 Effect of solvents and reaction methods on yield of 4a
由表3可见,有溶剂存在时,无论是回流反应还是微波反应,4a产率均低于无溶剂微波反应。其可能原因在于:无溶剂条件下可产生底物局部高浓度,使产率提高。
综上所述,合成4a的最佳反应条件为:1 2 mmol,r[n(1)∶n(2a)∶n(3)=1 ∶1 ∶1],于 50℃/450 W反应15 min。
2.2 反应机理
根据实验结果,提出了4a~4j可能的合成机理(Scheme 2)。

Scheme 2
由Scheme 2可见,2和3经Knoevenagel缩合反应生成5;5经分子内缩合得6;6和1经Michael加成反应得7;7依次经环化、脱水和氧化反应,合成4a ~4j。
[1]Shilabin A G,Dzhekieva L,Misra P,et al.4-Quinolones as noncovalent inhibitors of high molecular mass penicillin-binding proteins[J].ACS Med Chem Lett,2012,3(7):592 -595.
[2]Cross R M,Namelikonda N K,Mutka T S,et al.Synthesis,antimalarial activity and structure-activity relationship of 7-(2-phenoxyethoxy)-4(1H)-quinolones[J].J Med Chem,2011,54(24):8321 - 8327.
[3]颜鑫,刘苏友,欧晓明,等.5-氨基-5,6,7,8-四氢-2(1H)-喹啉酮的简便合成[J].合成化学,2010,18(1):94-96.
[4]周凯,李强,郑美林,等.2-取代-3,4-二氢-1-异喹啉酮的合成及其血管舒张活性[J].合成化学,2010,18(3):352-355.
[5] 孙良鹏,姜哲,高立信,等.含3,4-二氢2(1H)-喹啉酮结构查尔酮衍生物的合成及蛋白酪氨酸磷酸酯酶1B抑制活性研究[J].有机化学,2012,32(11):2108-2114.
[6]Sun X Y,Wu R,Wen X,et al.Synthesis and evaluation of antibacterial activity of 7-alkyloxy-4,5-dihydroimidazo[1,2-a]quinoline derivatives[J].Eur J Med Chem,2013,60:451 -455.
[7]刘长春.微波辐射下合成 2,6-二甲基-3-芳基-4(1H)-喹啉酮[J].精细化工,2014,31(1):75 -78.
[8]Ramalingan C,Kwak Y W.Tetrachlorosilane catalyzed multicomponent one-step fusion of biopertinent pyrimidine heterocycles[J].Tetrahedron,2008,64:5023-5031.
[9]Sharghi H,Jokar M.Al2O3/MeSO3H:A novel and recyclable catalyst for one-pot synthesis of 3,4-dihydropyrimidinones or their sulfur derivatives in Biginelli condensation[J].Synth Commun,2009,39:958 -979.
[10]Su W,Li J,Zheng Z,et al.One-pot synthesis of dihydropyrimidiones catalyzed by strontium(II)triflate under solvent-free conditions[J].Tetrahedron Lett,2005,46:6037 -6040.
[11]徐鉴.一锅法合成新型7-苯基-10-芳基-5H-茚并[1,2-b]喹啉-9,11-二酮类化合物[J].合成化学,2015,23(6):547 -549.
