复合益生菌菌液对奶牛产奶量和肠道菌群的影响
2015-04-19张海荣唐景春张清敏王希年许艳龙
张海荣,黄 华,唐景春*,张清敏,,王希年,许艳龙
(1.南开大学环境科学与工程学院,天津 300071;2.吉林九丰生物科技开发有限公司,吉林 通化 134001)
复合益生菌菌液对奶牛产奶量和肠道菌群的影响
张海荣1,黄 华1,唐景春1*,张清敏1,2,王希年2,许艳龙2
(1.南开大学环境科学与工程学院,天津 300071;2.吉林九丰生物科技开发有限公司,吉林 通化 134001)
为了研究复合益生菌菌液对奶牛产奶量、乳品质量、牛群健康和肠道菌群的影响,选择20头条件相近的健康奶牛随机分为试验组和对照组,采用菌液与饲料混合的方法饲喂牛群,考察其对奶牛产奶量,肠道菌群乳品质量和牛群健康的影响。结果表明,食用复合益生菌液的每头牛比对照组平均每天可以多产2.9 kg牛奶,提高产奶量14.8%,差异极显著 (P<0.01 ),经济效益显著;复合益生菌菌液可以促进肠道菌群调整,使有益菌-主要是乳酸菌成为优势菌群,并可以抑制霉菌和降解霉菌毒素,降低牛乳中体细胞数,预防隐性乳腺(房)炎。
复合益生菌;产奶量;PCR-DGGE;乳酸菌;霉菌;体细胞数
益生菌是一种活性微生物制剂,广泛应用于畜牧、水产等养殖业[1-4]。其中主要菌种是乳酸菌[5-6]、芽孢杆菌[7]、酵母菌[8-9]等。这些有益活性菌群在消化道内与病原菌竞争黏附位点,形成屏障,产生多种抗菌物质、维生素、有机酸和多种消化酶,降解霉菌毒素等。因此,能够提高畜禽以及鱼虾饲料转化率和对营养物质的吸收率,提高其抗病能力和抗应激能力,对机体产生明显的生理效应和生态效应,从而提高经济效益。
微生态制剂在反刍动物生产上的应用报道较少,单一的益生菌菌剂,如枯草芽孢杆菌或酵母培养物,在奶牛生产上的使用在国内已有一些报道[10]。但是,多种益生菌制成复合益生菌菌液,应用于奶牛生产还鲜有报道。为此,本研究采用多次、多点试验的方法,探讨了乳酸菌、枯草芽孢杆菌、酵母菌等多种菌扩大培养的菌液对奶牛产奶性能的影响,并对其经济效益进行了分析,旨在为复合益生菌广泛应用于奶牛生产提供科学依据。
1 材料与方法
1.1 试验用复合益生菌菌液
试验用复合益生菌菌液由某公司研制,含有效活菌数1×1010CFU/mL,主要由乳酸菌、芽孢杆菌、光合细菌和酵母菌等组成。
1.2 试验设计
选择年龄、胎次、泌乳月份、产奶量、体重以及健康状态相近的20头荷斯坦奶牛,随机分为对照组10头,编号分别为1~10;试验组10头,编号分别为11~20。试验组每天每头牛第一餐草料中添加50 mL复合益生菌菌液,对照组每天每头牛第一餐草料中相应多添加50 mL饮用水。两组的饲料以及管理条件都完全相同。奶牛自由饮水,自由吃料,每天挤奶2次,喂料2次。试验期21 d,其中预试验期7 d,每天检测试验组和对照组的产奶总量,并计算头均产奶量;从第8~21 d开始每2 d检测试验组和对照组的产奶总量,并计算头均产奶量。在整个试验期内还要记录因下雨、干热风等恶劣天气因应激反应造成对产奶量的影响。
1.3 牛粪中乳酸菌和霉菌的检测
为了解添加复合益生菌菌液后对牛肠道菌群的影响,于试验的第10天早晨分别多次采集对照组与试验组牛群新排出粪便,迅速冷藏运回实验室。分别用乳酸菌培养基(MRS)和霉菌培养基(高盐察氏培养基)培养并计数,观察肠道中乳酸菌和霉菌的生态变化[11-12]。
将对照组和试验组的冷藏鲜牛粪采用四分法,各分出10 g加于90 mL无菌水中,置于室温下200 r/min,振荡30 min,作为10-1稀释液,然后从10-1稀释液中在无菌条件下取1 mL加到9 mL无菌水中为10-2,依次制成10-3、10-4、10-5、10-6稀释液。然后取10-4、10-5、10-6各1 mL加入灭菌的平板内,平板再加入适量乳酸菌琼脂培养基混合均匀。先平放20 min,而后倒置于35℃温箱内培养24~48 h;同样取10-4、10-5、10-6各1 mL加到霉菌的琼脂培养基内,37℃温箱培养24~48 h。
1.4 牛乳中体细胞数检测
采用美国加利福尼亚体细胞检验法(Califomia Mastitis Test CMT)[13]。具体操作方法是在诊断盘(深1.5 cm,直径5 cm的乳白色平皿)内加被检乳样2 mL,再加2 mL CMT诊断液,平置诊断盘并使呈同心圆旋转摇动,使乳液与诊断液充分混合,10~30 s后观察混合液状态,并与标准对照表比较,确定混合液的级数(N、T、1、2、3级)。对应的体细胞数为:N级0~2×105/mL,T级2~4×105/mL,1级4~12×105/mL,2级12~50×105/mL,3级5×106/mL以上。如果体细胞数一直持续很高,说明奶牛已患有乳房炎,可能由葡萄球菌、链球菌、棒状杆菌、沙门氏菌或大肠杆菌等感染[14-15]。分别检测试验组奶牛在食用复合益生菌菌液前和连续食用复合益生菌菌液两周后所产牛奶的体细胞数。
1.5 牛粪微生物群落的PCR-DGGE测定
牛粪中微生物多样性的测定采用基因扩增-变性梯度凝胶电泳(PCR-DGGE)技术。牛粪中微生物DNA使用试剂盒(Zyme Research ZR Soil Microbe DNA MicroPrep)提取。PCR引物为16S rRNA保守区通用引物(F357GC:5'-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAGCAG-3',R518:5-'ATT ACC GCG GCT GCT GG-3')。PCR反应程序为:94 ℃,5 min,预变性;94 ℃,30 s变性;56℃,40 s退火;72 ℃,60 s延伸,循环35次;72 ℃,5min,最后一次延伸,扩增产物用1%的琼脂糖凝胶电泳检测。
利用DGGE电泳(DcodeTM,Bio-Rad)分离PCR产物,细菌DNA电泳条件为:8%丙烯酰胺凝胶(丙烯酰胺∶甲叉丙烯酰胺=37.5∶1),30%~60%变性梯度,140V稳压,60℃恒温下电泳220 min,EB染色20 min,最后利用Bio-Rad凝胶成像系统拍照并分析。
1.6 数据处理
产奶量的变化采用SPSS统计软件10.0进行方差分析和多重比较(Duncan法)。试验结果用平均数±标准误表示。利用Quantity one 4.62软件(Bio-Rad)对DGGE电泳条带进行分析,采用Shannon-Weiner指数和多样性指数进行微生态多样性分析。
2 结果与分析
2.1 产奶量变化
预试期与试验期内对照组与试验组产奶量的变化如表1所示。由表1知,每天每头牛在日粮中添加复合益生菌菌液50 mL,与对照组相比每天每头牛平均可多产奶2.9 kg,提高产奶量14.8%(P<0.01)。

表1 奶牛产奶量的变化(kg)
注:第19天下雨,气温骤降,产奶量降低,但试验组降低较少。
Notes: * notified that on day 19th, rain and sudden lowering of temperature decreased the milk yield of control group significantly; however, it did not affect much on test group.
2.2 鲜牛粪中乳酸菌与霉菌
多次粪样平板培养检测结果如表2所示,对照组粪样:乳酸菌含量为1.7×106CFU/mL,霉菌含量为1.3×107CFU/mL;而试验组粪样:乳酸菌含量达1.3×108CFU/mL,而霉菌几乎无菌落长出。

表2 牛粪中乳酸菌和霉菌含量
注:“-”代表没有检测到
Notes: - marked a number next to zero.
2.3 牛乳中体细胞数
牛乳中体细胞数是反映牛奶质量和牛群健康程度的一项重要指标。国际上也将牛乳体细胞数作为判定奶牛隐性乳房炎的标准,一般认为体细胞数<40万/mL为合格乳,正常牛乳中体细胞数一般在20~30万/mL之间,而超过此范围牛乳的品质就会降低。当乳汁中含有大量体细胞,且超过50万/mL时,奶牛就已经患上乳腺炎[16]。由表3可知,采用美国加州体细胞检验法(CMT)检测发现,食用益生菌菌液之前试验组牛乳中的体细胞数较高且部分大于>50万/mL,而食用益生菌菌液14 d后,试验组牛乳中体细胞数均比食用益生菌菌液之前降低,并均在40万/mL以下。说明复合益生菌菌液可以降低牛乳中体细胞数,可以预防乳腺(房)炎。
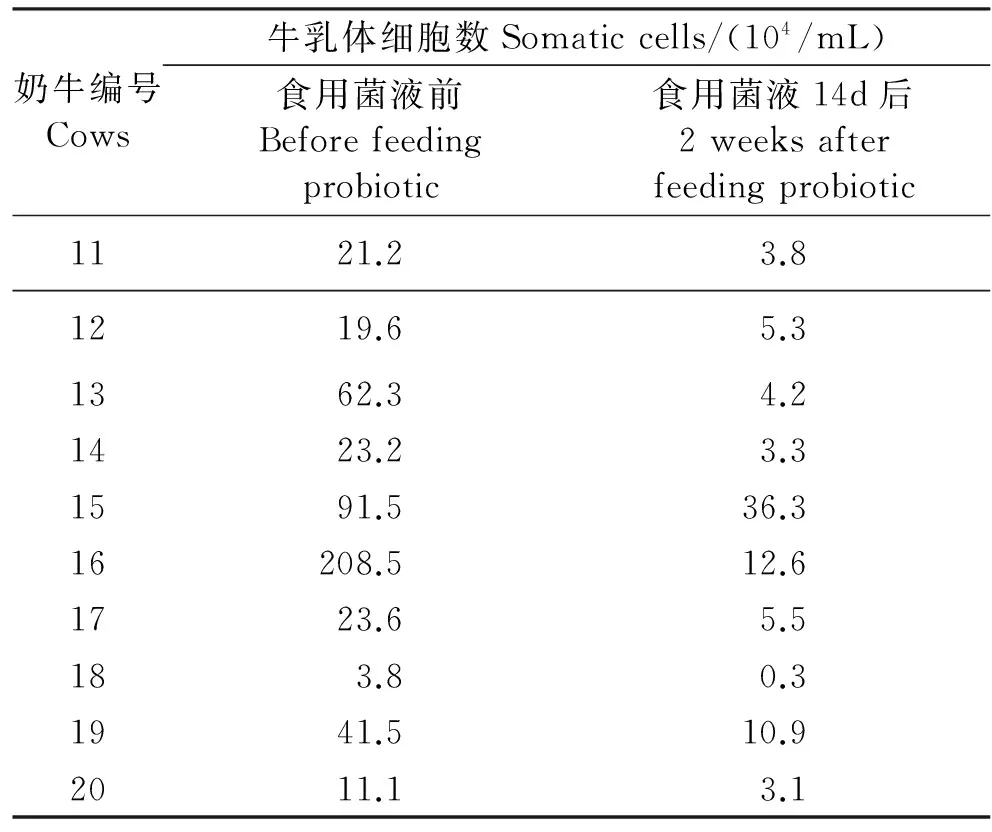
表3 食用复合益生菌菌液前和连续食用两周后
2.4 PCR-DGGE
采用ZR土壤DNA提取试剂盒分别从试验组和对照组的鲜牛粪样中提取基因组DNA,再扩增细菌16SrDNA V3区,经过变性梯度凝胶电泳,因每种细菌的V3区有差别,因而在梯度变性剂和电泳泳动作用下分离出不同的条带。结果如图1所示。
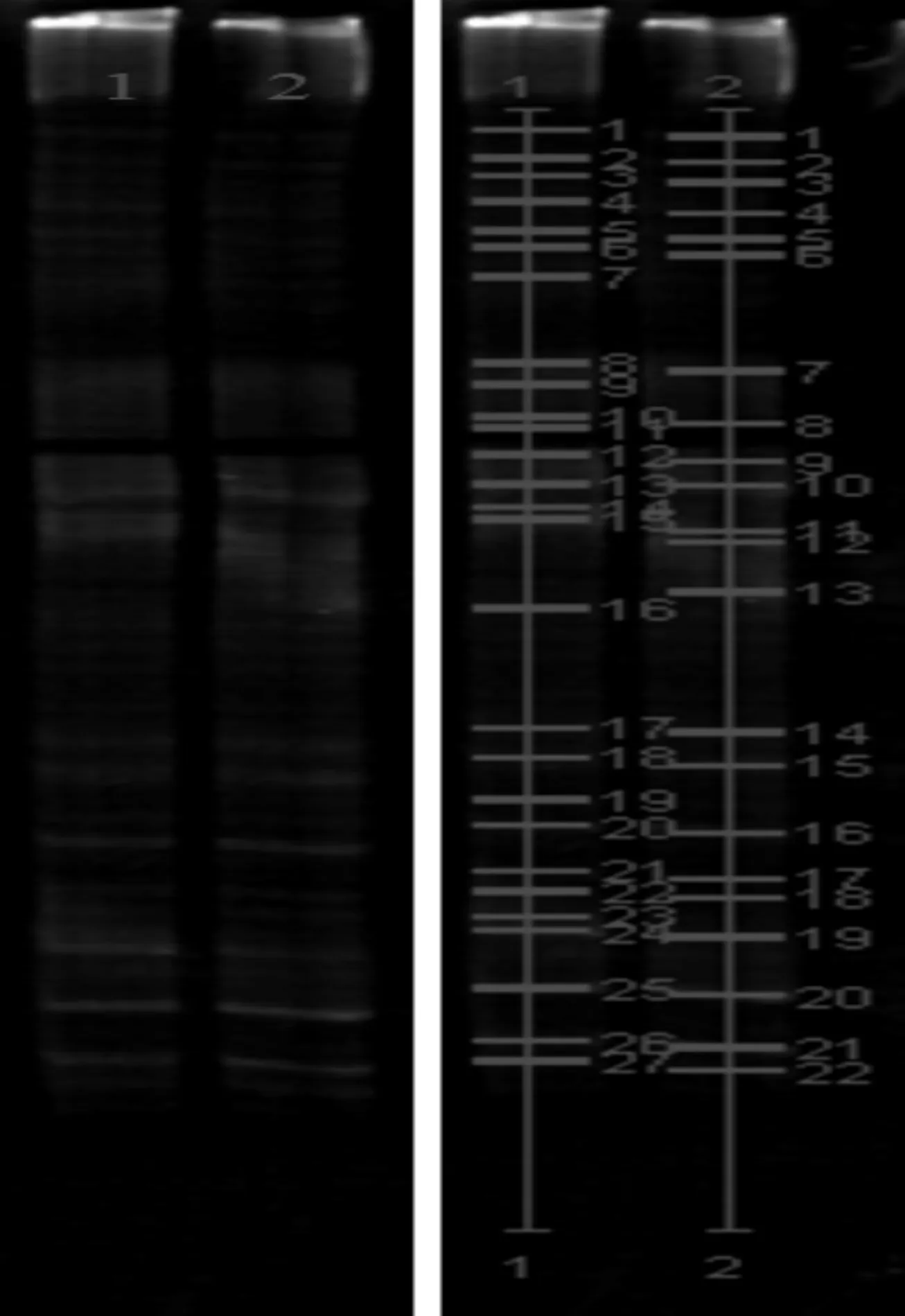
图1 PCR-DGGE指纹图谱及Quantity one软件处理图
1.fresh fecal of test group; 2.fresh fecal of control group
由图1可以看出,试验组粪样中细菌条带有27条,对照组有22条,说明试验组牛群肠道菌群多样性和微生态稳定性优于对照组。
由表4可以看出,饲喂复合益生菌菌液之后,试验组奶牛粪便菌群的Shannon-wiener指数比对照组增大,说明奶牛肠道中的菌群多样性增大,群落的复杂程度增高;试验组奶牛粪便菌群的均匀度指数比对照组在一定程度上增大,说明饲喂益生菌菌液后,牛群肠道菌群的微生态稳定性增强。

表4 牛粪中微生态的多样性指数
3 讨 论
奶牛采食被霉菌毒素污染过的饲料时,会造成瘤胃代谢紊乱、繁殖率降低(流产率增加)[17-18]、牛奶中体细胞数增加和产奶量下降以及乳房炎、蹄病等的发生。这也是导致奶牛产奶量不高,奶品质量降低的重要原因[19-20]。而益生菌在进入奶牛胃肠道后,促进肠道菌群调整,使有益菌(主要是乳酸菌)占有生态位,成为优势菌群,抑制了霉菌的生长和霉菌毒素的产生。从而使奶牛乳房炎等疾病的发病率降低,提高了产奶量,并降低了牛奶中的体细胞数,提高了奶品质量。
在奶牛日粮中平均每头牛添加50 mL益生菌菌液,在设有严格对照(条件完全相同)、气温平稳、空气质量较好的情况下,每头牛比对照组平均每天可以多产2.9 kg牛奶。但考虑到一般奶牛养殖小区不可能同时挑选出在产奶量、产奶月份、胎次以及体重、健康情况完全相近的对照组与试验组牛群,另外,也很难选择气温稳定、空气质量较好的时间段。因此,综合考虑其他因素的影响,在奶牛日粮中平均每头牛添加50 mL益生菌菌液,确定增加产奶量在1.5~2.0 kg/天·头为指标是适宜的。在日粮中添加复合益生菌菌液50 mL/(天·头),投入成本约为1.60元/(天·头);增加产奶量按1.5~2.0 kg/(天·头)计,按照鲜奶市场价(3.5元/kg)计算,增加收益为5.25~7.0元/(天·头),因此,每天每头奶牛可多增纯收入达3.65~5.4元,经济效益显著。
4 结 论
食用复合益生菌液的奶牛比对照组平均每天可以多产2.9 kg牛奶,提高产奶量14.8%;复合益生菌菌液可以促进肠道菌群调整,使有益菌-主要是乳酸菌成为优势菌群,并可抑制霉菌和降解霉菌毒素,降低牛乳中体细胞数,预防隐性乳腺(房)炎。复合益生菌菌液在奶牛养殖方面具有广阔的应用前景。
[1] 王运亨.影响奶牛产奶量及原料奶质量的主要因素[J].中国奶牛,2003(6):10-13.
[2] 刘彩娟,孙满吉,孙金艳,等.饲粮中添加复合益生菌对奶牛瘤胃发酵及纤维素酶活的影响[J].动物营养学报,2011,23(5):821-827.
[3] 张克春,徐国忠,吴显实,等.日粮添加富硒益生菌对奶牛乳房炎和乳汁体细胞数的影响[J].上海交通大学学报:农业科学版,2010,28(1):59-63.
[4] 张志军,刘 敏,马光辉,等.日粮中添加复合益生菌对奶牛生产性能的影响[J].新疆农业科学,2012,49(4):760-764.
[5] Giri S S, Sukumaran V, Sen S S, et al. Effects of dietary supplementation of potential probiotic Bacillus subtilis VSG1 singularly or in combination with Lactobacillus plantarum VSG3 or/and Pseudomonas aeruginosa VSG2 on the growth, immunity and disease resistance of Labeo rohita[J].Aquaculture Nutrition,2014,20(2):163-171.
[6] Allameh S K, Yusoff F M, Daud H M, et al. Characterization of a Probiotic Lactobacillus fermentum Isolated from Snakehead, Channa striatus, Stomach[J].Journal of the World Aquaculture Society,2013,44(6):835-844.
[7] Zhang Q,Yu H,Tong T,et al. Dietary supplementation of Bacillus subtilis and fructooligosaccharide enhance the growth, non-specific immunity of juvenile ovate pompano,Trachinotus ovatus and its disease resistance against Vibrio vulnificus[J].Fish & shellfish immunology,2014,38(1):7-14.
[8] Gunasundari V, Kumar T T, Ghosh S, et al. An ex vivo Loom to Evaluate the Brewer's Yeast Saccharomyces cerevisiae in Clownfish Aquaculture with Special Reference to Amphiprion percula (Lacepede,1802)[J].Turkish Journal of Fisheries and Aquatic Sciences,2013,13(3):389-395.
[9] Prasad L, Nayak B B, Srivastava P P, et al. Use of Brewer's Yeast Saccharomyces cerevisiae as growth promoter in giant freshwater prawn (Macrobrachium rosenbergii De man) post larvae[J].Turkish Journal of Fisheries and Aquatic Science,2013,13:447-452.
[10] 赵 珺,黄玉珍.枯草芽孢杆菌与酵母培养物对奶牛产奶性能的影响研究[J].长春大学学报,2007,17(08M):52-56.
[11] 冷晓飞,姜海峰,刘小林,等.皱纹盘鲍肠道菌群组成及PCR-DGGE指纹图谱分析[J].海洋科学,2013,37(5):10-14.
[12] 王春敏,佟丽波,韩桂华,等.利用PCR-DGGE技术分析抗生素对小鼠肠道菌群多样性的影响[J].中国老年学杂志,2014,(8):2 154-2 155.
[13] 刘 峰,迟玉杰.乳房炎乳的检测方法[J].现代食品科技,2005,21(1):129-131.
[14] 何 挺,毛超群,江兴军,等.一个高体细胞数牧场奶牛隐性乳腺炎病原菌的调查[J].中国奶牛,2010(8):38-41.
[15] 王希春,李 培,吴金节.奶牛隐性乳房炎对牛奶中体细胞数及品质的影响[J].中国奶牛,2008(4):49-51.
[16] 刘海霞.牛乳体细胞数的检测方法[J].中国乳品工业,2004,32(6):31-34.
[17] 许英民.奶牛常见饲料中毒及其防治[J].今日畜牧兽医:奶牛,2012(2):64-66.
[18] 陈玉山,郭 鹏,陈 蓉,等.玉米霉变对奶牛养殖业危害及应对措施[J].新疆畜牧业,2012(1):62-63.
[19] Bryden W L. Mycotoxin contamination of the feed supply chain: Implications for animal productivity and feed security[J].Animal Feed Science and Technology,2012,173(1):134-158.
[20] 高 潮,郑云峰,杨正坤,等.模拟胃肠道环境对霉菌毒素吸附剂吸附效果评估[J].中国饲料添加剂,2014(2):24-28.
Effect of Probiotic Complex on the Milk Yield and Intestinal Flora of Dairy Cow
ZHANG Hai-rong1,HUANG Hua1,TANG Jing-chun1*,ZHANG Qing-min1,2,WANG Xi-nian2,XU Yan-long2
(1.CollegeofEnvironmentalScienceandEngineering,NankaiUniversity,Tianjin300071,China;2.JilinJIUFENGBiotechnologyDevelopmentCo.Ltd,Tonghua,Jilin134001,China)
To study the effect of Probiotic Complex on the milk yield, milk quality, physical condition and intestinal flora of dairy cow, twenty Holstein cows with substantially the same age, birth parity, lactation month and milk yield were selected and divided into test group and control group. The test group was fed with fodder mixed with probiotic complex, and its effect on intestinal flora of dairy cow was examined through plate count and PCR-DGGE. Califomia Mastitis Test (CMT) was conducted to investigate its effect on milk quality and physical condition of cows. Results showed that the cows fed with Probiotic Complex could produce 2.9 kg more milk than the control group, milk yield rose by 14.8%, the difference was significant (P<0.01) and this will make significant economic benefits. Probiotic Complex may help intestinal flora to adjust so that the beneficial bacteria mainly Lactobacillus become dominant. Furthermore, it will inhibit mildew and degrade mycotoxins, reduce the number of somatic cells in milk, and prevent recessive breast (room) inflammation.
probiotic complex; milk yield; PCR-DGGE; lactobacillus; mildew; somatic cell number
2014-07-07,
2014-11-25
国家自然科学基金(31270544);国家高技术研究发展计划(863)重大项目(2013AA06A205)
张海荣(1990-),女,山东菏泽人,硕士研究生,研究方向:生物修复。E-mail: zhanghairong1017@sina.com
*[通讯作者] 唐景春(1968-),男,天津静海人,教授,博士生导师,研究方向:生态修复。E-mail: tangjch@nankai.edu.cn
S811.6
A
1005-5228(2015)01-0042-04
