烟草内生细菌YN201448的定殖能力研究
2015-04-18杨珍福何鹏飞吴毅歆毛自朝何月秋
杨珍福,何鹏飞,3,吴毅歆,毛自朝,何月秋,2*
(1.云南农业大学植物保护学院,昆明 650201;2.云南农业大学农学与生物技术学院,昆明 650201;3.微生物菌株筛选与应用技术国家地方联合共建工程中心,昆明 650471)
烟草内生细菌YN201448的定殖能力研究
杨珍福1,何鹏飞1,3,吴毅歆2,3,毛自朝2,3,何月秋1,2*
(1.云南农业大学植物保护学院,昆明 650201;2.云南农业大学农学与生物技术学院,昆明 650201;3.微生物菌株筛选与应用技术国家地方联合共建工程中心,昆明 650471)
摘要:为测定烟草内生细菌YN201448的定殖能力,通过自然转化法将携带绿色荧光蛋白基因的质粒pGFP4412成功导入YN201448细胞中,获得了GFP标记菌株48-pGFP。48-pGFP能稳定表达GFP蛋白,且对5种病原真菌的拮抗能力与野生型YN201448的相同。用48-pGFP菌液浸泡烟草种子和浇灌烟草苗后,在烟草的根、茎、叶等组织中都能检测到标记菌,其定殖数量分布为根>茎>叶;同时标记菌也能在根际土中稳定地定殖。激光共聚焦显微镜观察发现标记菌株主要聚集在烟草茎组织的表皮、皮层部位及维管组织。因此,YN201448可以在烟草体内外较长期定殖。
关键词:解淀粉芽孢杆菌;绿色荧光蛋白;拮抗作用;自然转化
植物体内存在大量的内生细菌,它们因植物组织的保护,而免受外部恶劣环境的影响,对植物具有广泛的生物学作用[1-3]。利用植物内生细菌作为生物制剂或生物肥料对植物进行生物预处理具有广阔的应用前景,掌握其定殖情况是进行生产应用的前提[4-5]。目前用于检测内生细菌在植物体内定殖的方法包括抗生素标记法、基因标记法、同位素示踪法、DNA和RNA探针法、免疫学方法等[6]。过去应用较为广泛的是抗生素标记法,该法虽然简便、快速、消耗低且结果可统计分析,但其精确性低、回收下限高[7]。近年来随着分子生物学技术的不断发展,基因标记技术越来越为人们重视,其中绿色荧光蛋白(GFP)由于具有性能稳定、检测方便、灵敏度高的特点已被成功用于观察细菌侵入植物的过程以及细菌在植物组织中的具体定殖部位[8-11]。
YN201448是从烟草体内筛选的内生解淀粉芽孢杆菌,平板对峙试验表明其对多种病原菌有抑制作用,经温室试验和田间使用证明其对烟草黑胫病有很好的防病作用,且对多种作物具有促生长作用。本研究运用质粒的接合转移方法对YN201448进行GFP标记,将GFP质粒转到YN201448菌株中,获得具有绿色荧光的菌株48-pGFP,这使我们实时动态地监测其在烟草体内外的定殖情况成为一种可能。研究YN201448菌株在烟草上的定殖情况,有助于进一步了解该菌株的防病促生机制,也为今后进一步开发成植物生防制剂和促生菌剂提供理论依据。
1 材料与方法
1.1材料
供试菌株:烟草内生解淀粉芽孢杆菌YN201448,真菌病原菌:烟草黑胫病菌(Phytophthora parasitica var. nicotianae)、禾谷镰刀病菌(Fusarium graminearum)、稻瘟病病菌(Magnaporthe oryzae)、番茄枯萎病菌(F. oxysporum f. sp. lycopersici)、玉米弯孢霉叶斑病菌(Curvularia lunata)等均为本试验室分离保存。
质粒:含有卡那霉素抗性基因的pGFP4412质粒由中国农业大学王琦教授惠赠。供试烟草:云烟97品种5~6叶期烟苗。细菌增殖采用LB培养基,自然转化生长采用GCHE和GC培养基[12]。
1.2方法
1.2.1拮抗细菌YN201448的GFP标记解淀粉芽孢杆菌YN201448的自然转化,采用Idris等[12]提供的两步法。将转化成功的菌株经不含卡那霉素的 LB 培养液和平板交替继续培养5轮,再回接到含卡那霉素的LB平板上检测,以证实其质粒表达的稳定性。
1.2.2GFP标记菌株与YN201448野生菌株拮抗能力的比较测定采用平板对峙[13]试验比较GFP标记菌株和野生型YN201448菌株对植物病原真菌的室内拮抗活性,其中植物病原真菌以烟草黑胫病病菌、禾谷镰刀病菌、玉米弯孢霉叶斑菌、番茄枯萎病菌、稻瘟病菌等为试验材料。当空白对照的病原菌长满平板时,观察接种拮抗菌的培养皿中拮抗带宽度的变化,对比两者的拮抗带宽度,得出标记菌是否具有相同的拮抗能力,以此来判断其是否适用于定殖和生物防治研究。
1.2.3GFP标记菌在烟草体内外的定殖研究(1)浸种处理:云烟97种子经酒精消毒后,用标记菌菌悬液(1.00×107cfu/mL)浸泡24 h,取出种子,用灭菌水冲洗4次后置于垫有湿润滤纸的培养皿内,于28 ℃光照培养箱中保湿培养。种子发芽后取0.5 g幼苗,用酒精消毒后,再用无菌水冲洗4次。将植物组织研磨成浆状物,并稀释成不同浓度,静置3 min。取150 µL汁液涂抹于含20 µg/mL卡那霉素的LB平板上,28 ℃下黑暗培养48 h,在紫外投射仪照射下统计平板上发绿色荧光的菌落数,计算含菌量[(菌落数×稀释倍数×分离用水毫升数)÷(涂板用水毫升数×分离组织克数)]。以清水浸种为对照,每处理重复3次。
(2)灌根处理:将长势一致的5~6片真叶期的烟草苗根拔起洗净后移栽在装有未灭菌自然土的花盆中后,用GFP标记菌菌液(1.00×107cfu/ml)灌根处理。分别于处理后第1、5、10、25、50天取样,测定拮抗细菌在烟草根、茎、叶内的定殖情况。以烟草根灌清水为对照,每处理重复3次。在组织分离的同时,称取烟草根际土于无菌水中,摇床震荡30 min后,进行一系列梯度稀释后涂布在含有卡那霉素的LB平板上,测定标记菌在根际土中的菌落变化情况。选择处理1 d和10 d后的烟草样品,切取用无菌水清洗过的烟草根、茎组织,压片法制片,在激光共聚焦显微镜下观察GFP标记菌株在烟草体内的定殖情况,以不接菌的烟草植株作为对照。
2 结 果
2.1解淀粉芽孢杆菌YN201448的转化
按照Idris等[12]提供的方法,我们成功地将pGFP4412质粒导入解淀粉芽孢杆菌YN201448自然感受态细胞中。pGFP4412标记的YN201448荧光明显,在抗生素平板上肉眼可见浅黄色菌落,其在紫外投射仪下菌落发出明亮的绿色荧光(图1),转化菌株命名为48-pGFP。48-pGFP经不含卡那霉素的LB培养液和平板交替继续培养5轮,再回接到含卡那霉素的LB平板上能正常生长,且绿色荧光明亮,说明标记菌株质粒能稳定表达。
2.248-pGFP与野生型菌株室内拮抗活性的比较
在平板对峙试验中,与YN201448菌株的野生型相比较(图2),48-pGFP菌株对病原真菌烟草黑胫病病菌、禾谷镰刀病菌、玉米弯孢霉叶斑菌、番茄枯萎病菌、稻瘟病菌等的拮抗能力与野生型的相同。说明标记后菌株对病原菌的抑制作用未受到影响,适用于定殖和生物防治的研究。
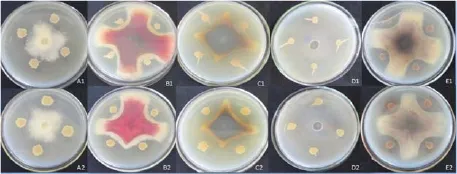
图2 YN201448菌株和GFP标记菌株对病原真菌抑菌活性Fig. 2 Inhibitory effect of GFP-tagged YN201448 and its own wild type on phytopathogenic fungi
2.348-pGFP在烟草体内和体外的回收监测
在浸种处理的实验中,清水对照处理中回收不到菌落,而用48-pGFP处理后长出的烟草幼芽中可以回收到1.07×104cfu/g发荧光的菌落。灌根试验的结果如图3所示,在根际土、根、茎、叶中,随着移栽后时间的延长,标记菌株的定殖密度有所下降。在用48-pGFP菌液处理后的第1天,在根、茎和叶组织中回收到的菌落数分别为8.59×105、3.35×105和7.44×104cfu/g,在第5天时菌落数有所下降,到第10天时处于上升状态,之后开始下降,到第50天时,烟草根、茎和叶组织中仍回收到2.53×105、4.10 ×102和4.44×102cfu/g的菌落。烟草根际土中的前10 d,48-pGFP处于缓慢增长的状态,到第10天时根际土中回收的菌落数达1.66×107cfu/g,之后逐渐下降,到第50天时回收到的GFP标记菌为2.00×105cfu/g。在处理后第25天对烟草组织进行表面消毒和不消毒处理后发现(图4),表面消毒过的只有未表面消毒的烟草组织中菌落数的1/10,说明YN201448菌株在植物表面也能够大量定殖。在处理第50天后烟草各组织和土壤中回收的48-pGFP菌落在抗生素平板上形成的菌落成浅黄色菌落是肉眼可见的,在紫外投射仪下能看到明显的荧光,说明GFP标记菌株比较稳定。处理后的第1天,48-pGFP在烟草根系上的定殖情况如图5a所示,在激光共聚焦显微镜下可以清楚的看到经过48-pGFP处理的根表呈现出很强的绿色荧光,比对照烟草根系中微弱的自发荧光(图5b)强得多;在茎组织切片中有标记菌的踪迹,且48-pGFP主要聚集在茎的表皮和皮层部位(图5d)。在处理后的第10天,烟草根表的绿色荧光信号更加强烈(图5c),与分离培养检测菌落数结果相符,同时在茎的维管组织细胞中(图5f)也能检测到48-pGFP。
烟草组织中标记菌落的回收结果和荧光显微镜观察结果都表明,48-pGFP能够进入烟草植株内部,并在烟草体内传导。菌株在进入到茎组织后,首先在表皮和皮层上定殖,然后向上传输到达叶片中,同时已定殖在表皮和皮层上的标记菌株也会向茎内部的维管组织中横向移动。烟草根际土中菌落回收结果表明,48-pGFP能在土壤中很好的定殖。由此表明,48-pGFP能够很好的在烟草体内外传导和定殖。

图3 48-pGFP在烟草体内外的定殖动态Fig. 3 Population of 48-pGFP in tobacco seedling and rhizosphic soil

图4 第25天时烟草组织中的48-pGFP菌落数Fig. 4 Population of 48-pGFP 25 days after inoculating tobacco

图5 标记菌48-pGFP在根表和茎组织中的定殖Fig. 5 The colonization of GFP-tagged strain, 48-pGFP in tobacco root and in stem tissues
3 讨 论
植物内生细菌作为新挖掘的微生物资源,正在被广泛开发利用,相对于其他植物来说,烟草内生菌研究及开发较少,其应用潜力巨大[14]。内生有益细菌在其寄主或其他植物中稳定定殖是其发挥防病促生作用的重要前提[15-16]。目前已有许多研究生防菌在植物体内定殖情况的方法,其中GFP标记具有操作简单、检测方便、无需外源底物等优点,已经成为当代研究目标微生物在自然环境中的释放、生存、定殖以及与其他微生物或植物互作等最为成功的报告基因[11,17-19]。YN201448是一株具有促生长、防治烟草黑胫病的烟草内生细菌[20-21]。本试验以GFP成功地标记了该菌株,从而为研究其在烟草植株不同部位的分布状况、定殖规律、促生长和防病机制提供了有力工具。
以标记菌株48-pGFP浸种和灌根处理,证明48-pGFP能在烟草体内定殖,灌根处理时,它在烟草根、茎、叶内的定殖能力为:根>茎>叶,表明该菌株进入烟草苗的根系后,能够转移到植株的茎和叶部组织。定殖数量动态在烟草的根、茎、叶等组织中均呈现“减-增-减”的变化趋势,且在根内的数量变化明显比茎和叶内的平缓,此结果与前人在其他作物上进行的定殖研究结果一致[22-24]。生防菌在根部定殖能力的强弱决定着生防的成败[6],有益内生细菌B946[7]在小麦体内,固氮菌DX120E[25]在甘蔗体内均能很好定殖,但只有当定殖达一定数量时,才能有效阻止病原菌侵染植物。本研究中48-pGFP在烟草体内的定殖随着植株的生长有所减少。因此,为了更好地发挥其防病促生长作用,在实际应用中可以根据需要适当补施,来保证YN201448在烟草体内的定殖菌落数。由于菌株经过GFP标记不能在大田中做相关试验,为了接近大田生长情况,本试验采用未灭菌的自然土来做定殖研究,表明野生型菌株YN201448亦能在自然土中很好定殖。
4 结 论
本研究获得了烟草内生解淀粉芽孢杆菌YN201448的GFP标记菌株48-pGFP,并通过对峙试验证明标记菌株对5种病原真菌的拮抗能力与野生型菌株的相同,用48-pGFP菌液对烟草进行浸种和灌根处理,均能回收到标记菌株,表明YN201448能在烟草体内外很好的定殖,具有进一步开发成植物生防制剂或促生菌剂的潜力。
致谢:感谢中国农业大学植物病理系王琦教授无私地惠赠带卡那霉素抗性基因的质粒pGFP4412。
参考文献
[1]Siciliano S D, Fortin N, Mihoc A, et al. Selection of specific endophytic bacterial genotypes by plants in response to soil contamination[J]. Appl Environ Microbiol, 2001, 6(67): 2469-2475.
[2]龚明福,韩松,李超,等. 苦豆子根瘤内生细菌分离及其对棉花枯萎病的生物防治效果测定[J]. 微生物学通报,2011,38(6):865-870.
[3]Rashid S, Charles T C, Glick B R. Isolation and characterization of new plant growth-promoting bacterial endophytes[J]. Applied soil ecology, 2012, 61:217-224.
[4]Coombs J T, Franco C M. Visualization of an endophytic Streptomyces species in wheat seed[J]. Appl Environ Microbiol, 2003, 69 (7): 4260-4262.
[5]卢镇岳,杨新芳,冯永君. 植物内生细菌的分离、分类、定殖与应用[J]. 生命科学,2006,18(1):90-94.
[6]张炳欣,张平. 植物根围外来微生物定殖的检测方法[J]. 浙江大学学报:农业与生命科学版,2000,26(6):624-628.
[7]刘忠梅,王霞,赵金焕,等. 有益内生细菌B946在小麦体内的定殖规律[J]. 中国生物防治,2005,21(2):113-116.
[8]范晓静,邱思鑫,吴小平,等. 绿色荧光蛋白基因标记内生枯草芽孢杆菌[J]. 应用与环境生物学报,2007,13(4):530-534.
[9]彭伟,谭悠久,黄永春. GFP标记的多粘芽孢杆菌1114在番茄根际的定殖[J]. 中国生物防治,2010,26(3):307-311.
[10] 殷幼平,袁训娥,李强,等. 生防菌枯草芽孢杆菌CQBS03的绿色荧光蛋白基因标记及其在柑橘叶片上的定殖[J]. 中国农业科学,2010,43(71):3555-3563.
[11] Xiao T, Tan S, Shen Q, et al. Bacillus cereus X5 suppresses root-knot nematode of tomato by colonizing in roots and soil[J]. Afr J Microbiol Res, 2012, 6: 2321-2327.
[12] Idris E E, Iglesias D J, Talon M, et al. Tryptophandependent production of indole-3-acetic acid (IAA)affects level of plant growth promotion by Bacillus amyloliquefaciens FZB42[J]. Molecular Plant-Microbe Interactions, 2007, 20(6): 619-626.
[13] 方中达. 植病研究方法[M]. 北京:中国农业出版社,1998.
[14] 李伟观,奚家勤,薛超群,等. 烟草内生菌研究概况及其应用[J]. 中国农学通报,2010,26(7):225-228.
[15] Kloepper J W, Beauchamp C J. A review of issues related to measuring colonization of plant roots by bacteria[J]. Can J Microbiol, 1992, 38 (12): 1219-1232.
[16] Compant S, Kaplan H, Sessitsch A, et al. Endophytic colonization of Vitis vinifera L. by Burkholderiaphytofirmans strain PsJN: from the rhizosphere to inflorescence tissues[J]. FEMS microbiology ecology,2008, 63(1): 84-93.
[17] 左存武,孙清明,黄秉智,等. 利用根系分泌物与绿色荧光蛋白标记的病原菌互作关系鉴定香蕉对枯萎病的抗性[J]. 园艺学报,2010,37(5):713-720.
[18] 徐明,桂月晶,祁伟彦,等. 绿色荧光蛋白基因标记棉花黄萎病菌[J]. 植物保护,2013,39(5):128-133.
[19] 闫立敏,王晓鸣,徐荣旗,等. 利用绿色荧光蛋白报告基因标记研究麦根腐平脐孺孢对小麦根和叶片的侵染[J]. 中国农业科学,2012,45(17):3506-3514.
[20] 杨珍福,吴毅歆,陈映岚,等. 烟草拮抗内生细菌的筛选与防病促生长效果[J]. 中国烟草科学,2014,35(6):48-53.
[21] 杨珍福,吴毅歆,聂兴成,等. 3株烟草内生细菌促进作物生长作用的研究[J]. 江西农业学报,2014,26(11):58-60.
[22] 刘云霞,张青文. 水稻体内细菌的动态研究[J]. 应用生态学报,1999,10(6):735-738.
[23] 龙良鲲,肖崇刚. 内生细菌01-144在番茄根茎内定殖的初步研究[J]. 微生物学通报,2003,30(5):53-56.
[24] 吴蔼民,顾本康. 内生菌73a在不同抗性品种棉花体内的定殖和消长动态研究[J]. 植物病理学报,2001,31(4):289-294.
[25] 魏春燕,邢永秀,莫遥,等. 绿色荧光蛋白基因标记的固氮菌DX120E在甘蔗植株内的定殖[J]. 作物学报,2014,40(6):1132-1139.
中图分类号:S435.72
文章编号:1007-5119(2015)03-0080-06
DOI:10.13496/j.issn.1007-5119.2015.03.016
基金项目:科技部国际科技合作项目“防治植物病害和促进植物生长的微生物开发应用及机制研究”(2009DFA326360);中国烟草总公司云南省公司项目“普洱市烤烟‘两黑病’综合防控技术研究与应用”(2015YN26)
作者简介:杨珍福(1988-),硕士研究生,主要研究方向为植物病理学。E-mail:ynjcyzf152@126.com。*通信作者,E-mail:ynfh2007@163.com
收稿日期:2014-08-31修回日期:2015-03-30
The Colonization of Endophytic Bacterium YN201448 in Tobacco
YANG Zhenfu1, HE Pengfei1,3, WU Yixin2,3, MAO Zichao2,3, HE Yueqiu1,2*
(1. Faculty of Plant Protection, Yunnan Agricultural University (YAU), Kunming 650201, China; 2. Faculty of Agronomy and Biotechnology, YAU, Kunming 650201, China; 3. National and Local Joint Engineering Research Center for Screening and Application of Microbial Strains, Kunming 650471, China)
Abstract:In order to determine the colonization of endophytic bacterium YN201448 in tobacco, we successfully obtained a stable GFP tagged strain 48-pGFP by transferring the pGFP4412 plasmid into YN201448 via natural transformation. 48-pGFP showed the same antagonistic effect against 5 pathogenic fungi as the wild strain YN201448. 48-pGFP was observed to be distributed in root, stem and leaf tissues of tobacco after its seeds soaked and seedling roots drenched with 48-pGFP. The colonizing bacterium decreased with the trend of root > stem > leaf, and 48-pGFP could colonize in rhizospheric soil stably. Fluorescence microscope observation indicated that 48-pGFP mainly appeared in tobacco stem epidermis, cortex and vascular tissue cells. Therefore, YN201448 could colonize inside and around tobacco plant stably for a relatively long period of time.
Keywords:Bacillus amyloliquefaciens; GFP; antagonistic effect; natural transformation
