SSR标记变性聚丙烯酰胺凝胶快速银染方法的建立
2015-04-16李建武
李建武,李 宁
(1.甘肃省农业科学院马铃薯研究所,甘肃 兰州 730 0 70;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730 0 70)
聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,PAGE)由Raymond和Weintraub[1]建立,是分析蛋白质和核酸的一种常用的电泳方法。由于其具有上样量少、不易扩散、分辨率高且易于观察的特点,在分子生物学及相关学科的基础和临床研究中得以广泛的应用。目前该方法已经广泛应用于遗传图谱构建等过程中AFLP(Amplified fragment length polymorphism)、 SSR(Simple sequence repeats)等分子标记的检测[2-5]。
目前常规的聚丙烯酰胺凝胶的银染过程耗时长,步骤繁琐,大批量的试验不仅费时、费力,且存在染色时间较长或分辨率较低等方面的缺点。为了提高分子标记等试验的效率,利用相同的SSR-PCR产物进行电泳,对文献报道的4种方法[4,6-8]与在An等[8]方法基础上改良的银染方法进行比较,经反复摸索、改良,建立了一种高效、快速的变性聚丙烯酰胺凝胶银染方法。
1 材料与方法
1.1 试验材料
从甘肃省农业科学院马铃薯研究所西北旱作马铃薯观测实验站采集马铃薯20份株系的幼嫩叶片,保存在冰盒中,带回实验室采用北京天根生化科技有限公司植物基因组DNA提取试剂盒(DP305)提取叶片基因组DNA。
1.2 PCR扩增体系和程序
采用SSR-PCR产物来比较分析各种染色方法的效果,引物参考Ghislain等[9]发表的引物STI 034,由生工生物工程(上海)股份有限公司合成。引物序列如下。
正向引物序列:5'-CAAGAAACCAAGAGCAAAT TTCA-3';反向引物序列:5'-TGGCGAATGTGAGAA ACAAA-3'。
PCR反应体系:采用20 μL反应体系,1.5 μL 10×Buffer,0.75 μL dNTP(2.5 mM/L),3 μL DNA(20 μmoL/μL),1.2 μL正向和反向引物(10 mM/L),0.3 μL Taq酶(5U/μL),加ddH2O至体积20 μL。
PCR扩增程序:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,共35个循环;72℃延伸10 min,10℃保存。扩增反应在Bio-T100 PCR仪上进行。
1.3 电 泳
SSR-PCR产物加1/2体积的变性上样缓冲液混合,经95℃变性5 min后置于冰上冷却停止反应,上样量为2.5 μL,采用6%(29:1)变性聚丙烯酰胺凝胶电泳分离扩增片段,稳压1 380 V,电泳120 min,电泳结束后银染显色、拍照。
1.4 银 染
采用5种银染方法,其中参考文献方法4种,试验改良方法1种,各银染方法步骤见表1,银染试验重复2次,试验用水全部采用实验室制作的蒸馏水。

表1 变性聚丙烯酰胺凝胶各银染方法操作过程Table 1 Silver staining methods of polyacrylamide gel
1.5 统计拍照
将银染的玻璃胶板晾干后放置在白炽灯箱上,按照点样顺序逐条对多态性进行比对,在出现差异谱带的地方进行记录,有记为1,无则记为0,不清楚记为“-”,使用数码照相机拍照保存。
2 结果与分析
2.1 不同银染方法的染色效果比较
变性聚丙烯酰胺凝胶不同银染方法银染结果见图1~5。从图中可以看出,银染方法2、3的银染结果背景较深,但方法2、3、4扩增目标片段较为模糊,不够清晰,不利于条带多态性统计;方法1的银染结果背景浅,目标片段清晰,便于条带统计,且条带信息丰富,效果最好。方法5的银染结果背景较浅,呈浅黄色,目标片段较为清晰,便于条带统计。
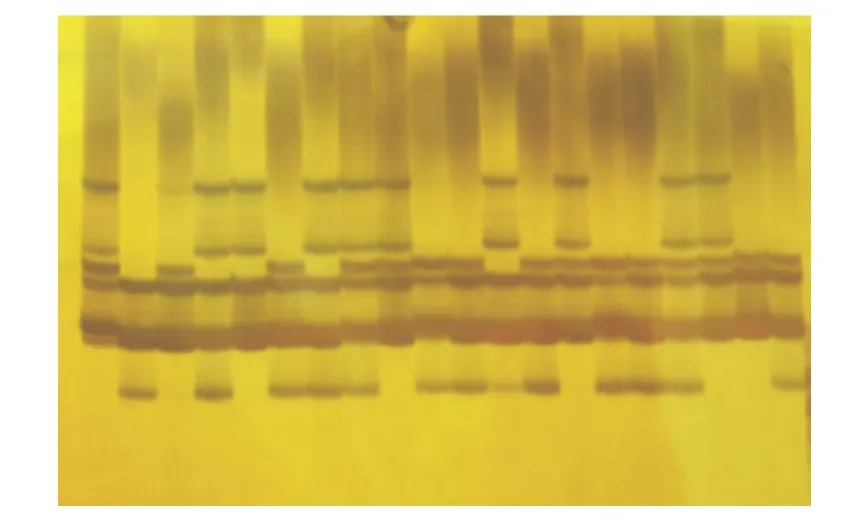
图1 方法1的银染结果Figure 1 Silver staining results for method 1

图2 方法2的银染结果Figure 2 Silver staining results for method 2

图3 方法3的银染结果Figure 3 Silver staining results for method 3

图4 方法4的银染结果Figure 4 Silver staining results for method 4

图5 方法5的银染结果Figure 5 Silver staining results for method 5
2.2 不同银染方法所需试剂
变性聚丙烯酰胺凝胶不同银染方法所需试剂如表2所示。所有操作过程均在1 000 mL蒸馏水溶液中进行。
从表2中可以看出,银染方法1、2所用的冰乙酸、AgNO3和NaOH的用量都比其他方法的用量多,尤其是比较昂贵的AgNO3用量达到了2 g,造成试剂的很大浪费,加大了试验成本。银染方法4用了大量的HNO3,危险性高,不利于操作人员的健康。银染方法3不使用无水乙醇、冰乙酸、HNO3和Na2CO3,是参试方法中试剂用量最少的方法,成本最低。银染方法5降低了部分试剂的使用量,同时减少了对人的伤害和对环境的污染,降低了试验成本。
2.3 不同银染方法所需时间
变性聚丙烯酰胺凝胶不同银染方法所需时间如表3所示。通过表3可知,银染方法1、2、3都耗费了很长的时间,在大批量银染实际操作中是不可取的。银染方法4操作过程需要10 min,耗时最短,银染方法5耗时12 min,这2种方法较其他方法节省了时间,易于批量操作。

表2 5种银染方法所需的各种试剂数量Table 2 Reagents used in five silver staining methods
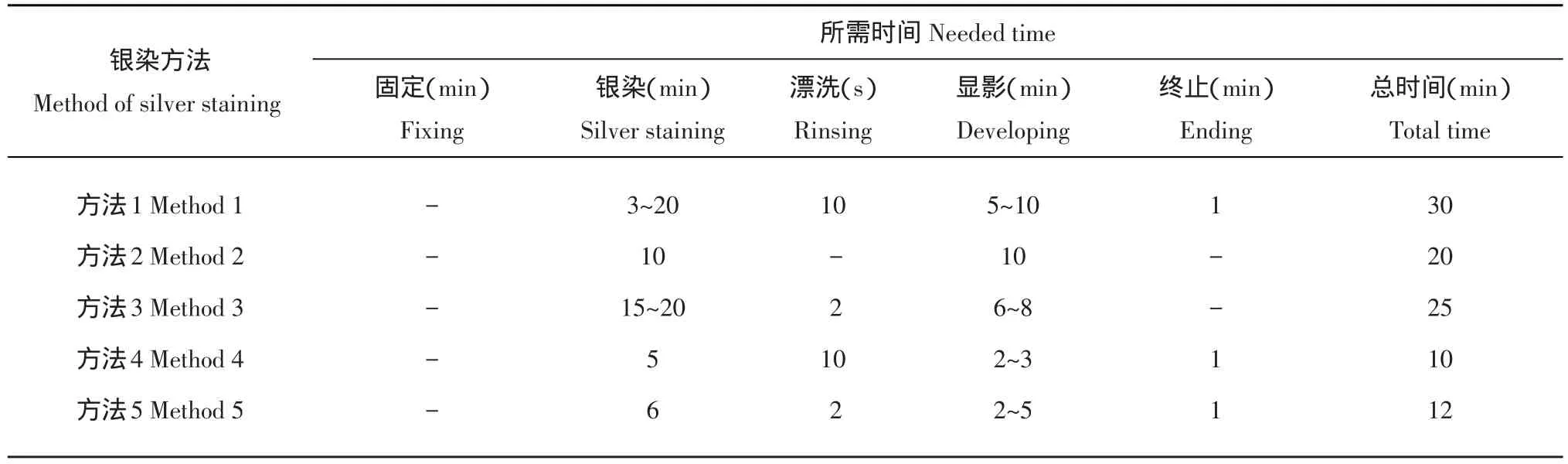
表3 5种银染方法所需时间Table 3 Time needed for five silver staining methods
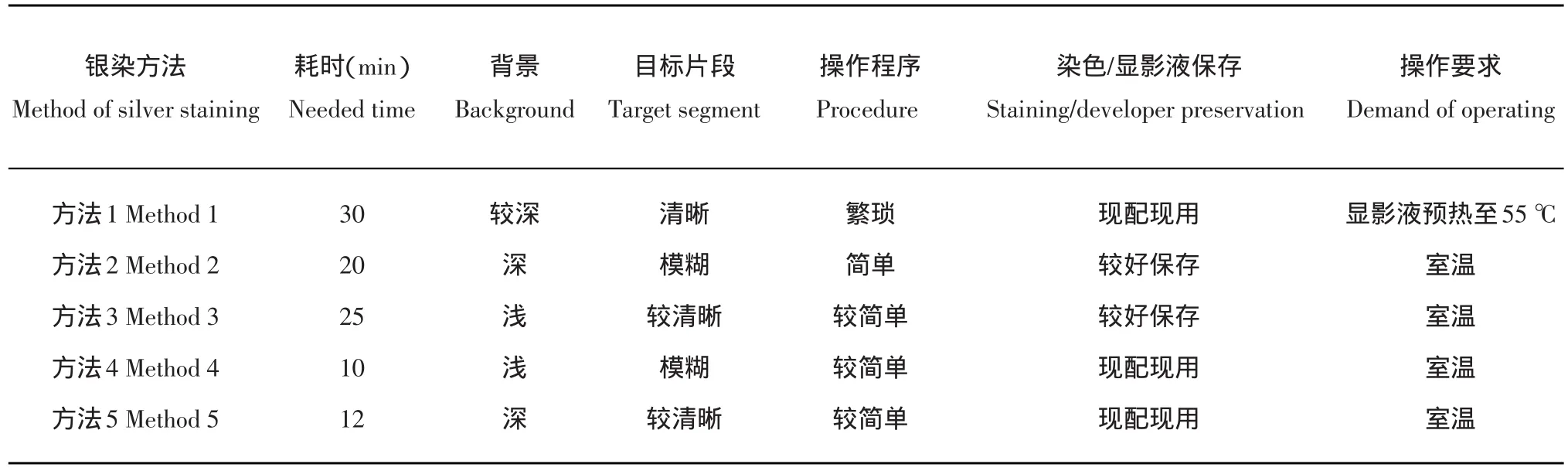
表4 5种银染方法的综合比较Table 4 Comprehensive comparison of five silver staining methods
2.4 不同银染方法的综合比较
对变性聚丙烯酰胺凝胶5种银染方法的操作时间长短、染色背景深浅、目标片段清晰程度、操作步骤、染色/显影液制作和温度条件方面进行综合比较分析(表4)。银染方法1用时长,染色效果最好,但显影过程必须在55℃下进行,显影水溶液温度不易控制,操作繁琐。银染方法2、3耗时长,银染方法4的染色/显影液不能长期保存反复使用。银染方法5操作耗时少,操作简单,显影出的胶板背景颜色深,条带较清晰,便于观察、记录,适宜批量操作。
3 讨论
近年来,随着分子标记技术的日益成熟和数量遗传学统计分析软件的不断更新,开展遗传连锁图谱构建、基因定位等研究均需要较大规模的群体为基础,样品数量多,若想提高整个研究的效率,首先必须从提高DNA提取效率及后续变性PAGE电泳、染色等步骤的效率着手。变性聚丙烯酰胺凝胶银染显色整个过程需要固定、银染、漂洗、显影、终止等多个环节,常规的显色方法需要花费较长的时间。本研究以得到理想的目的片段为前提条件,以缩短显色染色时间、简化操作过程、降低研究成本和提高银染效率为目的。
银染过程容易受试剂纯度、外界温度、水、操作时间等因素影响,研究统一使用实验室制作的蒸馏水,国产分析纯试剂,可能影响了部分银染方法的染色效果。银染方法1(Byun等[6]方法),背景较深,条带清晰,便于统计,但其染色时间长,整个染色过程需要30 min以上,显影液需要保持在55℃,过程繁琐,操作难度大。银染方法2(梁宏伟等[4]方法)与银染方法4(An等[8]方法),操作简单,但条带模糊,不便统计分析。银染方法3(高东等[7]方法),条带清晰程度较差,染色时间较长。改良方法是在An等[8]方法基础上通过减少染色和显影试剂使用量,延长反应时间取得了较好的银染效果。研究改良的高效快速银染方法与常规方法相比,不仅缩短了工作时间,提高了试验效率,还节约了部分化学试剂的种类及用量,降低了试验成本,且取得了可与常规方法相媲美的效果。综上所述,优化后的银染方法可满足变性聚丙烯酰胺凝胶快速银染要求。
[1] Raymond S,Weintraub L.Acrylamide gel as a supporting medium for zone electrophoresis[J].Science,1959,130(3377):711.
[2] Zhang Y J,Lee J B.Genetic polymorphism of Y-chromosomal STR loci in South Korean population[J].Forensic Science International,2007,173(2):225-230.
[3] Ruiz C,Paz B M,Asins M J.A quick methodology to identify sexual seedlings in citrus breeding programs using SSR markers[J]. Euphytica,2000,112(1):89-94.
[4] 梁宏伟,王长忠,李忠,等.聚丙烯酰胺凝胶快速、高效银染方法的建立[J].遗传,2008,30(10):1379-1382.
[5]牛楠,陆丹,李莹.高粱微卫星两种PAGE银染方法的比较[J].沈阳师范大学学报:自然科学版,2010(2):259-261.
[6]Byun S,Fang Q,Zhou H,et a1.An effective method for silverstaining DNA in large numbers of polyacrylamide gels[J]. Analytical Biochemistry,2009,385(1):174-175.
[7] 高东,杜飞,朱有勇.低背景、高分辨率PAGE简易银染法[J].遗传,2009,31(6):668-673.
[8] An Z W,Xie L L,Cheng H,et a1.A silver staining procedure for nucleic acidsin polyacrylanaide gelswithoutfixation and pretreatment[J].Analytical Biochemistry,2009,391(1):77-79.
[9] Ghislain M,Núñez J,Herrera M R,et a1.Robust and highly informative microsatellite-based genetic identity kit for potato[J]. Molecular Breeding,2009,23(3):377-388.

