液相色谱串接质谱联用快速分析肉食品中克仑特罗对映异构体
2015-04-15王占良张建丽赵宇张亦农
王占良 张建丽 赵宇 张亦农
国家体育总局反兴奋剂中心食品药品兴奋剂检测实验室(北京100029)
克仑特罗(Clenbuterol)化学名为2-[(叔丁氨基)甲基]-4-氨基-3,5-二氯苯甲醇盐酸盐, 商品名为克喘素、平喘素等,是一种人工合成的β2-肾上腺素受体激动剂。 由于可明显促进动物生长,并增加瘦肉率,在国内的畜牧业中时有非法使用。 克仑特罗具有蛋白同化作用, 因此作为兴奋剂被世界反兴奋剂机构(World Anti-Doping Agency,WADA)列入禁止运动员使用的一种蛋白同化制剂[1]。 2013年,WADA颁布实施了新技术标准[2],规定尿样中克仑特罗的最低检测浓度为0.2 μg/L,与之前的标准[3]相比较,检测限下降了一个数量级。经人体试验研究证实, 运动员食用了克仑特罗残留浓度为0.1 μg/kg的猪肉或猪内脏, 就会造成运动员尿检阳性[4]。 克仑特罗分子含有一个手性中心,R-(-)-克仑特罗和S-(+)-克仑特罗,比例各占50%,化学结构式见图1。 据报道[5,6],部分克仑特罗阳性的运动员尿样中的R-(-)-克仑特罗和S-(+)-克仑特罗的比例与化学对照品中比例有差异,R-(-)-克仑特罗在尿样中的含量更高。 而目前克仑特罗对映异构体的拆分主要利用高效液相色谱法、毛细管电泳法、薄层色谱法等,以上方法很难满足肉食品样品基质复杂、快速检测的要求。因此, 本研究采用液相色谱串接质谱联用分析肉食品中克仑特罗对映异构体, 旨在建立快速的分析肉食品中R-(-)-克仑特罗和S-(+)-克仑特罗比例的方法,了解肉食品中的克仑特罗异构体比值分布情况是否与标准品有差异。 为解析运动员尿样中克仑特罗的食源性来源提供证据。

图1 R-(-)-克仑特罗和S-(+)-克仑特罗的化学结构式
1 实验部分
1.1 主要仪器与装置
Agilent 1200HPLC/6410A MS/MS液相色谱串接质谱仪:美国安捷伦公司产品,配有电喷雾离子源(ESI);Waters 20孔固相萃取装置: 美国沃特世公司产品;Sigma X3R高速冷冻离心机:美国西格玛奥德里奇公司产品;Ika T18分散机:广州仪科实验室技术有限公司德国伊尔姆真空泵: 德国伊尔姆真空泵制造有限公司产品;Dri-block DB-3D氮气吹干装置:英国TECHNE公司产品;MILIQ纯水机:美国密理博公司产品。
1.2 主要材料与试剂
R-(-)-克仑特罗和S-(+)-克仑特罗购买自Toronto research chemicals inc., 精密称取配制成1 mg/ml的甲醇溶液,化学结构式见图1;D9-克仑特罗购买自澳大利亚标物中心, 精密称取配制成1 mg/ml的甲醇溶液;氢氧化钠、氨水、高氯酸为分析纯:北京化学试剂厂产品;甲醇、甲酸铵:色谱纯,美国DIKMA公司产品;50 ml螺口玻璃离心管、螺口玻璃试管、进样小瓶、进样小瓶铝盖:美国National公司产品;美国西格玛奥德里奇公司产品。
1.3 实验条件
1.3.1 色谱条件
色谱柱:Astec CHIROBIOTICTMT 150 mm×2.1 mm×5 μm;流动相为10 mmol/L甲酸铵的甲醇溶液;流速为0.4 ml/min; 柱温20℃; 进样量10 μl; 样品采集时间7 min。
1.3.2 质谱条件
电喷雾离子源(ESI),正离子模式,扫描方式为多反应检测方式(MRM),采集离子对见表1;干燥气流速为10 L/min;干燥气温度300℃;雾化气压力40 psi。
1.4 肉样前处理方法
肉样200 g,切成直径约1 cm的肉丁,准确称取10 g(误差0.2 g)置于50 ml塑料离心管内,加入质量浓度为0.1 μg/ L的D9-克仑特罗50 μL、20%的甲醇水溶液10 ml,12000 rmp/min的转速匀浆1 min,4 ml的纯净水清洗刀头2次, 合并清洗液于样品塑料离心管内, 加入2 ml的浓高氯酸,蜗旋提取30 s,温度-10℃下10000 rpm/min转速离心8 min, 收集上层提取液于50 ml的塑料离心管内,加入浓度12 Mol/L的NaOH溶液1.4 ml,调节PH在4 ± 1,待净化。
MCX 6 cc 150 mg的固相萃取柱(6 ml的5%的甲醇氨,6 ml的甲醇,6 ml的水,6 ml的0.1 mMol/L的高氯酸溶液依次活化), 将塑料离心管内溶液全部上柱, 6 ml的甲醇淋洗,6 ml的5%的甲醇氨洗脱, 收集洗脱液,在温度65℃下氮气吹干, 加入500 μL的流动相溶液溶解残渣,经0.2 μm针头滤器过滤后,待分析。
2 结果与讨论
2.1 方法优化
克仑特罗在肉食品中主要以游离形式为主, 而且克仑特罗呈弱碱性,适合采取酸性提取,提取物中含有蛋白质、脂肪等杂质,基质效应明显,采取MCX固相萃取柱纯化后,基质效应明显降低,见2.2图2。 结果显示,样品采取酸性提取,MCX固相萃取柱纯化, 基质干扰少,可以满足检测要求。通过比较不同流速和柱温对克仑特罗保留的影响, 结果显示化合物随流速的降低可以获得更长的保留, 柱温的降低可以延长保留时间并获得更好的色谱分离。 经过优化,最终选择流速0.4 ml/min,柱温20℃。 通过比较不同碰撞能量下离子对响应强度的变化,对R-(-)-克仑特罗和S-(+)-克仑特罗的质谱条件进行优化,结果列于表1。

表1 克仑特罗的质谱参数
2.2 方法专属性
称取约10 g的空白肉食品样品, 分别添加了检测限浓度S-(+)-克仑特罗、R-(-)-克仑特罗的肉样,按照1.4方法进行操作, 所得到的多反应离子对监测色谱图示于图2。 结果表明,R-(-)-克仑特罗和S-(+)-克仑特罗的特征离子对分离良好,相互间没有影响和变化;R-(-)-克仑特罗和S-(+)-克仑特罗的出峰位置在空白样品中无干扰峰出现,该方法具有较好的专属性。

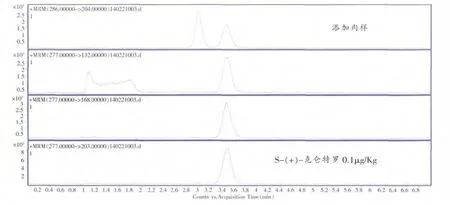
图2 样品中R-(-)-克仑特罗和S-(+)-克仑特罗的色谱分离图
2.3 校准曲线、检出限及定量限
配制R-(-)-克仑特罗和S-(+)-克仑特罗质量浓度为0.2~4 μg/kg的系列样品各1份,经1.4的前处理方法处理并仪器分析后,以R-(-)-克仑特罗和S-(+)-克仑特罗的定量离子色谱峰面积与D9-克仑特罗的定量离子色谱峰面积之比(Y)为纵坐标,以分析物标准溶液的质量浓度(X)为横坐标做校准曲线,线性方程结果见表2。由表2中数据可看出,各分析物校准曲线相关系数平方均大于0.99,表明目标分析物在质量浓度0.2~4 μg/kg内具有良好的线性关系,且无背景干扰。
检出限(LOD)和定量限(LOQ)采用向空白样品中逐级降低加标浓度的方法来确定。 以3倍信噪比(S/N=3)对应的目标物浓度作为检出限,以S/N=10对应的目标物浓度作为定量限, 获得的各目标物的检出限和定量限见表2。

表2 R-(-)-克仑特罗和S-(+)-克仑特罗的线性方程、检测限和定量限
2.4 回收率、日内及日间精密度
日内精密度、日间精密度均是每个质量浓度点做6个平行样本,连续4天进样。表3是添加水0.2、0.6及4 μg/kg时的回收率、日内及日间精密度。 由数据可以看出,R-(-)-克仑特罗和S-(+)-克仑特罗在3种添加水平下平均回收率为81.1%~110.2%, 日内精密度为2.4%~5.4%,日间精密度为5.3%~7.8%,能够满足常规检测需要。

表3 不同添加水平下各目标物的加标回收率、日内及日间精密度(RSD)(n=6)
2.5 阳性样品中克仑特罗异构体比值情况
以R-(-)-克仑特罗的峰面积与内标中D9-R-(-)-克仑特罗的比值与S-(+)-克仑特罗内标中D9-S-(-)-克仑特罗的比值相比计算后确定为该样品中克仑特罗异构体比值。
在添加的0.4 μg/kg和2 μg/kg克仑特罗对照品的空白肉食品中, 经计算其R构型/S构型的比值为1.00和1.02,与克仑特罗标准品中比值基本一致。 说明本方法可以真实反映和计算出肉食品中R构型/S构型的比值,证明该方法的可靠性和重现性。
采用本方法, 对实验室采集自全国各地的85例含有克仑特罗肉样样品进行分析和计算,结果见图3。R构型/S构型比值最大值为2.82,最小值为0.69,平均值为1.47。 在全部85例样品中, 比值高于2的有14例, 占比16.5%;比值在1.47和2之间的有22例,占比25.9%;比值在1到1.47之间的有40例,占比47.1%;比值小于1的有9例,占比10.6%。 以上结果说明,接近90%的检出克仑特罗的肉食品中,R构型/S构型比值高于1,证明现有主要受克仑特罗污染的肉食品中R构型的浓度比S构型的浓度更高。此结果与文献报道[6]的克仑特罗阳性运动员的尿样中R构型和S构型比值高于1是一致的,为证明运动员尿液中克仑特罗的食源性来源提供了重要证据。
3 总结
本研究建立了液相色谱串接质谱联用法分析肉食品样中R-(-)-克仑特罗和S-(+)-克仑特罗比值的检测方法。 采用固相萃取柱纯化,可显著降低基质效应。该方法样品前处理简单、快速、可靠。
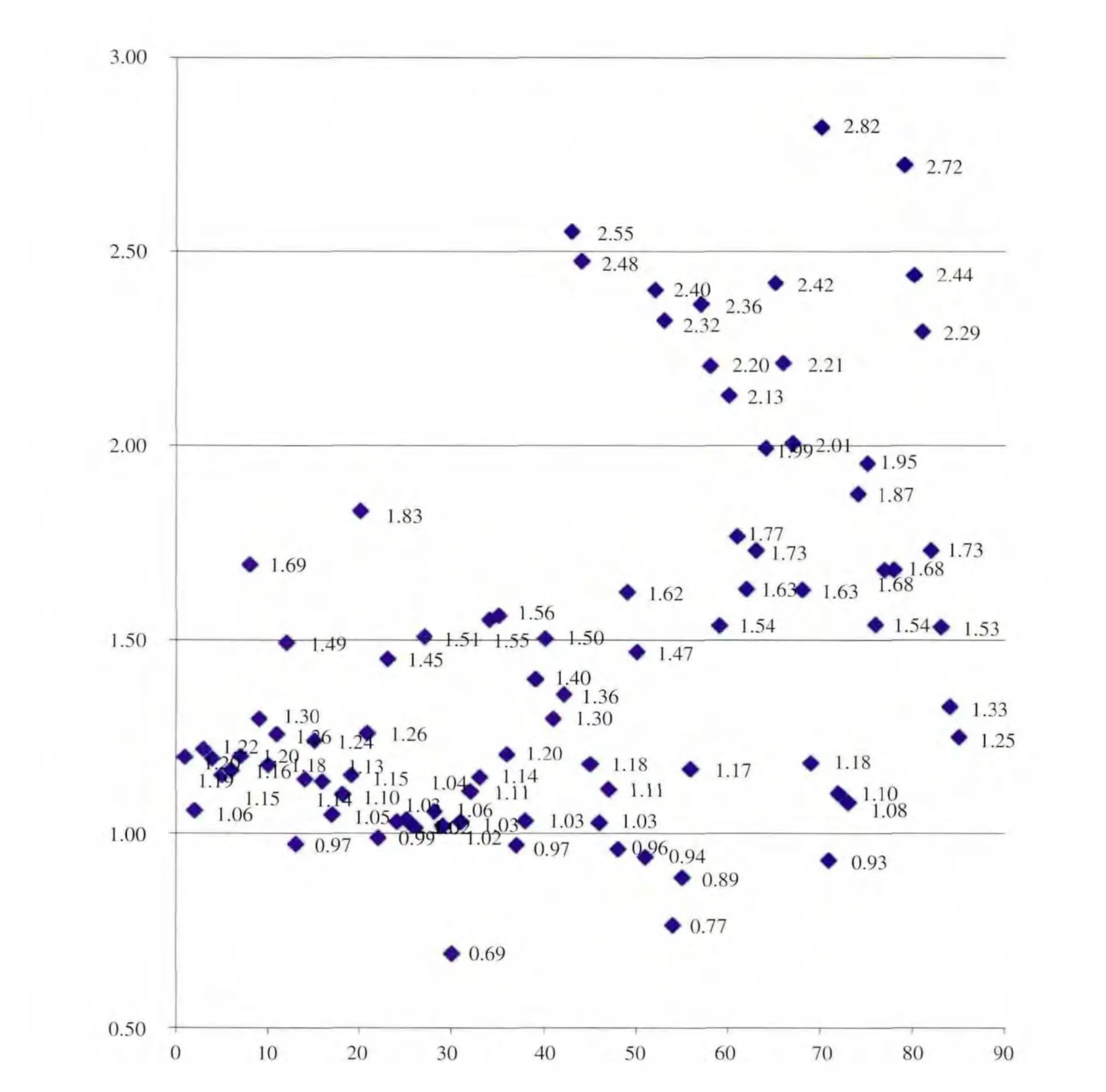
图3 阳性肉食品中克仑特罗异构体间比值(R构型/S构型)
[1] World anti-doping agency.WADA Prohibited list 2013. 2013:1-9.
[2] World anti -doping agency.TD2013 MRPL - Minimum Required Performance Levels.,2013:1-4.
[3] World anti -doping agency.TD2007 MRPL - Minimum Required Performance Levels. World anti-doping agency,2007:1-4.
[4] 张建丽,王占良,高照,等. 人体食源性盐酸克伦特罗尿样兴奋剂阳性可能性研究 [J]. 中国运动医学杂志,2010,29(5):580-583.
[5] Smith DJ. Stereochemical composition of clenbuterol residues in edible tissues of swine [J]. J Agr Food Chem,2000,48:6036-6040.
[6] Mario T,Andreas T,Simon B,et al. Does the analysis of the enantiomeric composition of clenbuterol in human urine enable the differentiation of illicit clenbuterol administration from food contamination in sports drug testing [J]. Rapid Commun. Mass Spetrom,2013,27:507-512.
