MTDH在肝细胞癌发展过程中的表达及意义
2015-04-14罗义欢刘泳汝熊货杰史振鸿杨丽桦党裔武
罗义欢,刘泳汝,谭 忠,熊货杰,史振鸿,杨丽桦,党裔武
(广西医科大学第一附属医院病理科1、肿瘤内科2,广西 南宁530021)
MTDH在肝细胞癌发展过程中的表达及意义
罗义欢1,刘泳汝1,谭 忠1,熊货杰1,史振鸿1,杨丽桦2,党裔武1
(广西医科大学第一附属医院病理科1、肿瘤内科2,广西 南宁530021)
目的探讨异黏蛋白(MTDH)的表达与肝细胞癌(HCC)发生发展的关系及其意义。方法应用免疫组织化学方法检测89例肝癌及其癌旁肝组织,37例肝硬化和25例正常肝组织中MTDH蛋白以及CD34,血管内皮生长因子(VEGF),肿瘤转移抑制基因蛋白(nm23)、p53、p21、Ki-67的表达,并分析MTDH与临床病理参数以及系列免疫组化指标的相互关系。结果HCC组MTDH的阳性率为57.3%,明显高于肝硬化组织的29.7%和正常肝组织的24.0%,差异均有统计学意义(P<0.05);MTDH的表达与肿瘤的T分级、远处转移、HBV感染、不同程度微血管密度、nm23以及Ki-67的表达密切相关(P<0.05);61例肝癌随访中,总平均复发时间为(57.841±3.025)个月,MTDH阳性表达组的平均复发时间为(47.791±4.226)个月,低于阴性表达组的(59.418±3.507)个月,但差异无统计学意义(P>0.05)。结论MTDH可能是一个潜在的评估HCC进展和预后的新生物学标志物,对肝癌的侵袭转移、血管生成等起重要作用。
肝细胞癌;异黏蛋白;免疫组织化学;转移
肝细胞癌(Hepatocellular carcinoma,HCC)是全球性高发的恶性肿瘤,每年有近78.25万的新发病例[1]。过去的十年,由于HCC确诊多为晚期,故发病率呈平稳升高趋势。近年的研究显示异黏蛋白(Metadherin,MTDH)在多种人类肿瘤中过表达,故检测其表达有助于早期诊断和判断肿瘤进程及预后。在多种人类肿瘤细胞中的研究显示MTDH异常表达可促进肿瘤细胞的增殖、侵袭转移、新生血管形成等特性[2-8]。MTDH在HCC中的表达在国内外已有相关研究[9-11],但是MTDH在HCC不同发展进程中的研究鲜见报道。因此,本研究采用免疫组织化学技术检测正常肝组织、肝硬化、癌旁肝组织以及HCC组织中MTDH的表达,并进一步结合部分常见生物标记物以及HCC患者的临床病理参数探讨MTDH在肝癌发生发展中的临床意义。
1 材料与方法
1.1 实验标本 收集广西医科大学第一附属医院病理科2008年3月至2011年2月根治性手术切除且病理证实的HCC及对应癌旁组织标本89例,肝硬化组织37例,正常肝组织25例。HCC标本中,男性72例(80.9%),女性17例(19.1%);年龄27~73岁,平均49岁;其中有61例采用电话随访2~70个月,至随访结束时,复发9例,未复发52例。本研究获得院伦理委员会批准,标本以及各项临床病理资料的收集均遵守赫尔辛基宣言。
1.2 实验试剂 MTDH兔抗人单克隆抗体购自美国Epitonics公司,稀释度为1:200,二抗SupervisionTM检测系统购自上海长岛生物技术有限公司,DAB显色系统购自福州买新生物技术有限公司。
1.3 实验方法 MTDH、CD34、内皮生长因子(VEGF)、肿瘤转移抑制基因蛋白(nm23)、p53、p21、Ki-67蛋白的免疫组化染色(IHC)采用二步法,操作严格按照试剂说明书进行。染色结果由两位病理医师采用双盲法阅片及双评分半定量积分法评分,凡细胞核内和(或)细胞质内中出现棕黄色颗粒者视为MTDH表达阳性细胞。每例组织随机计数片中10个高倍视野中阳性细胞率,无阳性染色细胞为0分,阳性染色细胞<10%为1分,阳性染色细胞11%~50%为2分,阳性染色细胞51%~80%为3分,阳性染色细胞>80%为4分;显色程度按照切片内细胞显色有无和深浅评分,细胞内无染色为0分,呈淡黄色为1分,棕黄色为2分,呈棕色为3分;最后两分相乘,乘积>3分的均看作阳性表达[12]。
1.4 统计学方法 应用SPSS20.0统计软件包进行数据分析,使用χ2检验分析MTDH在不同临床病理参数及免疫组化指标中的表达差异,使用Kruskal-WallisH检验分析MTDH在不同分化程度组织中的表达差异。Spearman秩相关检验用于分析MTDH的表达与病理参数及免疫组化指标的相关性。生存分析使用Kaplan-Meier法、Log-rank检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 MTDH在HCC及非癌肝组织中的表达 MTDH的表达主要在细胞核和细胞质中,见图1。其在HCC组织中的阳性率为57.3%,高于癌旁组织的42.7%,但差异无统计学意义(χ2=3.798,P>0.05),HCC组织中MTDH阳性率明显高于肝硬化组织的29.7%及正常肝组织的24.0%,差异均有统计学意义(χ2=7.950、8.659,P≤0.05),见表1。

表1 不同病变的肝组织MTDH的表达[例(%)]

图1 MTDH在不同病变肝组织中的表达
2.2 MTDH表达与临床病理参数的关系 MTDH在病理分期为Ⅲ~Ⅳ组,有远处转移组,HBV感染组表达的阳性率明显高于分期为Ⅰ~Ⅱ组,无远处转移组,无HBV感染组,差异均有统计学意义(P<0.05)。Spearman秩相关法分析显示,MTDH的表达与病理分期(r=0.216,P=0.043),远处转移(r=0.256,P=0.015)及HBV感染(r=-0.227,P=0.033)显著相关。MTDH的表达与患者的年龄、性别、分化程度、肿瘤大小、肝硬化、包膜、癌栓、脉管转移、HCV感染无明显相关(P>0.05),见表2。
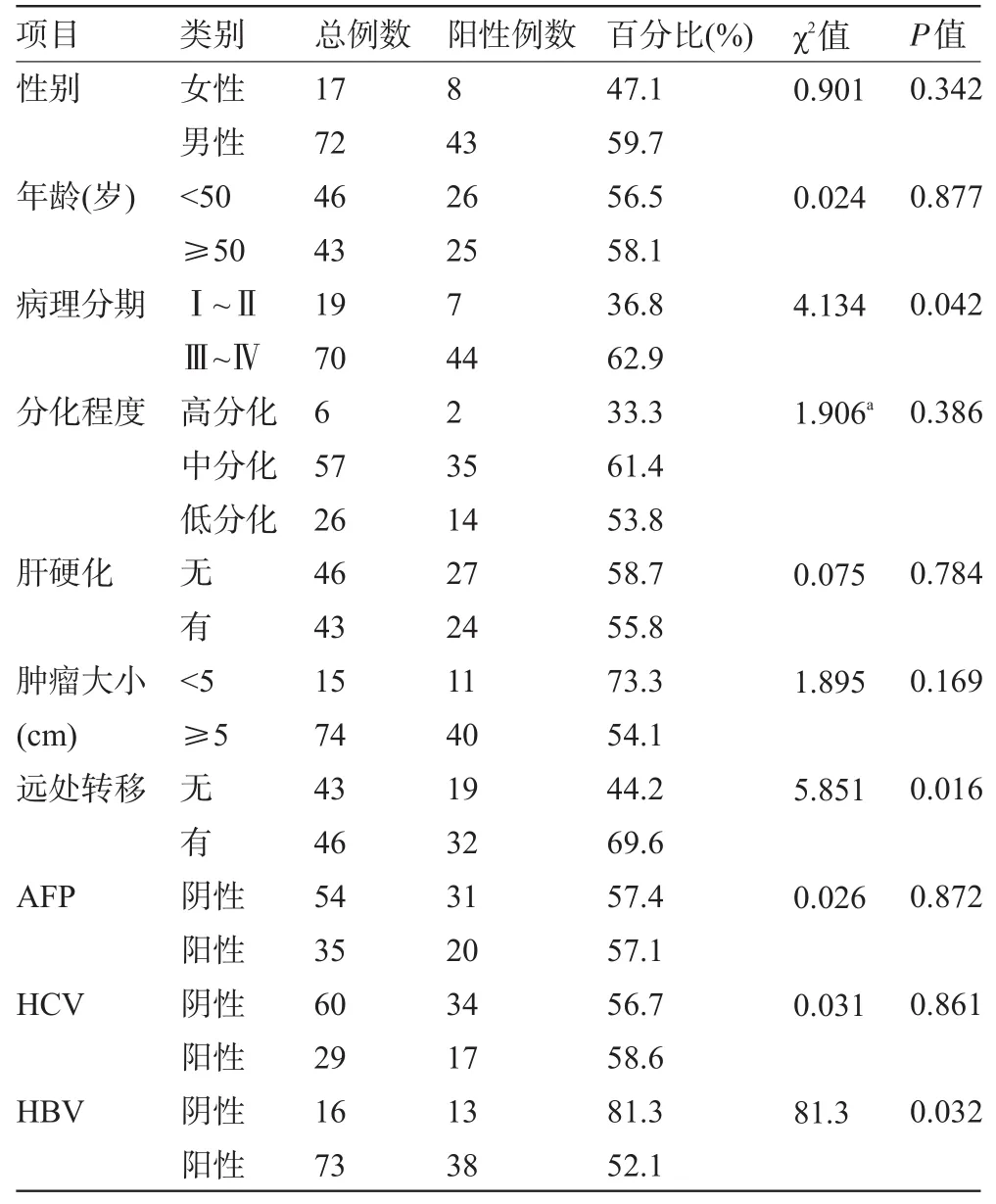
表2 MTDH的表达与HCC临床病理特征的关系
2.3 MTDH与其他免疫组化指标的关系 CD34表达结果用微血管密度(Microvessel density,MVD)表示,其中MVD高表达组MTDH表达的阳性率70.6% (24/34)显著高于MVD较小组49.1%(27/55),差异有统计学意义(χ2=3.969,P=0.046)。同时,MTDH的表达在nm23、Ki-67阳性组明显高于对应的阴性组[64.0%(48/75):21.4%(3/14),χ2=8.739,P=0.003;74.4% (32/43):41.3%(19/27),χ2=9.961,P=0.001],见表3。Spearman秩相关法分析显示MTDH的表达与MVD (r=0.211,P=0.047)、nm23(r=0.313,P=0.003)、Ki-67 (r=0.335,P=0.001)显著相关。然而MTDH的表达与VEGF、p53、p21的表达无明显相关(P>0.005)。
2.4 MTDH表达与HCC复发的关系61例随访病例中,9例复发,其中4例MTDH表达阴性,5例MTDH表达阳性。总平均复发时间为(57.841±3.025)个月,MTDH阴性表达组平均复发时间为(47.791±4.226)个月,低于阳性表达组的(59.418±3.507)个月。经Kaplan-Meier和Log-rank检验方法分析了MTDH对患者复发率的影响(见图2),结果显示其差异无统计学意义(χ2=0.668,P=0.414)。

表3 MTDH的表达与其他免疫组化指标的关系

图2 MTDH蛋白的表达与HCC患者复发的关系
3 讨 论
MTDH又名星形胶质细胞升高基因1(Astrocyte elevated gene,AEG-1),定位于染色体8q22.1,该染色体是HCC等多种肿瘤细胞系中相关基因突变的热点区域[13]。近年的研究显示MTDH是一个癌基因,在多种恶性肿瘤中高表达,如:黑色素瘤、乳腺癌、胃癌、结直肠癌、头颈部鳞状细胞癌、非小细胞肺癌、肝细胞肝癌、食道鳞癌、卵巢癌、宫颈癌、子宫内膜癌等[2-11]。MTDH的高表达参与H-ras、NF-κB及Wnt/β-catenin等多个重要的信号调控通路,从而发挥调控细胞转化、凋亡、增殖、迁移和肿瘤转移的作用。虽然MTDH的致癌作用已被证实,但它作为一个癌基因的潜在功能和作用机制尚未完全明确。本研究采用免疫组化方法初步探讨了MTDH蛋白在HCC发展的不同阶段中的表达,结果表明HCC组织中MTDH的表达呈逐渐升高趋势,故本课题组推测其在HCC发生发展过程中起促癌的作用。然而与预测不相符的是MTDH在正常肝、肝硬化和癌旁肝组织中的表达没有明显差异,是否MTDH只在肝硬化发展至HCC阶段中通过上调其表达而发挥促癌作用,或者是因为该几组样本量偏少而引起的偏差有待进一步研究证实。
结合临床病理参数分析发现,MTDH的表达与HCC的病理分级及其远处转移密切相关,可见MTDH是促进HCC进一步发展的一个关键作用因子。该结果与龚振斌[14]的研究报道相一致,其研究发现MTDH的表达水平与HBV相关的HCC患者的病理分期、组织分化程度、血管侵犯、T分级、N分级之间密切相关。此外,本研究还发现MTDH的表达与HBV感染呈负相关,HBV感染组反而出现MTDH低表达。HBV与HCC关系已成共识,因此我们推测HBV感染与MTDH的表达可能有相互抑制的作用,其相关的作用机制尚未见报道,有待进一步的深入研究。
高血管密度是HCC的特征之一,在HCC快速生长过程中,肿瘤容易出现缺氧和缺乏营养素,因此肿瘤细胞会释放VEGF等激活内皮细胞以促进血管形成。本研究中我们通过检测标记物CD34判断HCC肿瘤组织中的微血管密度,结果发现MTDH的表达与肿瘤MVD正相关,高MVD组其表达明显升高。HCC微阵列分析显示MTDH可以调节多个与侵袭、转移、血管形成相关基因的表达,如促进血管生成素(Angiopoietin)-1,并增加了肿瘤MVD;同时其经PI3K/AKT途径增加了脐静脉内皮细胞侵袭能力及在基质胶中管状结构的形成,后者与酪氨酸激酶受体2(Tie2)的表达相关,siRNA干扰Tie2后显著抑制此成管能力[15]。乳腺癌中的研究也证实MTDH表达与MVD和VEGF表达之间呈现明显的正相关[2]。
本研究结果显示MTDH的表达量随着病理分级上升而增加,与Ki-67蛋白的表达亦呈正相关。MTDH的表达在发生远处转移组明显高于无转移组,然而却与nm23蛋白的表达呈正相关,是否因为nm23阴性组样本数过少而导致结果的偏差有待进一步增加样本研究证实,其余结果均与相关报道比较一致。Emdad等[16]在永生性大鼠胚胎成纤维细胞中稳定表达MTDH可使细胞发生形态学改变且侵袭性增强,表达MTDH的大鼠胚胎成纤维细胞克隆可引发裸鼠肿瘤形成;Kang等[17]的研究表明MTDH的过表达能增加肿瘤的转移能力和侵袭性,当沉默MTDH基因后能降低人肿瘤的转移和侵袭;MTDH在乳腺癌细胞系中的异常表达能增强细胞增殖能力和在软琼脂上的生长能力,而通过RNA干扰后则抑制细胞增殖和克隆形成能力[2,9]。因此,MTDH可望成为HCC病理分级以及转移等肿瘤预后相关的一个参考指标。
[1]Cai ZQ,Si SB,Chen C,et al.Analysis of prognostic factors for survival after hepatectomy for hepatocellular carcinoma based on a bayesian network[J].PLoS One,2015,10(3):e0120805.
[2]Li C,Li R,Song H,et al.Significance of AEG-1 expression in correlation with VEGF,microvessel density and clinicopathological characteristics in triple-negative breast cancer[J].Journal of Surgical Oncology,2011,103(2):184-192.
[3]Wan L,Kang Y.Pleiotropic roles of AEG-1/MTDH/LYRIC in breast cancer[J].Advances in Cancer Research,2013,120:113-134.
[4]Li G,Wang Z,Ye J,et al.Uncontrolled inflammation induced by AEG-1 promotes gastric cancer and poor prognosis[J].Cancer Research,2014,74(19):5541-5552.
[5]Song H,Tian Z,Qin Y,et al.Astrocyte elevated gene-1 activates MMP9 to increase invasiveness of colorectal cancer[J].Tumour biology:the journal of the International Society for Oncodevelopmental Biology and Medicine,2014,35(7):6679-6685.
[6]Wang YP,Liu IJ,Chiang CP,et al.Astrocyte elevated gene-1 is associated with metastasis in head and neck squamous cell carcinoma through p65 phosphorylation and upregulation of MMP1[J].Molecular Cancer,2013,12(1):109.
[7]He W,He S,Wang Z,et al.Astrocyte elevated gene-1(AEG-1)induces epithelial-mesenchymal transition in lung cancer through activating Wnt/beta-catenin signaling[J].BMC Cancer,2015,15:107.
[8]Jung HI,Ahn T,Bae SH,et al.Astrocyte elevated gene-1 overexpression in hepatocellular carcinoma:an independent prognostic factor [J].Annals of Surgical Treatment and Research,2015,88(2):77-85.
[9]Yu C,Chen K,Zheng H,et al.Overexpression of astrocyte elevated gene-1(AEG-1)is associated with esophageal squamous cell carcinoma(ESCC)progression and pathogenesis[J].Carcinogenesis,2009,30(5):894-901.
[10]Song H,Li C,Lu R,et al.Expression of astrocyte elevated gene-1: a novel marker of the pathogenesis,progression,and poor prognosis for endometrial cancer[J].International Journal of Gynecological Cancer,2010,20(7):1188-1196.
[11]Song E,Yu W,Xiong X,et al.Astrocyte elevated gene-1 promotes progression of cervical squamous cell carcinoma by inducing epithelial-mesenchymal transition via Wnt signaling[J].International Journal of Gynecological Cancer,2015,25(3):345-355.
[12]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[13]Poon TC,Wong N,Lai PB,et al.A tumor progression model for hepatocellular carcinoma:bioinformatic analysis of genomic data[J]. Gastroenterology,2006,131(4):1262-1270.
[14]龚振斌.异黏蛋白(metadherin)在肝细胞肝癌中的表达及其作用[D].西安:第四军医大学,2012.
[15]Yoo BK,Emdad L,Su ZZ,et al.Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J]. The Journal of Clinical Investigation,2009,119(3):465-477.
[16]Emdad L,Lee SG,Su ZZ,et al.Astrocyte elevated gene-1(AEG-1) functions as an oncogene and regulates angiogenesis[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(50):21300-21305.
[17]Kang DC,Su ZZ,Sarkar D,et al.Cloning and characterization of HIV-1-inducible astrocyte elevated gene-1,AEG-1[J].Gene,2005,353(1):8-15.
Significance of MTDH expression in the developing process of hepatocellular carcinoma.
LUO Yi-huan1,LIU Yong-ru1,TAN Zhong1,XIONG Huo-jie1,SHI Zhen-hong1,YANG Li-hua2,DANG Yi-wu1.Department of Pathology1, Departmetn of Medical Oncology2,the First Affiliated Hospital of Guangxi Medical University,Nanning530021, Guangxi,CHINA
ObjectiveTo investigate the relationship between the expression of metadherin(MTDH)and the carcinogenesis of hepatocellular carcinoma(HCC)and its related significance.MethodsImmunohistochemistry was adopted to detect the expression levels of MTDH,CD34,vascular endothelial growth factor(VEGF),nm23,p53,p21 and Ki-67 in a cohort of89 pairs of HCC tissues and their matched adjacent hepatic tissues,37 cases of hepatocirrhosis tissues and25 cases of normal hepatic tissues.Meanwhile,we analyzed the correlation between MTDH and several clinicopathological parameters as well as some immunohistochemical indexes.ResultsThe positive rate of MTDH expression in HCC tissues(57.3%)was significantly higher than that in either hepatocirrhosis tissues(29.7%)or normal hepatic tissue(24.0%,P<0.05).The MTDH expression was closely related to T category,distant metastasis,HBV infection,microvessel density and the expression of nm23 and Ki-67(P<0.05).For the61 cases of HCC which were followed up,the overall average recurrence time was(57.841±3.025)months,and no statistical significance was found between MTDH-positive group[(47.791±4.226)months]and MTDH-negative group[(59.418±3.507)months],P>0.05.ConclusionMTDH might be implicated as a crucial part in invasion,metastasis and angiogenesis in HCC, which has the potential to be a novel biomarker for the assessment of the development and prognosis of HCC.
Hepatocellular carcinoma;Metadherin;Immunohistochemistry;Metastasis
R735.7
A
1003—6350(2015)22—3288—04
2015-05-15)
10.3969/j.issn.1003-6350.2015.22.1194
国家自然科学基金(编号:81560489);广西自然科学基金(编号:2015GXNSFBA139157);广西教育厅科研项目(编号:LX2014075);广西医科大学青年科学基金项目(编号:GXMUYSF201311);广西卫生厅科研课题(编号:Z2014054);广西医科大学大学生创新创业项目(编号:201410598003)。
党裔武。E-mail:dangyiwu@126.com
