脂易消对NAFLD大鼠Visfatin蛋白表达的影响*
2015-04-12周岳君陈玉翠
周岳君 陈玉翠
非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(Insulin resistance,IR)和遗传易感密切相关的代谢应激性肝脏损伤,其病理学改变与酒精性肝病(ALD)相似,但患者无过量饮酒史,疾病谱包括非酒精性单纯性脂肪肝(Nonalcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis, NASH)、及相关肝硬化和肝细胞癌[1-4]。NAFLD是21世纪全球重要的公共健康问题之一,亦是我国愈来愈重视的慢性肝病,加强NAFLD的预防与治疗,延缓和阻止NAFLD的发生、发展成为当前中西医研究的热点[5-6]。
NAFLD的发病机理至今尚未十分明确,近年有学者认为脂肪细胞因子在肝脂肪变性进程中可能起着十分重要的作用。其中内肥素(Visfatin)因具有类胰岛素作用可降低血糖、参与脂肪代谢等生理环节而备受关注[7-8]。本实验采用高脂饮食喂养制备NAFLD大鼠模型,通过中药验方脂易消予以干预,阐明Visfatin与NAFLD发病的相关性,探讨NAFLD的发病机理和中医药治疗NAFLD的作用机制。
1 材料与方法
1.1 实验动物 清洁级SD大鼠60只,雄性,体重(180±10)g,由中科院上海实验动物中心提供,饲养于浙江中医药大学实验动物中心,室温23 ℃,湿度50%,明暗各12 h,随机分笼喂养,自由饮水和采食,预养1周后进入实验阶段[9]。
1.2 药物 脂易消:半夏、枳壳、荷叶、水飞蓟、泽泻、决明子等生药材购自浙江省杭州市方回春堂国药馆[10]。易善复胶囊(多烯磷脂酰胆碱胶囊):北京万安特制药有限公司,228 mg/粒,批号:D1141。使用前用蒸馏水超声乳化,配制成1 L含多烯磷脂酰胆碱132.4 g。生理盐水:浙江莎普爱思药业有限公司,批号:110313-3。
1.3 器材 GKC可控硅恒温水浴锅,上海锦屏仪器仪表有限公司。3000紫外线分光光度仪,Pharmacin公司。TGL68高速台式离心机,上海安宁科学仪器厂。OLIMPUS显微镜,日本OLYMPUS公司。7170全自动生化分析仪,日本AAS公司。Hoefer300电转 仪;IS1000凝 胶 成 像 仪;MyCycler PCR仪;The BioRadiCyclerIq PCR仪;Optical Caps (8 Caps/Strip)(Applied Biosystems; Cat # 4323032);Optical Adhesive Covers (Applied Biosystems; Cat # 4311971,美国BioRad公司。WD900TL23-2微波炉,Galanz。ZF-90型暗箱式紫外透射仪,上海顾村电光仪器厂。DYY-6B型稳压稳流电泳仪,北京市六一仪器厂。DNA离心干燥箱,上海安亭科学仪器厂。Ultrospec3300pro微量核酸测量仪,Ampersand。冷冻台式高速离心机,Heraeus。可调微量加样枪,Thermo Labsystems。-80 ℃低温冰箱,Sanyo。AR2130电子精密天平OhausCorp.Pine Brook,NJ,USA。YDS-3S液氮生物容器,四川亚西机器厂[11-12]。
1.4 试剂 TG检验试剂盒,上海申能-德赛有限公司,批号:571/017/01;TC检验试剂盒,上海申能-德赛有限公司,批号:130/016/01;氯仿(分析纯)浙江迪耳药业有限公司。异丙醇(分析纯),浙江杭州双林化工试剂厂。琼脂糖(agarose)溴化乙锭(EB),上海生工生物工程技术服务有限公司。M-MLV RTase,invitrogen。Taq 酶,Oligod(T)18Primers,RNase inhibitor,dNTP,100 bp marker等。
1.5 方法
1.5.1 造模与分组 将60只雄性SD大鼠随机分成脂易消低、中、高剂量治疗组,易善复阳性对照组,模型对照组和正常对照组6组,每组各10只。正常组予普通饲料喂养,其余予高脂饲料喂养(内含10%猪油、2%胆固醇、0.5%胆盐、5%蛋黄粉,82.5%普通饲料)喂养,造模12周后处死动物。
1.5.2 给药途径及剂量 脂易消低、中、高剂量治疗组干预剂量分别相当于成人每千克体重临床用量的3、6、12倍,易善复剂量相当于成人每千克体重临床用量的6倍,均为临床等效剂量。实验剂量按照实验动物研究“等效剂量”的计算方法(50 kg人/200 g大鼠的转换系数r=0.021)计算等效脂易消剂量[13]。实验剂量经计算确定如下:低剂量组,高脂饲料喂养,按等效剂量7.5 g/(kg·d)灌胃,共12周;中剂量组,高脂饲料喂养,按等效剂量15 g/(kg·d)灌胃,共12周;高剂量组,高脂饲料喂养,按等效剂量30 g/(kg·d)灌胃,共12周;易善复组,高脂饲料喂养,按等效剂量69.2 mg/(kg·d)灌胃,共12周;正常组,标准饲料喂养,等容量的生理盐水灌胃,1次/d,共12周;模型组,高脂饲料喂养,等容量的生理盐水灌胃,1次/d,共12周。
1.5.3 标本采集与保存 实验大鼠饲养至第12周末次给药后,当晚禁食12 h但不禁水,次日上午用10%水合氯醛溶液(3 mL/kg)腹腔注射麻醉后,心脏取血,分离血清,置于-20 ℃冰箱保存待用;迅速取出肝组织,称重,在肝右叶中部切取数块肝组织保存于液氮中以备用。
1.5.4 指标检测
1.5.4.1 肝组织匀浆TC、TG变化检测 将玻璃试管中新鲜肝组织称重,精密称定,剪碎后加入9倍冰生理盐水,用均质机磨成10%肝组织匀浆后,4000 r/min离心10 min,提取上清液,上清液即为肝组织匀浆制品。肝匀浆TC、TG测定均按试剂盒说明操作。
1.5.4.2 肝组织病理学检测 取大鼠肝脏右叶肝组织,HE染色观察肝组织炎症、细胞变性情况等一般病理改变。非酒精性脂肪性肝炎病理学诊断标准参考《非酒精性脂肪性肝炎诊断指南》实施[1]。(1)依据肝细胞脂肪变性占据所获取肝组织标本量的范围,分为5度(F0~4):F0:肝细胞内无脂滴沉积;F1:肝小叶内<30%的肝细胞有脂肪变;F2:肝小叶内30%~50%的肝细胞有脂肪变;F3:肝小叶内50%~75%的肝细胞有脂肪变;F4:75%以上的肝细胞有脂肪变。(2)依据炎症程度分为4级,G0:无炎症;G1:腺泡3带呈现少数气球样肝细胞,腺泡内散在个别点灶状坏死;G2:腺泡3带明显气球样肝细胞,腺泡内点灶状坏死增多,门管区轻-中度炎症;G3:腺泡3带广泛的气球样肝细胞,腺泡内点灶状坏死明显,门管区轻-中度炎症或门管区周围炎症。
1.5.4.3 ELISA法检测Visfatin蛋白表达 按照试剂盒操作说明进行,通过绘制标准曲线求出肝组织标本中Visfatin蛋白浓度。
1.6 统计学处理 使用SPSS 18.0软件进行统计分析,计量资料采用(±s)表示,比较采用t检验,计数资料采用单因素方差分析(one way ANOVA),以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
在实验期间,共有2只大鼠死亡,其中低剂量组1只,高剂量组1只。正常组大鼠精力旺盛,活泼好动,饮食正常,毛发有光泽,粪便成形,体重增加缓慢。模型组大鼠体重较正常组增长较快,毛发油腻,粪便松软粘臭,不成形,实验初期活动尚可,后期大鼠活动减少,形体肥胖,动作慵懒。脂易消高剂量组、中剂量组、低剂量组及易善复组大鼠体重增加缓慢,状态较模型组好,但不及正常组。
2.1 肝匀浆生化指标的测定 与正常组相比,脂易消各剂量组、易善复组、模型组大鼠肝组织TC含量显著增加,差异均有统计学意义(P<0.01);与模型组相比,脂易消各剂量组和易善复组TC水平均有显著降低,差异均有统计学意义(P<0.01);与易善复组相比,脂易消各剂量组肝组织TC水平差异均无统计学意义(P>0.05)。大鼠肝组织匀浆TG水平:与正常组相比,脂易消各剂量组、易善复组TG水平差异均无统计学意义(P>0.05),模型组大鼠肝组织TG含量显著升高,差异有统计学意义(P<0.01);与模型组相比,脂易消各剂量组和易善复组TG水平显著降低,差异均有统计学意义(P>0.05);与易善复组相比,脂易消各剂量组肝组织TG水平差异均无统计学意义(P>0.05),见表 1。
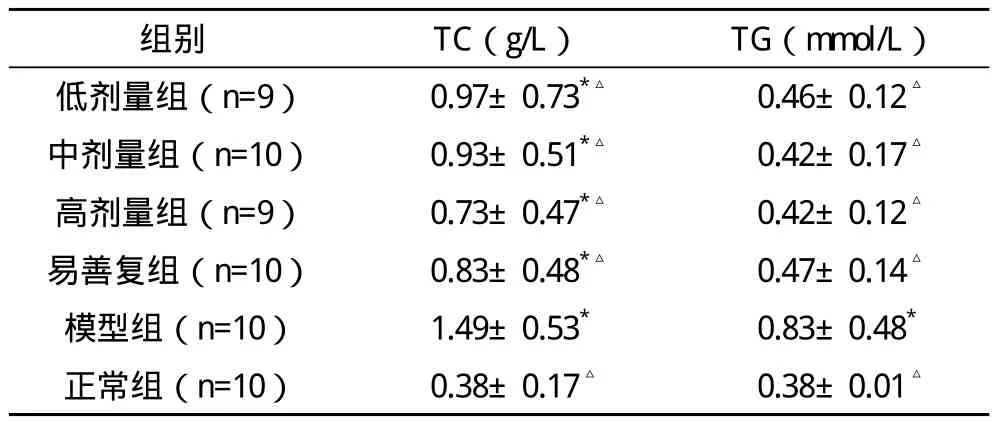
表1 各组大鼠肝匀浆TC、TG变化(x-±s)
2.2 常规HE染色光镜下观察
2.2.1 正常组 HE染色显示,大鼠肝小叶结构清晰,肝细胞多为单核,肝板呈条索状,围绕中央静脉呈放射状排列,无脂肪变性及炎症细胞浸润,见图1。
2.2.2 模型组 HE染色显示,大鼠肝组织可见弥漫性肝细胞脂肪变,细胞肿胀,胞浆疏松,存在大量脂肪空泡。汇管区和小叶间有炎症细胞浸润,正常的肝小叶结构被破坏,部分大鼠小叶内坏死灶融合成片,但未见肝纤维化形成,其肝组织脂肪变性程度与正常组比较差异有统计学意义(P<0.01),见图 2、表 2。
2.2.3 脂易消各剂量组 HE染色显示,大鼠肝组织呈弥漫性肝细胞脂肪变,可见小泡性、大泡性及气球样混合的脂肪变性,程度较模型组略轻,但差异无统计学意义(P>0.05)。汇管区和小叶间有少量炎症细胞浸润,其炎症积分明显低于模型组,两组比较差异有统计学意义(P<0.01),见图3~5、表2~3。
2.2.4 易善复组 基本与脂易消各剂量治疗组相近,大鼠肝组织可见弥漫性、混合性肝细胞脂肪变,汇管区有炎症细胞浸润,有少量点灶状坏死。其炎症积分与脂易消各剂量组比较差异无统计学意义(P>0.05),见图6、表2~3。

图1 正常大鼠(HE染色×280)
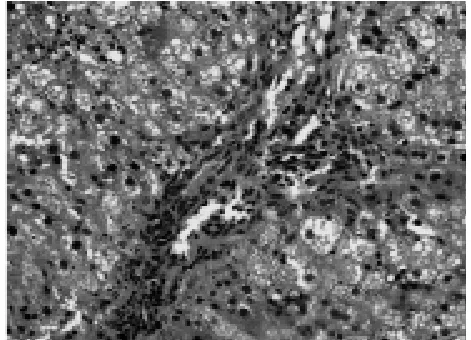
图2 模型组大鼠 (HE染色×100)

图3 脂易消低剂量组大鼠(HE染色×100)

图4 脂易消中剂量组大鼠 (HE染色×100)
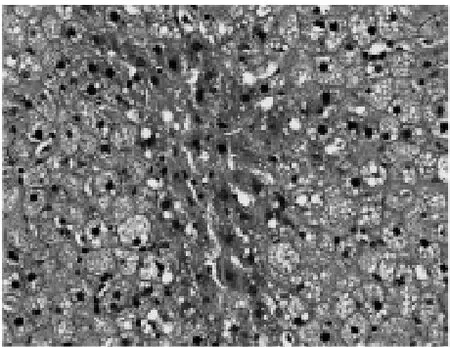
图5 脂易消高剂量组大鼠(HE染色×100)
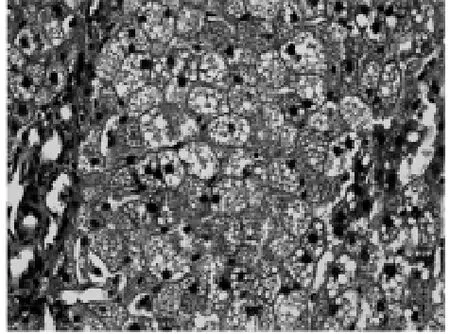
图6 易善复组大鼠 (HE染色×100)
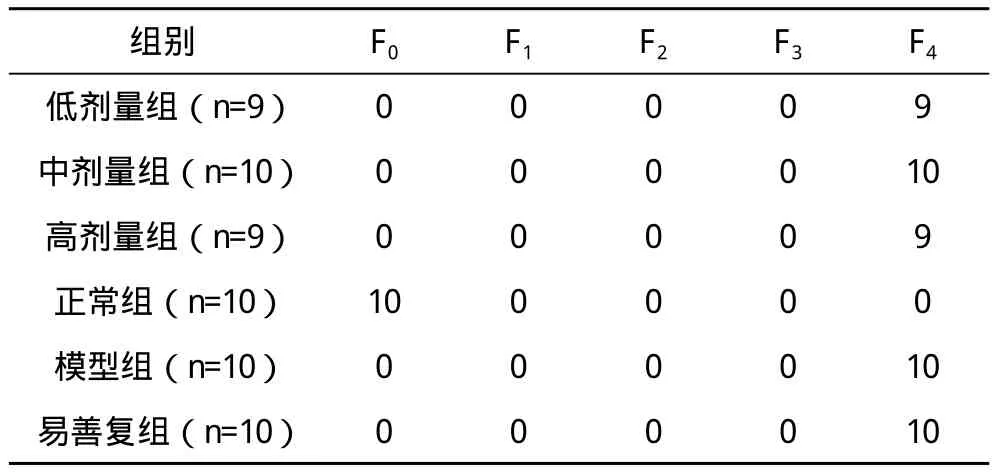
表2 各组大鼠肝脂肪变性程度 只
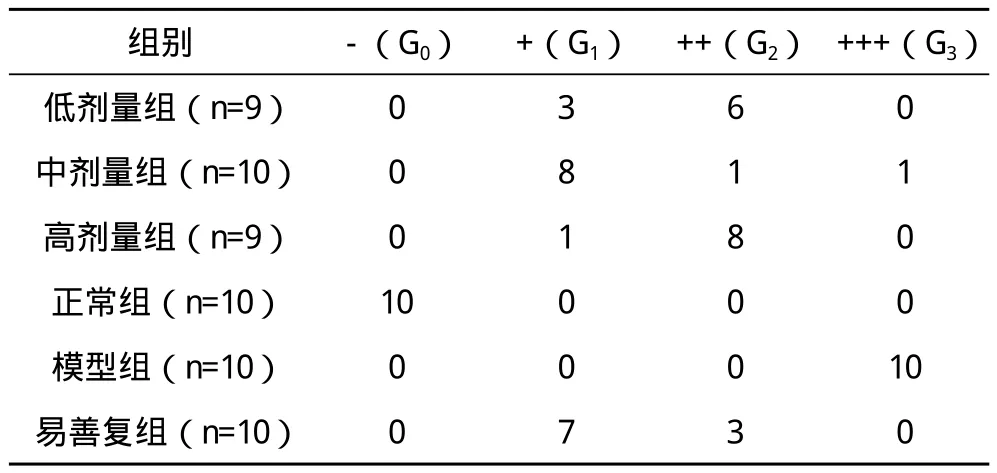
表3 各组大鼠肝组织炎症活动度 只
2.3 肝组织Visfatin蛋白表达水平检测 大鼠肝组织Visfatin蛋白表达情况:低剂量组为(17.31±0.27)ng/L,中 剂 量 组 为(16.85±0.44)ng/L, 高 剂 量 组 为(16.97±0.58)ng/L,易善复组为(17.19±0.38)ng/L、模型组为(18.52±1.38)ng/L,正常组为(16.02±15)ng/L。与正常组相比,模型组、脂易消低剂量组大鼠肝组织Visfatin蛋白表达明显升高,差异均有统计学意义(P<0.05);与模型组相比,脂易消各剂量组及易善复组大鼠肝组织Visfatin蛋白表达均明显降低,差异均有统计学意义(P<0.05);与易善复组相比,脂易消各组大鼠肝组织Visfatin蛋白表达差异均无统计学意义(P>0.05)。大鼠内脂素浓度测定标准曲线见图7。

图7 大鼠内脂素浓度测定标准曲线
3 讨论
本实验结果表明,模型组大鼠肝组织内TG、TC含量均显著上升,而脂易消各剂量组大鼠肝组织TC、TG含量均较之降低,表明脂易消能抑制肝脏细胞内TC、TG合成,从而改善NAFLD的进展。
脂易消能抑制肝脏细胞内TC、TG合成,改善NAFLD的发病进展,能改善肝细胞炎症活动度,减轻肝组织损伤,显著降低NAFLD大鼠肝组织Visfatin蛋白表达水平,本实验提示脂易消治疗NAFLD疗效确切,其作用机理可能与Visfatin参与了NAFLD的发生、发展有关。脂易消可能通过影响Visfatin的合成和分泌从而改善了NAFLD的生化指标。已有实验证明Visfatin具有类胰岛素作用并可以降低血糖、参与脂质代谢及炎症反应,因此进一步深入研究Visfatin是通过胰岛素信号通路还是其他信号通路参与了NAFLD的发生和发展具有积极的意义[14-15]。
[1]中国中西医结合学会消化系统疾病专业委员会.非酒精性脂肪性肝病的中西医结合诊疗共识意见[J].中国中西医结合杂志,2011,31(2):155-158.
[2]梁冰,陈曦,刘双燕,等.非酒精性脂肪肝与胰岛素抵抗的关系[J].临床肝胆病杂志,2006,22(3):213-214.
[3]高鑫.非酒精性脂肪性肝病与代谢综合征[J].中国实用内科杂志,2011,31(9):664-667.
[4]李瑜元.非酒精性脂肪性肝病的研究进展[J].世界华人消化杂志,2013,21(2):109-115.
[5]中华医学会肝脏病学会分会脂肪肝和酒精性肝病学组.非酒精性脂肪肝病诊疗指南(2010年修订版)[J].胃肠病学和肝病学杂志,2010,19(6):483-487.
[6]范建高.中国非酒精性脂肪性肝病的流行病学[J].中国医师进修杂志,2010,33(1):4-6.
[7] Fukuhara A,Matsuda M,Nishizawa M ,et al.Visfatin: a protein secreted by visceral fat that mimics the effects of insulin[J].Science,2005,307(5708):426-430.
[8]罗欣.非酒精性脂肪肝病发病机理及诊治进展[J].现代临床医学,2013,39(5):323-325.
[9]南月敏,王蕾,李良霄,等.非酒精性脂肪肝动物模型研究进展[J].河北医科大学学报,2007,28(1):67-69.
[10]车念聪.非酒精性脂肪性肝病的中医证治研究[J].中西医结合肝病杂志,2008,18(5):257-259.
[11]谢晶日,齐妍.非酒精性脂肪肝病中医药研究进展[J].辽宁中医药大学学报,2010,12(3):5-7.
[12]程勤,陈来旺.高脂饲料诱发非酒精性脂肪肝实验研究[J].淮海医药,2014,32(6):521-523.
[13]章元沛.药理学实验[M].第2版.北京:人民卫生出版社,1996:239.
[14]邝卫红.肝胆疾病[M].北京:中国医药科技出版社,2013:200-260.
[15]田春风,赵旭红,梁建英,等.非酒精性脂肪性肝病研究进展[J].临床荟萃,2011,26(12):1088-1090.
