Glil 基因对人牙周膜干细胞增殖及成骨分化调控机制的研究
2015-04-10罗金英钟建鑫舒绍兵周继祥第三军医大学西南医院口腔科重庆00038重庆市南川区人民医院口腔科重庆085武警重庆总队机关门诊部口腔科重庆07重庆大学生物医学工程学院重庆000
罗金英,钟建鑫,舒绍兵,3,张 洁,朱 璨,张 倩,汤 玲,周继祥 (.第三军医大学西南医院口腔科,重庆00038;2.重庆市南川区人民医院口腔科,重庆085;3.武警重庆总队机关门诊部口腔科,重庆07;.重庆大学生物医学工程学院,重庆000)
人牙周膜干细胞(human periodontal ligament stem cells,PDLSCs)是一种间充质干细胞,具有高度增殖、自我更新、多向分化的潜能,是牙齿移动过程中的关键细胞,在矫治力作用下可分化为成骨细胞[1],是矫治性牙槽骨应力改建中成骨细胞的来源之一[2]。Hedgehog(Hh)信号通路对骨髓干细胞应力成骨的调控具有重要作用,多种因素可直接或间接通过调控Hh信号通路从而使间充质干细胞向成骨细胞分化[3]。本课题组前期证实了周期性张应力可促进PDLSCs 向成骨细胞分化,并通过体外细胞应力实验证实了Hh 信号通路对PDLSCs 应力成骨具有直接的调控作用[4-5]。Glil(Gliloma-associated oncogene homoglog)是Hh 信号通路中重要的转录因子,是该通路激活的最重要标志[6-7],其如何通过调控Hh 信号通路来影响PDLSCs 成骨的分子机制还少有研究。本实验拟构建过表达Glil 基因腺病毒载体,并转染PDLSCs 细胞,检测其成骨标志物的表达,探讨上调Glil 基因对PDLSCs 增殖及成骨分化的影响,为进一步研究Glil 基因在Hh 信号通路对人牙周膜干细胞应力成骨过程中的作用提供研究基础。
1 材料与方法
1.1 主要试剂
Ⅰ型胶原酶购于Sigma 公司,胎牛血清购于Gibco 公司,α-MEM培养基、胰蛋白酶均购于HyClone 公司。KOD-plus 高保真酶,限制性内切酶EcoRv、Xba Ⅰ、Pme Ⅰ、Pac Ⅰ、连接酶T4Lignase 均购自TOYOBO 公司。Marker-DL15000、pAdTrack 腺病毒载体、293T 细胞均购自invitrogen 公司。Glil、Runx2 和ALP抗体购于Santa Cruz 公司。质粒提取试剂盒、普通琼脂糖凝胶DNA 回收试剂盒购于北京天根生物公司,LipofectaminTM2000转染试剂盒购于Invitrogen 公司,CD146 单克隆抗体购于Biolegend 公司,成骨、成脂诱导液购于赛业生物技术有限公司。
1.2 人牙周膜干细胞分离、培养及鉴定
本实验使用的标本均来自于本科室12 ~24 岁因矫正需要拔除的健康牙。牙齿拔除前,行口腔洁治及常规消毒,用含1%青霉素-链霉素的PBS 冲洗3 ~5 遍,直到冲洗液不再浑浊。手术刀片轻轻单向刮取牙根中1/3 的牙周膜组织,眼科剪将组织块剪至1 mm2大小,加入Ⅰ型胶原酶消化45 min,将组织混悬液接种于6 孔板。37 ℃、5%CO2培养箱中培养。48 h 第1 次换液,待细胞密度达70% ~80%时传代,传至第3 代,通过流式分选技术获得牙周膜干细胞。取第4 代PDLSCs 用胰蛋白酶消化,重悬,加入10 μl PBS 制成悬液,加入EP 管中,EP 管中加入CD146 抗体,上流式细胞仪进行表型分析。将4 ~6 代细胞以5 ×104的密度接种于内置无菌玻片的24 孔板,制作细胞爬片,用免疫组化Envisionf 法对其波形蛋白及角蛋白进行检测。成骨诱导:取第4 ~6 代PDLSCs 以2.5 ×104的密度接种于24 孔板中,培养4 d 后换液,加入成骨诱导液,诱导7 d 后,茜素红染色,倒置显微镜下观察是否有矿化结节形成。成脂诱导:PDLSCs 在成脂诱导液下培养3 周,油红染色后,倒置显微镜下观察是否有脂滴的形成。
1.3 Glil 腺病毒载体的构建及转染牙周膜干细胞
1.3.1 重组质粒PTA2 /Glil 的构建 采用Gene Tool 软件设计克隆Glil 基因引物序列为:上游:5’-GAAGATCTCGACTACCGCATCATCACAGC-3’,下 游:5’-GCTCTAGAATAGGGTTTCCAATGCTTCACTG-3’,RT-PCR 法,以人牙周膜细胞提取RNA逆转录成cDNA 为模板,扩增Glil 基因的ORF 序列,克隆至载体PTA2,采用限制性内切酶(EcoRv、XbaⅠ)和菌落PCR 法对重组子进行初步鉴定,将阳性重组子的质粒行测序鉴定,测序正确者命名为PTA2/Glil。
1.3.2 pAdTrack-CMV-Glil 重组质粒构建与鉴定 以PTA2/Glil 为模板,引用T 载体酶切位点(EcoRv、Xba Ⅰ),双酶切PTA2/Glil、pAdTrack-CMV,胶回收Glil 目的基因及pAdTrack-CMV 线性化条带,纯化后连接,菌液PCR 和限制性内切酶对重组子行初步鉴定,可疑阳性重组子送予测序,测序正确者被命名为pAdTrack-CMV-Glil。
1.3.3 腺病毒同源重组穿梭质粒 用PmeⅠ线性化重组pAdTrack 穿梭质粒并转入BJ5183 感受态细菌,与腺病毒骨架质粒pAdEasy-1 同源重组,用卡那霉素筛选出单克隆。挑取单克隆菌落并抽提质粒,重组质粒用PacⅠ酶切鉴定。
1.3.4 腺病毒的包装和扩增 取含10%胎牛血清的DMEM高糖完全培养液培养293 T 细胞,将处于对数生长期的细胞用0.25%胰酶消化,计数后并将细胞以每孔1 ×105细胞接种至6孔板,待其达到60% ~70%融合度,使用脂质体转染方法将PacⅠ线性化的重组质粒转染293T 细胞,转染24 h 后便可观察到绿色荧光。当293 T 细胞出现明显的细胞病变和CPE,则收取细胞和上清,在-80 ℃至室温条件下反复冻融3 次,使细胞破裂后释放出腺病毒,经0.45 μm 过滤掉细胞碎片后得到第1代腺病毒。用第1 代腺病毒感染293T 细胞可得到第2 代腺病毒。重复5 次后可得到纯的重组腺病毒。
1.3.5 Glil 腺病毒载体转染牙周膜细胞 将4 ~6 代牙周膜细胞接种至6 孔板,待细胞长至70% ~80%时,更换无抗生素无血清培养基,加入15 μl 左右的病毒液,2 h 后培养基更换含10%FBS 的α-MEM 培养基中,转染后培养48 h 于倒置荧光显微镜下观察,带绿色荧光的细胞为阳性,观察荧光及细胞病变(CPE)以判断转染效率。
1.4 Glil 在感染病毒后的PDLSCs 中的表达
腺病毒转染PDLSCs 后24 h 和48 h,分别收集2 瓶密度为1 ×106的细胞,加入蛋白裂解液,电泳、转膜后,加入一抗过夜,孵二抗,Western blot 检测Glil 蛋白在PDLSCs 中的表达。
1.5 CCK-8 检测腺病毒转染后的PDLSCs 增殖能力
牙周膜干细胞以1 ×104的密度接种于96 孔板中,分别为Glil 基因腺病毒载体组、空载体组、对照组(未加病毒),每组5 个副孔,检测前加入含10 μl CCK-8 液的培养基共100 μl,37 ℃、5%CO2培养箱孵育2 h,测定450 nm 处光密度值D(450),连续检测6 d。
1.6 细胞分化能力检测
腺病毒转染PDLSCs 后,分别培养24 h、48 h 后提取蛋白,Western blot 检测其中Glil、ALP 以及Runx2 的表达。
1.7 统计学分析
2 结果
2.1 人牙周膜干细胞鉴定
流式细胞仪表型分析CD146 阳性率为94.8%。免疫组化染色角蛋白阴性,波形蛋白阳性(图1a、图1b),说明所得细胞为间充质来源。成骨诱导牙周膜干细胞培养3 周后,镜下观有散在的矿化结节,茜素红染色阳性(图1c)。成脂诱导实验:成脂诱导牙周膜干细胞3 周后,胞浆内可见脂滴出现,对其进行油红O 染色,可见细胞内有大小不一的红色脂滴(图1d)。
2.2 Glil 病毒载体的构建及鉴定
将目的基因Glil 亚克隆至pAdtrack-CMV 载体后,选用EcoRv+ XbaⅠ酶切鉴定,电泳显示约3 300 bp 的目的片段与约9 200 bp 的pAdtrack-CMV 骨架片段见图2,经测序证实,带有Glil 基因的pAdtrack-CMV-Glil 载体构建成功。利用脂质法包装pAdtrack-CMV-Glil 病毒载体,将其感染293T 细胞2 d 后,荧光显微镜下观察90%以上细胞有荧光,光镜下观察有空斑形成(图3)。
2.3 腺病毒转染PDLSCs 及过表达Glil
过表达Glil 腺病毒转染PDLSCs,培养48 h 后,显微镜下观察带绿色荧光细胞达90%以上。分别在腺病毒转染后的24 h、48 h 收集细胞进行Western blot 检测,发现转染24 h 后Glil 蛋白表达较对照组未增加[灰度值(0.041 ±0.024)和(0.036 ±0.017),P >0.05],差异无统计学意义;48 h 后Glil 蛋白表达较对照组增加[灰度值(0.041 ± 0.024)和(0.148 ± 0.017),P <0.05],差异有统计学意义,证明该时间点的PDLSCs 细胞成功过表达Glil 基因,见图4。
2.4 上调Glil 可使PDLSCs 的增殖能力减弱
腺病毒转染人牙周膜干细胞后,检测1 ~6 d 人牙周膜干细胞的增殖情况,6 d 后比较空载体组和过表达组的增殖情况,发现过表达组增殖速率明显减慢(P =0.003),具有统计学差异(图5),说明上调Glil 基因可使PDLSCs 增殖速率减慢。
2.5 上调Glil 基因增强PDLSCs 成骨分化能力
过表达Glil 的腺病毒转染PDLSCs 48 h 后,Western blot 检测成骨标志物ALP 表达显著升高。空白对照组与48 h 过表达组[(0.154 ±0.213)和(0.237 ±0.256),P <0.05]差异有统计学意义(图6)。Western blot 检测成骨标志物Runx2 表达也显著升高。空白对照组与48 h 过表达组[(0.167 ±0.008)和(0.223 ±0.090),P <0.05]差异有统计学意义(图6)。说明过表达Glil 基因可以促进PDLSCs 向成骨细胞转化。
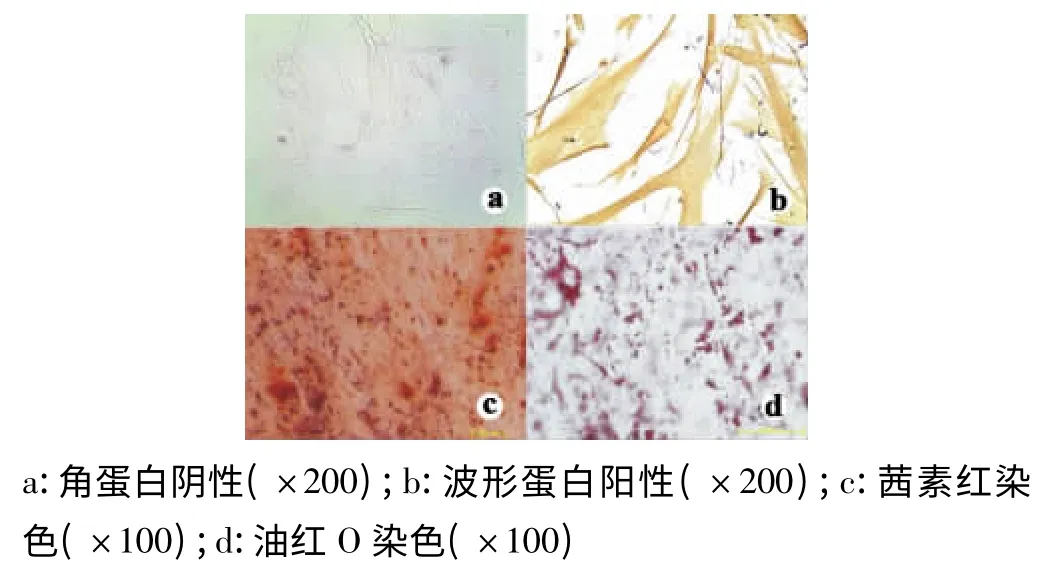
图1 人牙周膜干细胞鉴定(倒置显微镜)
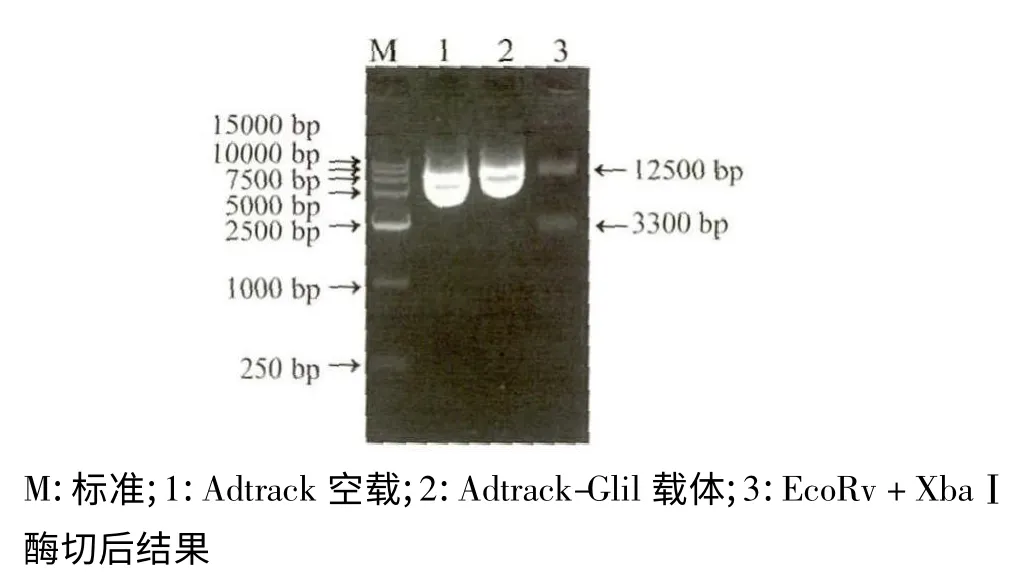
图2 腺病毒载体鉴定

图3 Glil 病毒载体的构建

图4 过表达Glil 腺病毒转染PDLSCs 后Glil 蛋白表达增加

图5 上调Glil 后PDLSCs 的增殖能力检测结果
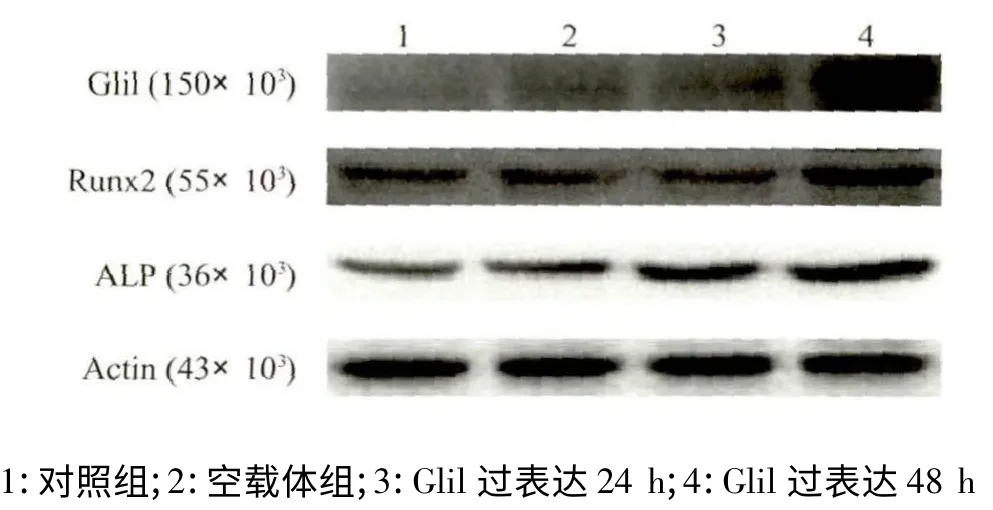
图6 上调Glil 基因PDLSCs 成骨分化能力检测结果
3 讨论
对于Hedgehog(Hh)信号通路的早期研究是其在哺乳动物胚胎发育阶段的作用和它的过度激活与众多肿瘤的发生有关,近年来,Hh 信号通路在骨的形成发育中的作用越来越受到学术界重视。激活的Hh 信号通路主要通过影响干细胞的增殖及分化而实现对成体组织功能稳定的调节[8]。若在胚胎发育过程中缺失Hh 基因,将会导致严重的骨骼发育畸形[9],Hh 蛋白可以通过促进间充质干细胞增殖分化或直接作用于成骨细胞而实现成骨细胞分化并参与骨形成[10-11]。ALP 作为成骨细胞分泌的一种糖蛋白,它可破坏钙通道抑制剂,从而启动钙化过程,是成骨分化的开始,是成骨细胞早期分化的重要酶[12-13]。Runx2 在骨形成过程及成骨细胞分化中起着控制作用,尤其是对间充质干细胞骨向分化的调节具有重要作用,是骨形成的关键基因,也是成骨细胞成熟的标志[14-15]。ALP、Runx2 是成骨过程中不同阶段的标志物,它们的表达水平反映了PDLSCs 向成骨细胞转化的过程。本研究发现,正常组、空载组细胞及含目的基因病毒感染的PDLSCs 24 h时均能表达ALP 及Runx2,但Glil 的表达没有明显差异,说明PDLSCs 本身具有向成骨细胞分化的能力。当Glil 目的基因病毒感染PDLSCs 48 h 后,Glil 的表达水平升高,ALP、Runx2 的表达也明显增加,这表明上调Glil 能促进PDLSCs 向成骨细胞的转化。
Hh 信号通路主要由Hh 配体、Smo(Smoothened)跨膜蛋白、Ptch(Patched)受体、Hip、核转录因子Glil 组成。在没有Hh 蛋白时,PTCH 与SMO 结合,抑制了SMO 的活性,当Hh 蛋白从分泌细胞分离并转运至效应细胞后,Hh 蛋白与效应细胞膜上的PTCH 受体结合,将SMO 释放,从而把Hh 信号传至效应细胞内,激活胞核内的转录因子Gli 蛋白,促使目标基因得以表达[16-17]。Glil 是一种锌指蛋白,在哺乳动物中有3 种Glil 基因,其中Glil 不仅与效应细胞的成骨作用相关,而且通过Hh 蛋白激活表达,对Hh 起正反馈调节作用。Glil 激活Hh 信号,进而激活Hh 信号通路,诱导一系列下游信号分子的释放,从而发挥其调控作用。由此可见Glil 是Hh 信号通路最重要的下游转录因子,也是Hh 信号通路的靶基因,是公认的Hh 信号通路被激活的重要标志物,在此通路中起着至关重要的承上启下的作用。
本实验构建了过表达Glil 目的基因的腺病毒载体并转染PDLSCs,转染效率较高,转染48 h 后,Western blot检测Glil 表达增加,说明成功上调了Glil 基因在PDLSCs中的表达。含目的基因的腺病毒感染PDLSCs 后,检测其增殖能力有所下降,其成骨相关指标ALP、Runx2 表达有所增加,说明PDLSCs 的成骨分化能力增强。
综上所述,本研究通过基因重组技术研究了Glil对牙周膜干细胞成骨分化的影响,进一步证实了Hh通路对牙周膜干细胞向成骨细胞转化的调控作用,为进一步研究Hh 信号通路对PDLSCs 应力成骨调控机制打下基础,也为临床矫治过程中牙的移动及牙周病治疗中骨的再生提供了一定的理论依据。
[1]Choi JK,Hwang HI,Jang YJ.The efficiency of the in vitro osteo/dentinogenic differentiation of human dental pulp cells,periodontal ligament cells and gingival fibroblasts[J].Int J Mol Med,2015,35(1):161-168.
[2]Zhang C,Li J,Zhang L,et al.Effects of mechanical vibration on proliferation and osteogenic differentiation of human periodontal ligament stem cells[J].Arch Oral Biol,2012,57(10):1395 -1407.
[3]Kim SY,Yoo JY,Ohe JY,et al.Differential expression of osteo-modulatory molecules in periodontal ligament stem cells in response to modified titanium surfaces[J].Biomed Res Int,2014,(2014):452175.doi:10.1155/2014/452175.
[4]常慧君,申 涛,董世武,等.purmorphamine 促进人牙周膜干细胞应力成骨[J].第三军医大学学报,2012,34(9):839 -842.
[5]张 洁,常慧君,李雨轩,等.Smoothened 慢病毒干扰载体的构建及其对人牙周膜干细胞的增殖与分化的影响[J].第三军医大学学报,2013,35(11):1133 -1136.
[6]Liu Y,Wang H,Cheng G,et al.Experssion analysis of Gli1 and Gli2 in different tissues and muscle-derived cells of Qinchuan cattle[J].Genet Mol Res,2014,13(4):8767 -8775.
[7]Kitaura Y,Hojo H,Komiyama Y,et al.Glil haploinsufficency leads to dereased bone mass with an uncoupling of bone metabolism in adult mice[J].PloS One,2014,9(10):e109597.
[8]Deng C,Yu Y.Roles of Hh signaling pathway on injury of bone with fluorosis[J].Zhonghua Bing Li Xue Za Zhi,2014,43(1):68 -70.
[9]Choudhry Z,Rikani AA,Choudhry AM,et al.Soinc Hh signaling pathway:a complex network[J].Ann Neurosci,2014,21(1):28 -31.
[10]Ohata Y,Ozono K.Bone and stem cells.The mechanism of osteogenic differentiation from mesenchymal stem cell[J].Clin Calcium,2014,24(4):501 -508.
[11]蔡加琴,邓 力.Hh 信号通路对MSCs 的调控[J].中国修复重建外科杂志,2010,24(8):993 -996.
[12]Yuan SH,Gao CB,Yin CU,et al.Recombinant adeno-associated virus BMP-4/7 fusion gene confers ossification activity in rabbit bone marrow stromal cells[J].Genet Mol Res,2012,11(3):3105 -3114.
[13] Sardiwal S,Gardham C,Coleman AE,et al.Bone-specific alkaline phosphatase concentrations are less variable than those of parathyroid hormone in stable hemodialysis patients[J].Kidney Int,2012,82(1):100 -105.
[14]Luca Dalle Carbonare L,Innamorati G,Valenti MT.Transcription factor Runx2 and its application to hone tissue engineering[J].Stem Cell Rev,2012,8(3):891 -897.
[15]Liu DD,Zhang JC,Zhang Q,et al.TGF-β/BMP signaling pathway is involved in cerium-Promoted osteogenec differentiation of mesenchymal stem cells[J].J Cell Biochem,2012,114(5):1105 -1114.
[16]Yao S,Lum L,Beachy P.The ihog cell-surface proteins bind Hedgehog and mediate pathway activation[J].Cell,2006,125(2):343 -357.
[17]Vered M,Peleg O,Taicher S,et al.The immunoprofile of odontogenic keratocyst (Keratocystic odontogenic tumor)that includes expression of PTCH,SMO,GLI-1and bcl-2 is seminal to ameloblastoma but different from odontogenic cysts[J].J Oral Pathol MED,2009,38(7):597 -604.
