MicroRNA-203 对人下咽癌细胞转移能力的影响及其机制研究
2015-04-10第四军医大学学员一旅陕西西安710038第四军医大学唐都医院耳鼻咽喉科陕西西安710038
高 丽,卞 卡 (1.第四军医大学学员一旅,陕西 西安710038;.第四军医大学唐都医院耳鼻咽喉科,陕西 西安710038)
下咽癌又称为喉咽癌,是原发于舌根、会厌、梨状窝、杓会厌皱襞、环状软骨后区、喉咽侧壁及后壁等区域的一种病因不明的恶性肿瘤。下咽癌发病率不高,占全身恶性肿瘤的0.5%,但5 年生存率仅有25% ~40%[1-2]。目前治疗方式以手术为主,辅以围手术期的放化疗等综合治疗。导致生存率不高的主要原因是下咽癌易出现转移,半数以上的患者早期即出现颈部淋巴结转移。因此弄清楚下咽癌转移的发生原理及影响转移的分子机制对于深入了解下咽癌,改善其治疗效果、提高患者生存率有非常重要的临床意义。MicroRNA 是一类由内源基因编码的长度为22 个核苷酸左右的非编码单链RNA 分子,它们在动植物中参与转录后基因表达调控。我们已经通过研究证明,MicroRNA-203 在一些肿瘤中可以发挥抑癌微小RNA 的作用[3],但其在下咽癌中的作用尤其是对下咽癌转移机制的影响尚不清楚。本实验研究了MicroRNA-203 通过调控靶基因MEKK1 在下咽癌的转移中起的作用,对于进一步阐明MicroRNA-203 对下咽癌的生物学活性的影响具有重要意义。
1 材料与方法
1.1 材料
人下咽癌细胞系Fadu 由美国Baylor 医学院Weiwen Long副教授馈赠。pcDNA3-MEKK1 质粒、由美国Baylor 医学院Weiwen Long 教授馈赠。相关试剂载体:MEKK1 兔源多克隆抗体(美国Enzo Life Sciences 公司),β-actin 鼠源单克隆抗体(美国Sigma 公司)。反转录试剂盒(美国Invitrogen 公司)。克隆质粒pMD-18T(日本Takara 公司);慢病毒系统pLenti-6.3(美国Invitrogen 公司)。荧光素酶实验报告基因质粒(美国Promega 公司)。主要仪器设备:Western blot 系统(美国Bio-Rad 公司),RT-PCR 检测仪(美国ABI 公司)。
1.2 方法
1.2.1 过表达MicroRNA-203 的慢病毒包装 构建含有目的基因pre-MicroRNA-203 的慢病毒载体,纯化提取质粒,将慢病毒载体与包装系统共转染病毒包装细胞293T,培养48 ~72 h后收集含有病毒的上清培养液得到慢病毒Lv-MicroRNA-203与Lv-luc,将病毒纯化和浓缩后得到的病毒上清检测滴度,-80 ℃保存备用。
1.2.2 qRT-PCR 检测慢病毒Lv-Luc 及Lv-MicroRNA-203 转染Fadu 细胞后MicroRNA-203 的表达 用慢病毒Lv-luc 与Lv-MicroRNA-203 分别转染下咽癌细胞Fadu,用Trizol 法分别提取Fadu-Lv-Luc 和Fadu-Lv-MicroRNA-203 两种细胞的RNA,利用Reverse Transcription Kit(Invitrogen 公司)进行MicroRNA-203 的逆转录,得到的产物进行实时定量PCR 反应。
1.2.3 细胞迁移能力检测实验 饥饿细胞12 ~24 h 后制备细胞悬液,调整细胞密度至5 ×105/mL。取细胞悬液100 μl 加入Transwell 小室,24 孔板下室加入600 μl 含血清的培养基。注意下层培养基和小室间不要产生气泡。常规培养细胞18 h,取出Transwell 小室,弃去孔中培养液,PBS 洗2 遍,甲醇固定30 min,将小室适当风干。0.1%结晶紫染色15 min,用棉签轻轻擦掉上层未迁移细胞,用PBS 洗3 遍。显微镜下随机5 个视野观察细胞,记数。
1.2.4 利用生物信息学方法预测MicroRNA-203 下游调控靶分子 在喉癌细胞中利用生物信息学分析软件TargetScan、MiRanda 和PicTar 分析MicroRNA-203 可能的下游靶基因,预测miRNA 种子区的结合;根据得出的分值高低,预测出相关下游靶基因,将靶基因的3’UTR 与MicroRNA-203 种子区序列进行比对。
1.2.5 荧光素酶报告基因法验证MicroRNA-203 的靶基因构建双荧光素酶表达载体,将希望鉴定的MicroRNA-203 靶基因的MEKK1 的3’UTR 插入荧光素酶基因的3’UTR 中,得到pGL3-WT-MEKK1-UTR/pGL3-mut-MEKK1-UTR 及对照载体pRL-TK。将构建好的重组载体转染Fadu-Lv-MicroRNA-203 细胞与阴性对照Fadu-Lv-Luc 细胞,培养48 h 后检测细胞荧光素酶的表达情况。检测方法参照Dual-Glo Luciferase Assay System说明书。计算分析数据。
1.3 统计学分析
使用SPSS 17.0 统计软件,采用独立样本t 检验进行分析,结果以P <0.05 认为有统计学意义。
2 结果
2.1 qRT-PCR 检测稳定感染Lv-Luc 及Lv-MicroRNA-的Fadu 细胞中MicroRNA-203 的表达
用慢病毒Lv-luc 与Lv-MicroRNA-203 分别转染下咽癌细胞Fadu,得到Fadu-Lv-Luc 与Fadu-Lv-MicroRNA-203。qRT-PCR结果显示与阴性对照Fadu-Lv-Luc 细胞相比,Fadu-Lv-MicroRNA-203 细胞的MicroRNA-203 的表达量提高了约390 倍(P <0.01)。说明利用慢病毒Lv-MicroRNA-203 感染Fadu 细胞得到了稳定高表达MicroRNA-203 的下咽癌细胞株(图1)。
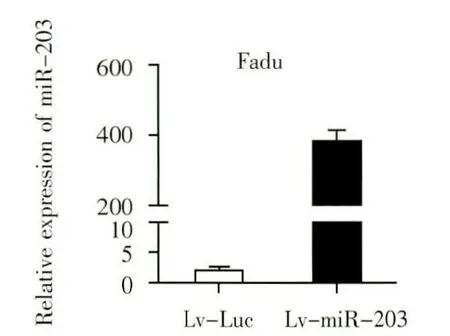
图1 qRT-PCR 检测慢病毒感染的Fadu 细胞MicroRNA-203表达量
2.2 MicroRNA-203 对下咽癌细胞迁移能力的调控
Transwell 实验显示,在过表达MicroRNA-203 的下咽癌细胞Fadu-Lv-MicroRNA-203 中,穿过Transwell 膜的细胞数远远多于对照Fadu-Lv-Luc(P <0.05),说明在下咽癌细胞中高表达MicroRNA-203 可以显著降低肿瘤细胞的迁移能力(图2)。
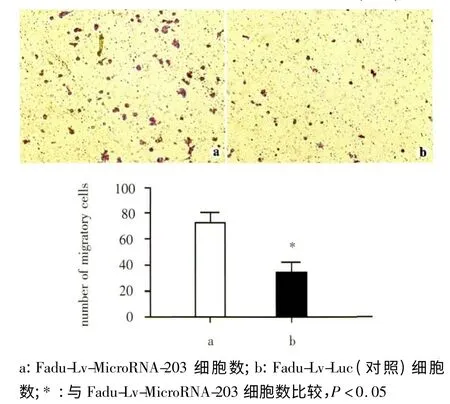
图2 transwell 实验检测下咽癌细胞的迁移
2.3 MEKK1 是MicroRNA-203 的下游负向调控分子
使用miRanda、TargetScan、PicTar 3 种微小RNA 靶基因预测软件,通过分析得出MicroRNA-203 的潜在可能靶基因MEKK1。结合KEGG 数据库,将MicroRNA-203 与MEKK1 的3’UTR 区进行同源互补分析,图3 所示两者有明显的种子区互补的假想位点,说明MEKK1 有可能是MicroRNA-203 的下游靶基因之一,同时在报告基因中对MEKK1 成功进行了单点突变的载体构建。
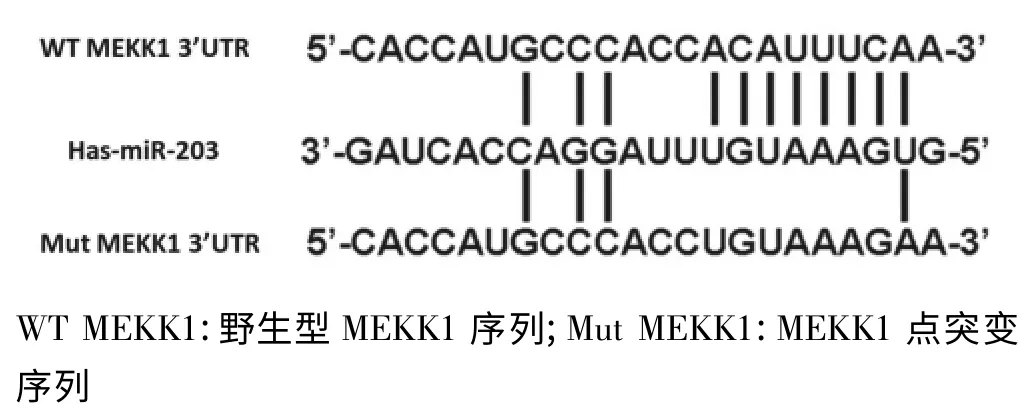
图3 MicroRNA-203 序列与MEKK1 3’UTR 序列相关性分析
2.4 下咽癌细胞高表达MicroRNA-203 后MEKK1 蛋白表达的变化
Western blot 与qRT-PCR 结果显示,在下咽癌细胞中高表达MicroRNA-203 后MEKK1 的蛋白表达水平(图4)及mRNA表达水平(图5)均有显著下降(P <0.05),提示MicroRNA-203可通过结合MEKK1 3’UTR 发挥转录后基因沉默作用,通过加速降解MEKK1 mRNA 来降低MEKK1 蛋白的表达。
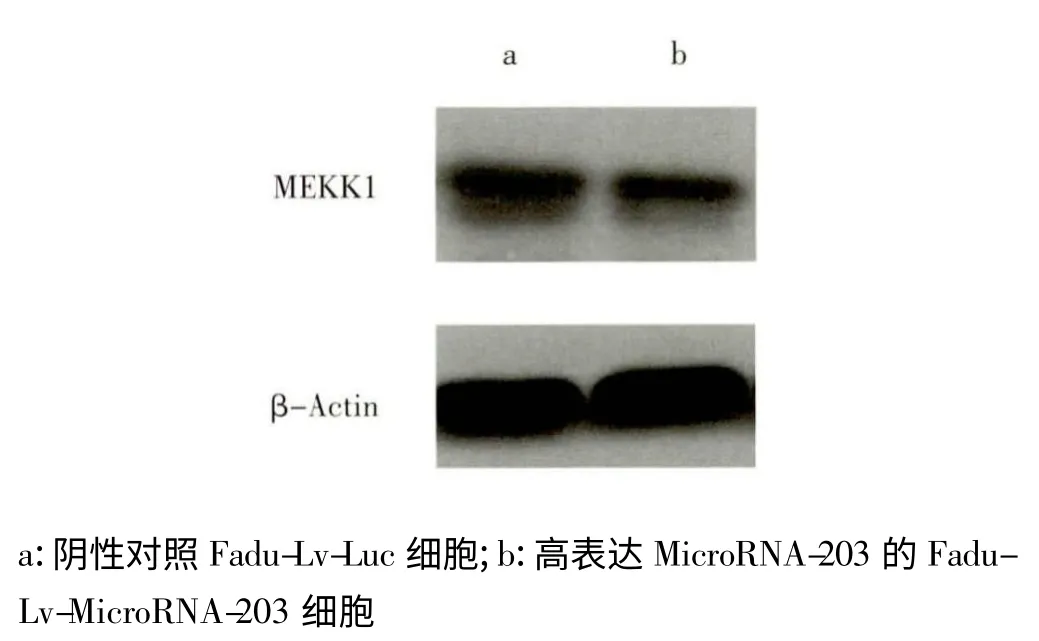
图4 Western blot 检测过表达MicroRNA-203 的下咽癌细胞中MEKK1 的蛋白表达
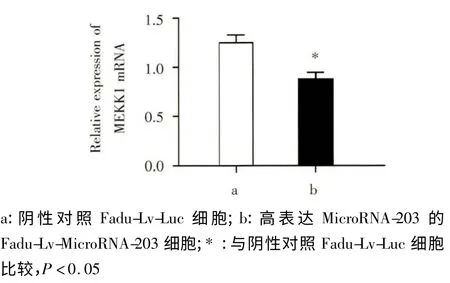
图5 qRT-PCR 检测过表达MicroRNA-203 的下咽癌细胞中MEKK1 的mRNA 表达量
2.5 双荧光素酶检测MicroRNA-203 对MEKK1 有抑制作用
本实验结果显示,在下咽癌细胞Fadu 中转染MEKK1 萤光素酶表达载体后,在高表达MicroRNA-203 的Fadu 细胞中,MEKK1 的荧光素酶活性大大降低,是正常下咽癌细胞的65%(图6)。但我们将MEKK1 进行突变后,MicroRNA-203 的表达对MEKK1 的荧光素酶活性则无影响。提示MEKK1 可能是MicroRNA-203 的一个下游调控靶分子,MicroRNA-203 与MEKK1 的3’UTR 结合后对它进行负性调控。
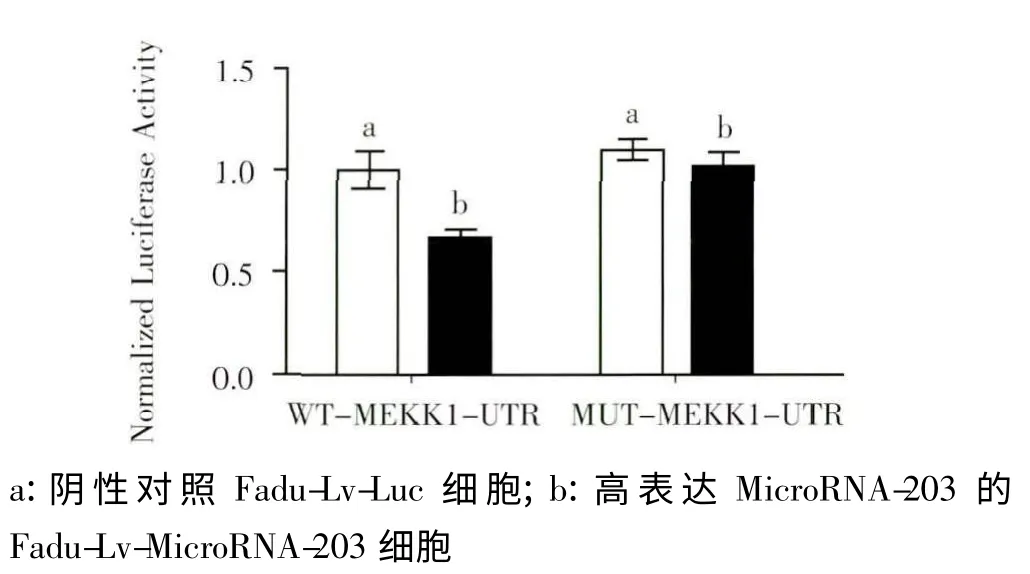
图6 双荧光素酶报告基因实验检测MicroRNA-203 对MEKK1 的作用
3 讨论
近年来,伴随对人类基因组结构与功能的进一步深入探析,科学家们发现在基因组的转录产物中存在一类长度约为19 ~25 nt 的小核酸类物质微小RNA(microRNA,miRNA),它可以通过结合与自身序列部分碱基互补匹配的mRNA 分子,通过抑制其翻译或降解mRNA 自身达到转录后基因沉默的调节功能,已知的MicroRNA 已经超过千种[4]。众多研究[5-14]表明MicroRNA 与肿瘤发生发展密切相关。以MicroRNA-203 为例,研究发现MicroRNA-203 在宫颈癌等许多恶性肿瘤中高表达,表现出癌基因的作用[5-6],然而在肝癌等另一部分肿瘤中,MicroRNA-203 又被发现起到抑癌基因的作用[7-14]。因此,MicroRNA-203 在不同类型的肿瘤中起到怎样的作用,需要更加深入地研究。我们的前期实验结果显示,慢病毒介导过表达MicroRNA-203 明显抑制了头颈肿瘤细胞的增殖能力及细胞周期进展速率[3],其通过结合survivin 3’UTR 发挥转录后基因沉默的作用,抑制survivin 在头颈肿瘤细胞中的表达,进而影响对细胞存活及增殖的生物学效应。由此我们相信,MicroRNA-203 在头颈肿瘤的发生发展及转归中很可能是一个重要的功能分子和预后评价指标。本实验进一步研究了MicroRNA-203 对下咽癌细胞转移能力的影响,证明MEKK1 为MicroRNA-203 的有效下游靶基因,有可能通过MicroRNA-203 对其的抑制发挥着调控下咽癌转移能力的作用。MEKK1 是MAPK 信号转导通路中的结点位置,其生物学作用与肿瘤的增殖、迁移、运动、侵袭等密切相关[15]。虽然MEKK1 在肿瘤的生物学活动中起到十分重要的作用,但目前还没有有效的MEKK1 抑制剂上市,因此深入研究MEKK1 在信号转导通路中的的作用机制,寻找MicroRNA-203 等直接作用于MEKK1 的可靠抑制剂,对于肿瘤的特异性治疗具有重要意义。
[1]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277 -300.
[2]Leemans CR,Braakhuis BJ,Brakenhoff RH.The molecular biology of head and neck cancer[J].Nat Rev Cancer,2011,11(1):9 -22.
[3]Bian K,Fan J,Zhang X,et al.MicroRNA-203 leads to G1 phase cell cycle arrest in laryngeal carcinoma cells by directly targeting survi vin[J].FEBS Lett,2012,586(6):804 -809.
[4]Wery M,Kwapisz M,Morillon A.MicroRNA-203 leads to G1 phase cell cycle arrest in laryngeal carcinoma cells by directly targeting surv ivin[J].Wiley Interdiscip Rev Syst Biol Med,2011,3(6):728 -738.
[5]Iorio MV,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67(18):8699 -8707.
[6]Ikenaga N,Ohuchida K,Mizumoto K,et al.MicroRNA-203 expression as a new prognostic marker of pancreatic adenocarcinoma[J].Ann Surg Oncol,2010,17(12):3120 -3128.
[7]Furuta M,Kozaki KI,Tanaka S,et al.miR-124 and miR-203 are epigenetically silenced tumor-suppressive microRNAs in hepatocellular carcinoma[J].Carcinogenesis,2010,31(5):766 -776.
[8]Yuan Y,Zeng ZY,Liu XH,et al.MicroRNA-203 inhibits cell proliferation by repressing ΔNp63 expression in human esophageal squamous cell carcinoma[J].BMC Cancer,2011,11:57.doi:10.1186/1471 -2407 -11 -57.
[9]Bueno MJ,Pérez de Castro I,Gómez de Cedrón M,et al.Genetic and epigenetic silencing of microRNA-203 enhances ABL1 and BCR-ABL1 oncogene expression[J].Cancer Cell,2008,13(6):496 -506.
[10]Li J,Chen Y,Zhao J,et al.miR-203 reverses chemoresistance in p53-mutated colon cancer cells through downregulation of Akt2 express ion[J].Cancer Lett,2011,304(1):52 -59.
[11]Bo J,Yang G,Huo K,et al.microRNA-203 suppresses bladder cancer development by repressing bcl-w expression[J].FEBS J,2011,278(5):786 -792.
[12]Chiang Y,Song Y,Wang Z,et al.Aberrant expression of miR-203 and its clinical significance in gastric and colorectal cancers[J].J Gastrointest Surg,2011,15(1):63 -70.
[13]Saini S,Arora S,Majid S,et al.Curcumin modulates microRNA-203-mediated regulation of the Src-Akt axis in bladder cancer[J].Cancer Prev Res (Phila),2011,4(10):1698 -1709.
[14]Saini S,Majid S,Yamamura S,et al.Regulatory role of miR-203 in prostate cancer progression and metastasis[J].Clin Cancer Res,2011,17(16):5287 -5298.
[15]吴刘成,邵义祥.Map3k1 调控小鼠眼睑闭合的研究进展[J].动物学杂志,2011,46(3):144 -151.
