甘露糖结合凝集素对肠上皮细胞凋亡的调控作用及机制研究
2015-04-10王文生孙力华第三军医大学新桥医院普通外科重庆400037
许 超,彭 科,王文生,于 敏,孙力华,杨 桦 (第三军医大学新桥医院普通外科,重庆400037)
甘露糖结合凝集素(mannose-binding lectin,MBL)属于凝集素家族的成员,是一种钙离子依赖性凝集素,其通过糖基识别区(CRD)选择性识别病毒、真菌等,促进免疫细胞吞噬并且活化补体通路起到免疫防御作用[1-3]。有研究[4]显示MBL 可以直接与细胞表面的MBL 受体结合,发挥调控炎症、促凋亡和调理素等生物学功能。近来有研究显示高浓度的MBL 与细胞凋亡相关,如Wang 等[5-6]的研究显示MBL 与U937 细胞、单核细胞结合,可促进其凋亡;Schlagwein 等[7]的研究表明在肾移植中MBL 分泌增多直接促进肾小管上皮细胞凋亡。近来发现MBL 表达在肠道上皮细胞[8],但肠道表达MBL 的具体作用及机制目前研究并不清楚。我们发现在脂多糖(lipopolysaccharide,LPS)刺激后的肠上皮细胞MBL 表达升高,同时,肠上皮细胞凋亡增加。但是二者之间是否相关,肠道表达MBL是否参与了上皮细胞增殖凋亡调控过程,目前研究尚未见相关报道。因此我们用重组甘露糖结合凝集素(recombinant human Mannose-binding lectin,rhMBL)处理肠上皮细胞,探讨MBL 对肠上皮细胞凋亡的影响,并初步探讨其分子机制。
1 材料与方法
1.1 材料与仪器
人结肠癌上皮Caco-2 细胞株购自中国科学院细胞库;细胞培养箱购自日本Sanyo 公司;胎牛血清MEM 培养基购自美国HyClone 公司;胰蛋白酶购自美国BBI 公司;Bax、Bcl-2 抗体购自Millipore 公司;聚偏二氟乙烯(PDVF)膜购自美国Millipore公司;WB 垂直电泳仪和半干电转仪购自美国Bio-Rad 公司;RIPA 裂解液、蛋白测定试剂盒和SDS-PAGE 凝胶配置试剂盒均购自武汉博士德生物工程公司;凝胶成像分析系统购自美国KODAK 公司;rhMBL 购自北京义翘神州生物公司;Annexin-VFITC/PI 试剂盒购自南京凯基生物公司;MoFlow 流式细胞仪购自美国Beckman Coulter 公司。
1.2 动物模型的制备
14 只6 ~8 周龄雄性C57 小鼠,体质量(21 ±2)g。随机分为2 组(n=7):假手术组(Sham 组)、LPS 组。处理前12 h 禁食,自由饮水。LPS 组经腹腔注射LPS 溶液10 mg/kg[9];Sham组给予同等体积的0.9%氯化钠注射液。观察5 h 后腹腔注射0.1%的戊巴比妥钠0.15 mL 麻醉后,腹正中线切开,暴露肠段并取其小肠组织。
1.3 实验方法
1.3.1 细胞培养 Caco-2 细胞用含10%胎牛血清、1%双抗、1%非必需氨基酸的MEM 培养基中置于37 ℃、5%CO2饱和湿度的条件下培养,直至细胞融合80%,用0.2%含EDTA 胰酶消化,按1∶3 传代培养。
1.3.2 流式细胞术检测细胞凋亡 取不同浓度的rhMBL 处理Caco-2 细胞后,按Annexin-V-FITC、PI 双标记染色试剂盒说明书操作后用流式细胞仪检测rhMBL 对Caco-2 细胞凋亡效应,计算细胞凋亡率,实验重复3 次。
1.3.3 WB 法检测Bax、Bcl-2、P38 蛋白表达水平 将Caco-2接种于六孔板,不同浓度处理后,用PBS 洗3 次,每孔加入RIPA裂解液(200 μl 含预冷的PMSF 2 μl),冰浴20 min,12 000 ×g 4 ℃离心15 min,吸取上清,用蛋白测定试剂盒测定上清液蛋白水平。蛋白上样后恒压电泳,200 mA 恒流湿转至PVDF 膜(用甲醇浸泡),转膜后,用5%TBST 脱脂奶粉室温封闭2 h,加入一抗4 ℃冰箱过夜。TBST 洗膜3 次,每次10 min,然后加入对应二抗后,37 ℃温箱孵育1 h,TBST 洗膜4 次,每次10 min。加入ECL 发光试剂显影,采集发光信号,经Kodak Molecular Imaging软件行密度分析,实验重复3 次。
1.3.4 免疫组化染色 石蜡切片脱蜡,二甲苯、乙醇各浸泡10 min,PBS 冲洗3 次,阻断内源性过氧化物酶的活性,枸盐酸缓冲液,一抗室温下孵育2 h。DAB 液显色,苏木素复染,自来水冲洗、蓝化,中性树胶封固,晾干后观察,实验重复3 次以上。
1.3.5 分析Bax、Bcl-2 mRNA 水平变化 不同浓度rhMBL处理后48 h,用Trizol(Invitrogen)按试剂盒说明提取细胞总RNA,用逆转录试剂盒将RNA 逆转录为cDNA。以合成的cDNA第1 链为模板进行扩增(按SYBR Green 试剂盒说明进行)。△Ct=Ct 目的基因-Ctβ-Actin,△△Ct =△Ct 处理组-△Ct 对照组。不同样本的目的基因表达的相对差异量=2 -△△Ct,引物序列见表1,实验重复3 次以上。

表1 Real-Time PCR 的引物核酸序列
1.4 统计学方法
采用SPSS 13.0 统计软件进行数据分析,数据以均数±标准差表示。采用单因素方差分析进行组间比较,检验水准α=0.05。
2 结果
2.1 小肠上MBL 表达情况
构建LPS 刺激模型,发现Sham 组MBL 表达在肠上皮细胞处,同时存在隐窝上皮细胞中。LPS 组可见MBL 在肠上皮和隐窝上皮表达明显增高。Real-Time PCR 结果显示LPS 处理组相对表达量为(12.665 ±4.85),比Sham 组明显升高(P <0.05),见图1、图2。
2.2 LPS 刺激肠上皮细胞凋亡情况
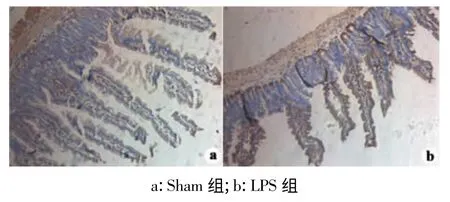
图1 MBL 免疫组化染色(×100)
Tunel 染色后在800 倍镜下观察阳性细胞数在细胞总数中的比值,计算凋亡率。在LPS 刺激模型中,Tunnel 染色阳性的肠上皮细胞在小肠可见散在分布(图3),LPS 处理组阳性细胞比为(45.27 ±4.85)%,比Sham 组的(5.27 ±0.91)%明显增加,差异具有统计学意义(P <0.05)。
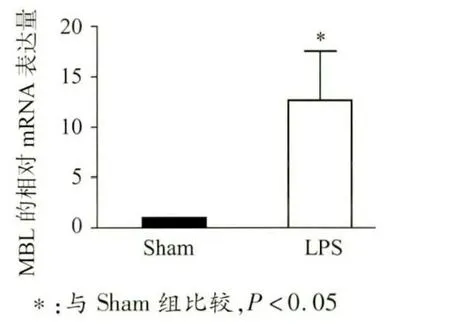
图2 MBL 的mRNA 表达情况
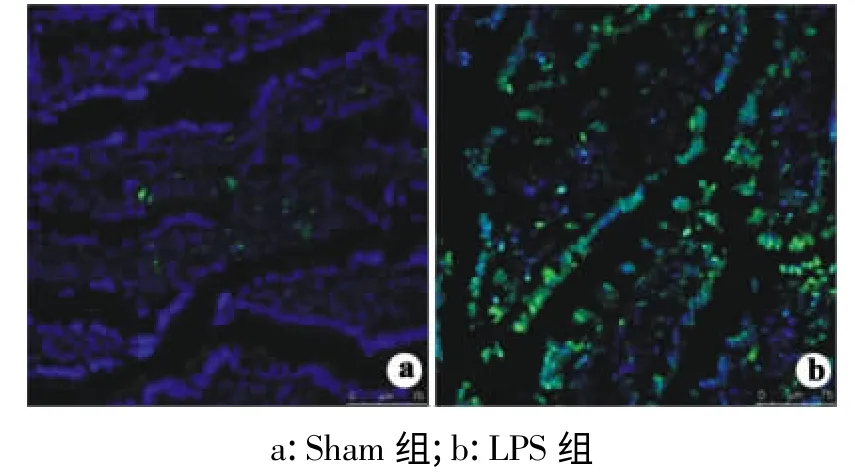
图3 TUNEL 染色(×800)
2.3 rhMBL 对Caco-2 细胞早期凋亡的影响
不同浓度rhMBL 作用于Caco-2 细胞48 h 后的细胞早期凋亡结果见图4。20 μg/mL 的rhMBL 组的细胞凋亡率为(9.22 ±1.16)%,与其余组的(4.08±0.28)%、(4.77±0.76)%、(4.87 ±0.35)%比较明显增加,差异有统计学意义(F=41.536,P <0.001)。取20 μg/mL 的rhMBL 作用于Caco-2 细胞0、12、24、48 h 后,细胞早期凋亡率分别为(4.01 ± 0.19)%、(4.76 ± 0.24)%、(6.90 ±0.36)%、(9.66 ±0.61)%,逐渐增加,并呈时间依赖性。rhMBL 作用细胞48 h 后细胞凋亡较明显,差异具有统计学意义(F=130.613,P <0.05),见图5。

图4 rhMBL 作用后Caco-2 后48 h 细胞早期凋亡率

图5 20 μg/mL rhMBL 作用后Caco-2 细胞早期凋亡率
2.4 Caco-2 细胞中Bax、Bcl-2 的蛋白和基因表达情况
Bax,Bcl-2 比值Bax/Bcl-2是反应细胞凋亡活性的关键指标之一。通过Western Blotting 检测凋亡相关分子Bax,Bcl-2 的表达,发现对照组、20 μg/mL rhMBL 组的Bax/Bcl-2 蛋白表达比值分别为(0.81 ±0.06)、(1.10 ±0.05),结果分析表明20 μg/mL组与对照组相比明显升高,差异有统计学意义(P <0.05)。Bax/Bcl-2 mRNA 表达的比值,对照组和20 μg/mL rhMBL 组分别是(0.60 ±0.08)、(1.45 ±0.15),两者比较差异具有统计学意义(P <0.01),见图6。
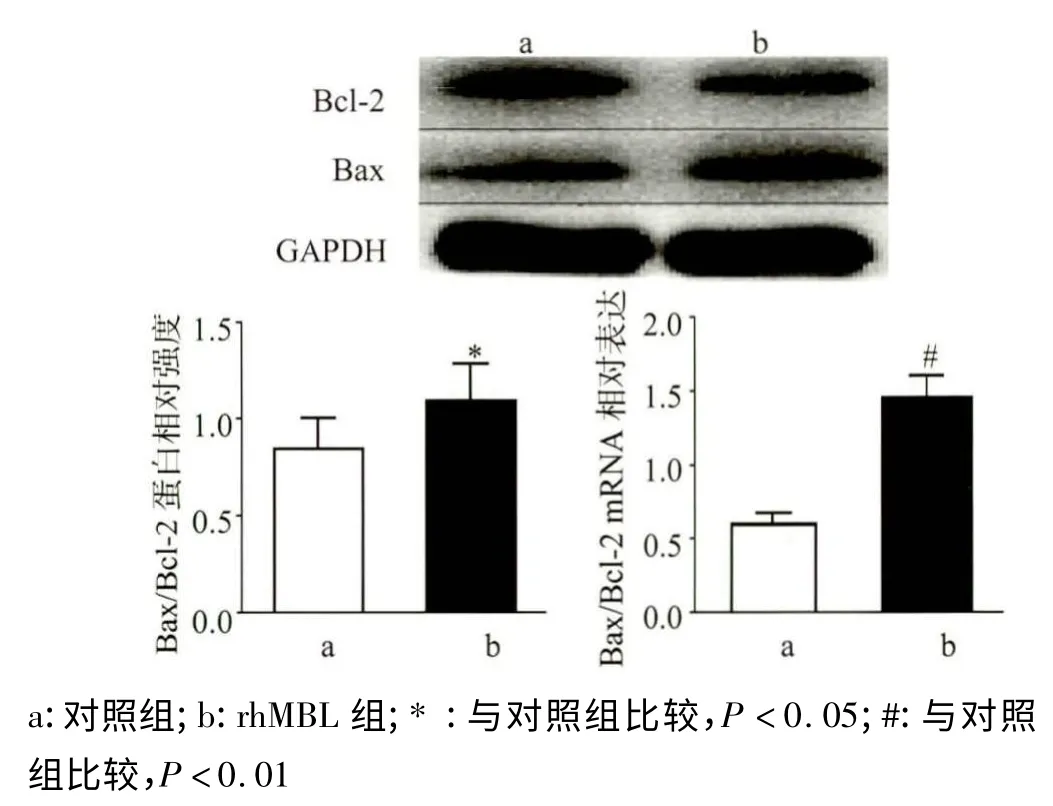
图6 各组Bax、Bcl-2 蛋白和mRNA 的表达
2.5 rhMBL 通过P38 途径调控细胞凋亡
为进一步探讨rhMBL 调控细胞凋亡的分子机制,利用Western Blotting 检测细胞中凋亡相关信号通路中P38、ERK、JNK 的变化,通过检测发现加入rhMBL 组其P-JNK 变化不明显,而磷酸化P38、ERK 相对表达明显高于对照组(P <0.05),细胞通过应用P38 抑制剂(SB203580)、ERK 抑制剂(U0126)后,发现加入P38 抑制剂组Bax/Bcl-2 降低明显(F =5.474,P <0.05),流式凋亡减弱(F=26.107,P <0.001),见图7 ~9。


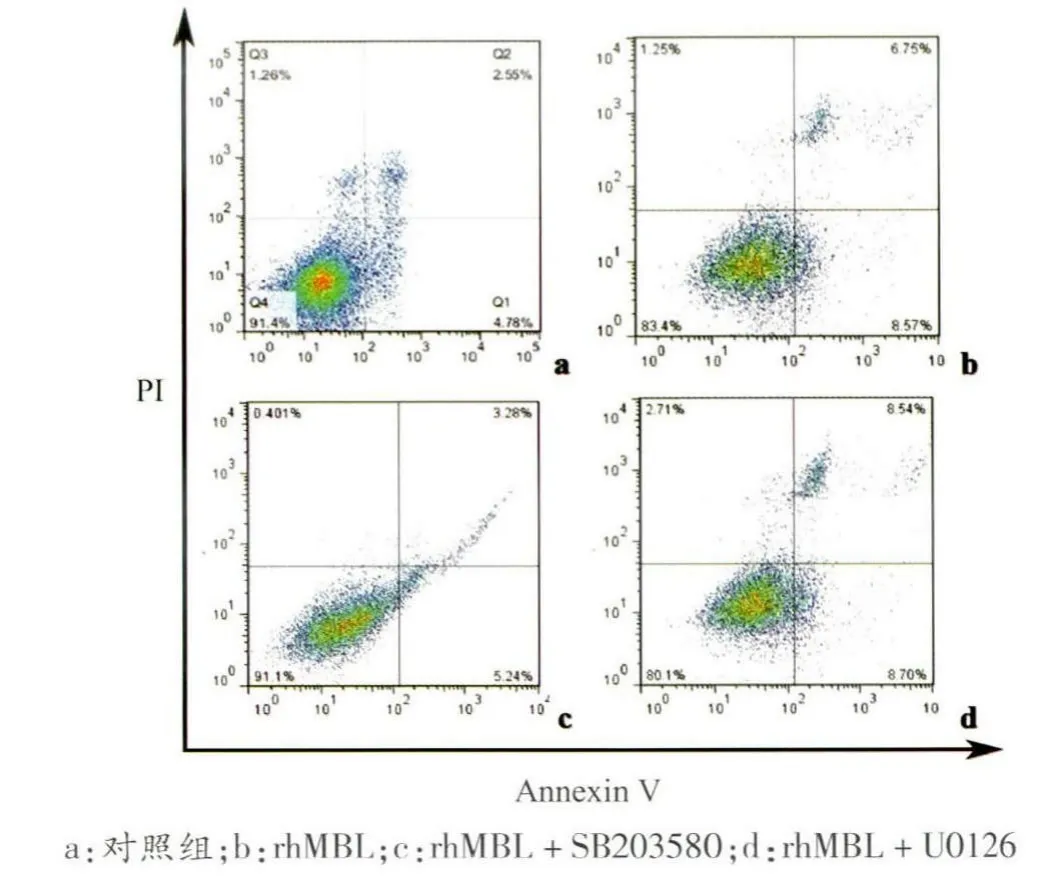
图9 各组流式细胞图
3 讨论
肠黏膜屏障由生物屏障、免疫屏障和机械屏障组成。其中机械屏障是重要屏障之一,是由单层肠上皮细胞通过紧密连接蛋白连接而成,可防止病原微生物、抗原和毒素入血。然而在许多病理情况下如严重感染、休克、急慢性炎症疾病等可造成肠上皮细胞凋亡脱落,导致屏障功能衰竭。肠道炎症损伤,诱导肠上皮细胞损伤及凋亡,加重屏障功能衰竭[9-10]。
甘露糖结合凝集素(MBL)是一种钙离子依赖性的C 型凝集素,由2 ~6 条多肽链组成,主要由肝细胞合成,并释放入血[1-2,4],维持机体固有免疫功能。在体内MBL 主要有4 种功能:初始补体活化的功能、不依赖补体的调理素作用、介导炎症反应和促进凋亡[3]。高浓度MBL 与细胞凋亡密切相关,Wang 等[5]认为MBL 在2 型糖尿病中表达升高,促进单核细胞凋亡,加重了病情。Schlagwein 等[7]研究发现肾移植前期,MBL 诱导肾小管上皮细胞凋亡,导致肾脏损伤,在后期主要为补体激活损伤。近年来发现MBL 表达在肠上皮细胞,是除肝以外表达最多的脏器。而且大量研究表明,在肠缺血再灌注模型中敲除MBL 后可减轻屏障功能损伤[11-12]。我们已经发现在LPS 刺激后模拟的肠屏障损伤中,肠上皮细胞表达的MBL 升高,同时肠上皮细胞凋亡增加。那么在病理刺激下,肠道高表达的MBL 与肠上皮细胞的凋亡之间是否会存在相关性,我们进行了相关研究。
本实验结果显示,腹腔注射LPS 后,肠道上皮细胞凋亡明显增加,同时观察到MBL 表达较对照组增多。为进一步明确MBL 表达升高与上皮细胞凋亡增加的关系,我们选用Caco-2 细胞,观察MBL 在体外对其凋亡的影响。首先用流式细胞技术检测Caco-2 细胞的早期凋亡情况,发现给予20 μg/mL 的rhMBL 组早期凋亡明显高于对照组。凋亡主要是受到促进凋亡和抑制凋亡相互作用的调控。Bcl-2 基因家族是凋亡调控基因之一,它能够通过多种途径来抑制细胞凋亡。Bax基因家族的功能与之相反,Bax 蛋白通过与Bcl-2 蛋白形成异源二聚体,抑制Bcl-2 基因的抗凋亡作用[13]。因此我们通过Western blotting 法从蛋白水平初步探讨细胞凋亡的相关机制,结果显示20 μg/mL rhMBL 处理组的Caco-2 细胞Bax/Bcl-2 比例增高,表明凋亡增加,这与流式细胞术检测结果一致。由此我们推测MBL可能与Bax、Bcl-2 调控Caco-2 细胞凋亡相关。但其具体机制尚未见报道。目前有研究[14-15]认为细胞凋亡多与JNK、ERK、P38 信号传导通路相关,其中P38 MAPK细胞凋亡中起到重要作用。Wang 等[5]报道,高浓度MBL 通过P38 MAPK 信号通路,促进单核细胞凋亡。因此我们筛查JNK、ERK、P38 通路的活化情况,发现阻断P38 途径,MBL 诱导Caco-2 细胞凋亡受到抑制。因此可以认为高浓度MBL促进Caco-2细胞凋亡的部分机制是通过激活P38 得以实现的。但有研究[7]认为MBL 可以内在化进入细胞后促进细胞凋亡,因此MBL如何调控细胞凋亡的具体机制还需要进一步探讨。
综上所述,本研究发现高浓度rhMBL 可促进Caco-2细胞凋亡,并且其可能是通过P38 途径参与Caco-2细胞凋亡的调控,提示MBL 在病理情况下升高,可能加重肠黏膜屏障损伤,为预防屏障损伤提供一个潜在的靶点。
[1]Ip WK,Takahashi K,Ezekowitz RA,et al.Mannose-binding lectin and innate immunity[J].Immunol Rev,2009,230(1):9 -21.
[2]Takahashi K.Mannose-binding lectin and the balance between immune protection and complication[J].Expert Rev Anti Infect Ther,2011,9(12):1179 -1190.
[3]Stuart LM,Takahashi K,Shi L,et al.Mannose-binding lectin-deficient mice display defective apoptotic cell clearance but no autoimmune phenotype[J].J Immunol,2005,174(6):3220 -3226.
[4]Turner MW.The role of mannose-binding lectin in health and disease[J].Mol Immunol,2003,40(7):423 -429.
[5]Wang Y,Chen AD,Lei YM,et al.Mannose-binding lectin inhibits monocyte proliferation through transforming growth factor-beta1 and p38 signaling pathways[J].PLoS One,2013,8(9):e72505.doi:10.1371/journal.pone.0072505
[6]雷艳梅,王 燕,张丽芸,等.甘露聚糖结合凝集素诱导人白血病细胞系U937 细胞凋亡[J].热带医学杂志,2011,11(5):496 -499.
[7]van der Pol P,Schlagwein N,van Gijlswijk DJ,et al.Mannan-binding lectin mediates renal ischemia/reperfusion injury independent of complement activation[J].Am J Transplant,2012,12(4):877 -887.
[8]Uemura K,Saka M,Nakagawa T,et al.L-MBP is expressed in epithelial cells of mouse small intestine[J].J Immunol,2002,169(12):6945 -6950
[9]Williams JM,Duckworth CA,Watson AJ,et al.A mouse model of pathological small intestinal epithelial cell apoptosis and shedding induced by systemic administration of lipopolysaccharide[J].Dis Model Mech,2013,6(6):1388 -1399.
[10]马远航,杨松巍,孙礼刚,等.SIRT1 在TNF-α 介导的肠上皮屏障破坏中的作用及机制研究[J].重庆医学,2014,43(16):1969 -1971.
[11] Hart ML,Ceonzo KA,Shaffer LA,et al.Gastrointestinal ischemiareperfusion injury is lectin complement pathway dependent without involving C1q[J].J Immunol,2005,174(10):6373 -6380.
[12]Matthijsen RA,Derikx JP,Steffensen R,et al.Mannose-binding lectin null alleles are associated with preserved epithelial cell integrity following intestinal ischemia reperfusion in man[J].Mol Immunol,2009,46(11):2244 -2248.
[13]Sun L,Wang W,Xiao W,et al.Angiotensin II induces apoptosis in intestinal epithelial cells through the AT2 receptor,GATA-6 and the Bax pathway[J].Biochem Biophys Res Commun,2012,424(4):663 -668.
[14]Parente R,Trifirò E,Cuozzo F,et al.Cyclooxygenase-2 is induced by p38 MAPK and promotes cell survival[J].Oncol Rep,2013,29(5):1999 -2004.
[15]Park SJ,Kim IS.the role of p38 MAPK activation in auranofin-induced apoptosis of human promyelocytic leukaemia HL-60 cells[J].Br J Pharmacol,2005,146(4):506 -513.
