巨菌草诱导培养基的筛选及优化
2015-04-08颜海锋
黄 静,颜海锋,郑 燕
(1.国家菌草工程技术中心,福建 福州350002;2.福建农林大学生命科学学院,福建 福州350002)
巨菌草(Pennisetum sp.)原产于北非地区,1983年引入中国,是一种单子叶禾本科狼尾草属植物。茎直立,丛生,根系非常发达,植株高大,一般为3~5 m,最高的可达7.08 m。巨菌草喜温暖湿润条件,适宜在亚热带、热带和温带生长;属于C4植物,具有很高的光合效率,抗逆性很强,产量很高,达300~500 t·h m-2[1-2]。近几年,巨菌草在我国南方地区的种植面积逐步扩大,应用也越来越广泛,除了作为动物饲料和保持水土的优良品种[3],也用作栽培灵芝和平菇、猴头菇等食用菌的培养料[4]。此外,还可用作生物能源,用于生物发电和制造燃料[5-6]。
然而,巨菌草不耐寒,在北方寒冷地区自然难以越冬。我国北方大部分地区通过扦插进行无性繁殖;也可用种子进行有性繁殖,但发芽率很低[7],如遇冰雪和霜冻天气很容易死亡,这种特性使其在北方地区的推广严重受到限制,传统的育种技术无法解决此难题。生物技术如转基因、体细胞杂交等是改良巨菌草耐寒性的有效途径,但必须首先建立巨菌草的组织培养技术体系及转基因体系。而有关巨菌草组织培养方面的研究在国内外尚没有相关的报道。基于此,本研究以巨菌草的茎尖分生组织作为外植体,对巨菌草的愈伤组织诱导进行探索,以期为巨菌草组织培养体系建立和生物技术遗传改良奠定基础,同时为巨菌草的组培育苗提供技术支持,促进在更大范围利用和推广巨菌草。
1 材料与方法
1.1 材料
试验材料为巨菌草幼茎,在福建农林大学国家菌草工程技术中心菌草种植基地种植,由于巨菌草不断地分蘖,可随时取到比较幼嫩的茎。
1.2 方法
1.2.1 外植体准备 选取幼嫩且生长良好的巨菌草茎杆,剥除叶鞘,用刀切下茎尖部分[8-9]。
1.2.2 培养基的制备 以MS+30 mg·L-1蔗糖+2.5 mg·L-1植物胶+1 mg·L-1聚乙烯吡咯烷酮为基本培养基,p H 为5.8。
1.2.3 外植体的消毒接种 将外植体分别置于75%的乙醇中处理0、30、60 s和2%的次氯酸钠溶液中处理10、15、20 min,用无菌水冲洗3~5次,在无菌滤纸上吸干水分,用手术刀切成0.1~0.2 c m厚的小薄片,接种于MS基本培养基上,每瓶接种6块外植体,每次接种6瓶,3次重复。然后置于26~28 ℃的暗培养箱中培养,7 d 后统计外植体污染率[10-11]。
1.2.4 愈伤组织诱导
1)将外植体材料接种含2,4-D 浓度分别为0、1.0、2.0、3.0、4.0 mg·L-1的MS 培养基中,观察愈伤组织生长状况,选取愈伤组织生长最好的浓度为最佳浓度[12-14]。
2)在最佳2,4-D 浓度的基础上,在MS培养基中添加0.1、0.2、0.3、0.4 mg·L-1的NAA 或IAA与2,4-D 组合,选择愈伤组织生长最好的浓度组合[15-16]。
3)在最佳2,4-D 和最佳IAA 或NAA 的浓度组合上,在MS 培养基上添加0.5、1.0、1.5 mg·L-1细胞分裂素6-BA 或KT,选择愈伤组织生长最好的浓度组合。
以上各阶段愈伤组织的诱导均在暗培养箱中培养,培养温度为26~28 ℃[15],每个处理接种6瓶,每瓶接种4~6块外植体,3次重复(即重复18瓶),接种20 d后统计愈伤组织诱导率。
1.3 数据分析
愈伤组织诱导率=产生愈伤组织的外植体/接种的外植体总数×100%。
以上各处理的3 次重复数据平均值为结果数据,运用Excel 2010和统计分析软件DPS 6.0进行数据的显著性测验和分析。
2 结果
2.1 外植体的消毒方式
该组处理编号为A1到A11,共11种组合,结果如表1所示。
外植体的污染率在0~28%,最低的为只用次氯酸钠消毒10、20 min和只用乙醇30、60 s,污染率都为0。污染率最高的为用乙醇消毒30 s然后再用次氯酸钠消毒20 min,污染率为28%。
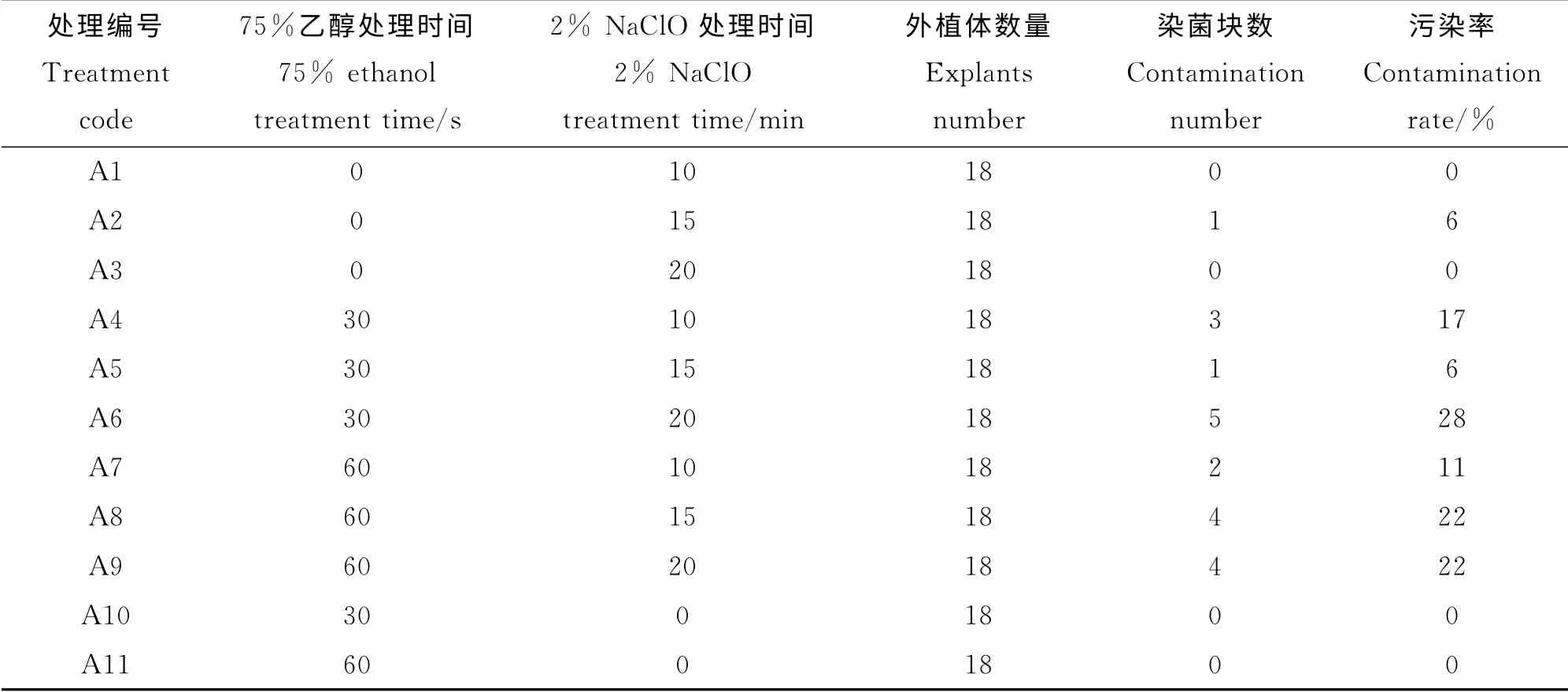
表1 不同消毒剂对外植体处理不同时间后的污染情况Table 1 Contamination r ate of explants after disinfecting by different disinfectants with different ti mes
2.2 不同浓度2,4-D 对巨菌草愈伤组织诱导的影响
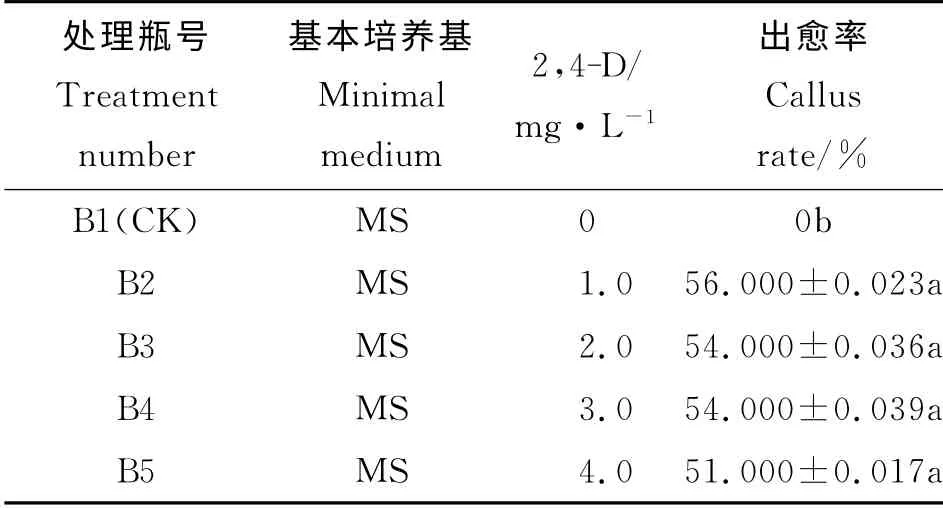
表2 不同浓度的2,4-D对巨菌草愈伤组织诱导的影响Table 2 Different concentrations of 2,4-D effects on Pennisetum sp.callus induction
与不加入2,4-D 的对照相比(表2),不同浓度的2,4-D 均能诱导出巨菌草的愈伤组织(图1)。从1.0~4.0 mg·L-14个浓度梯度中,巨菌草的出愈率并没有显著差异,在51.000%~56.000%。

图1 巨菌草茎尖的愈伤组织Fig.1 Pennisetum sp.stem tip callus
2.3 不同浓度的IAA、NAA 与2,4-D 组合对巨菌草愈伤组织诱导的影响
以MS+3.0 mg·L-12,4-D 作为基本培养基,添加不同浓度的IAA 和NAA,以不添加生长素为对照,共9个处理(表3)。
与对照相比,加入IAA 或NAA 之后,巨菌草的出愈率均有明显的提高,除C5 外其余处理与对照间差异均极显著(P<0.01)(表3)。出愈率随着IAA 浓度的增高而呈先升高再降低的趋势,在浓度为0.2 mg·L-1时达到最高水平,此时出愈率为76%,与其他浓度间差异极显著。而4 个浓度的NAA均能增加出愈率,但无显著差异(P>0.05),
以MS作为基本培养基,分别添加不同浓度的2,4-D,以不添加2,4-D 作为对照(CK),共5 个处理,结果如表2所示。出愈率都在60%左右。

表3 不同浓度的IAA、NAA与2,4-D组合对巨菌草愈伤组织诱导的影响Table 3 Influence of different concentrations combination of IAA,NAA and 2,4-D on Pennisetum sp.callus induction
2.4 不同浓度细胞分裂素对巨菌草愈伤组织诱导的影响
以MS+3.0 mg·L-12,4-D+0.2 mg·L-1IAA 为基本培养基(记为D),添加不同浓度的细胞分裂素,6-BA 或KT,以不添加细胞分裂素为对照,共有7个处理组合(表4)。
不加细胞分裂素的对照组出愈率为68%,加入细胞分裂素之后,出愈率为66.000%~71.000%,与对照相比差异不显著(P>0.05)。
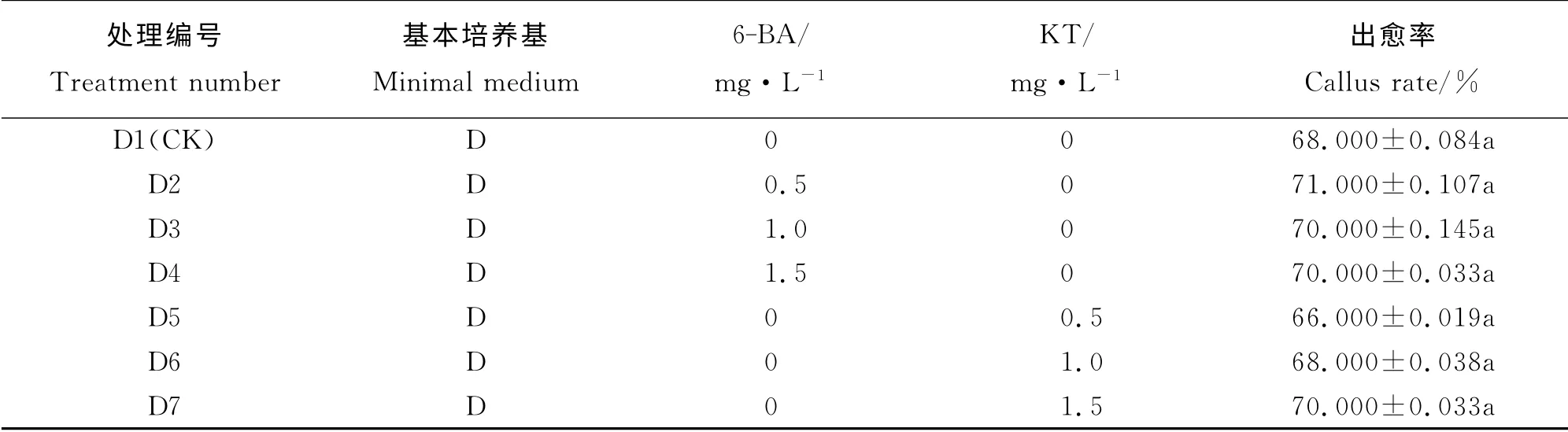
表4 不同浓度细胞分裂素对巨菌草愈伤组织诱导的影响Tabel 4 Effects of different concentration of cytokinin on Pennisetum sp.callus induction
3 讨论与结论
在植物组织培养试验中,外植体消毒是试验的第一步也是很关键的一步,如果消毒处理效果不好,将会产生大范围的污染,导致以后的步骤无法继续进行[17]。然而,影响消毒效果的因素很复杂,所以污染是普遍发生的问题。由于外植体比较幼嫩,酒精穿透力又很强,所以用酒精造成的褐化比较严重,导致外植体活力大大降低[8]。对外植体用不同的消毒剂组合及不同时间处理后发现,只用2%次氯酸钠或只用75%酒精处理外植体的效果最好,没有发现污染情况,但是用75%的酒精处理后褐化会非常严重,导致外植体的生长活力不强。如果用酒精处理后再用次氯酸钠处理染菌率反而增高,可能是出现交叉污染的状况,这与谢妤和张子雯[10]对杂交狼尾草(Pennisetu m al opecuroides)的研究结果一致的。由于本研究中用的外植体都是非常幼嫩的茎,酒精和次氯酸钠都会在一定程度上损害外植体,所以在保证无污染的情况下,消毒剂的处理时间越短越好。鉴于本研究的材料为有很多带绒毛的叶鞘,为了尽量降低污染率,又保持外植体较高的活力,先用75%酒精擦拭剥除较老的叶鞘,然后用2%的次氯酸钠溶液消毒处理10 min,从而达到了理想的消毒效果。
在甘蔗(Sacchar um)组织培养试验中,2,4-D被认为是外植体脱分化产生愈伤组织的关键因素[15]。在不含2,4-D 的培养基中,甘蔗外植体不能脱分化产生愈伤组织,这与本研究巨菌草愈伤组织的诱导结果是一致的。但是巨菌草诱导愈伤组织对浓度要求不高,2,4-D 浓度在1.0~4.0 mg·L-1的范围内都可以诱导出愈伤组织,且各浓度间差异不显著。由于前人对禾本科的组织培养结果都表明3.0 mg·L-1的2,4-D 是最佳浓度[16,18],3.0 mg·L-1的2,4-D 也是诱导绒毛狼尾草(Pennisetu m setaceum )幼穗愈伤组织的最适浓度[12],此外,本研究中虽然各个浓度2,4-D 都能诱导出愈伤组织,且出愈率差异不显著,但从愈伤组织的硬度和颜色看,3.0 mg·L-1浓度下诱导的愈伤组织长势最好,故本研究中采用3.0 mg·L-1为最佳浓度。
生长素NAA 和IAA 都能促进愈伤组织的诱导,但是浓度对其的影响差别相对比较大;虽然二者的影响均达到显著水平,但是IAA 比NAA 的效果更好,且在浓度为0.2 mg·L-1时能发挥最好的效果,诱导率高达76%。在甘蔗组织培养中,细胞分裂素KT 和6-BA 也能促进愈伤组织的诱导[15]。对象草(Pennisetu m pur pureu m)幼穗的研究表明,KT 浓度为0.05 mg·L-1或0.10 mg·L-1时,颗粒状愈伤组织的诱导率较高[19]。但是在本研究中,这两种细胞分裂素的效果不是很明显,所以在巨菌草的愈伤组织诱导中没有必要加入KT 或6-BA。
综上,巨菌草的组织培养体系与其他禾本科植物存在一定差异。巨菌草愈伤组织诱导的最佳培养基配方是MS+2,4-D(3.0 mg·L-1)+IAA(0.2 mg·L-1)。
4 展望
巨菌草愈伤组织诱导是组织培养中关键的一步,愈伤组织诱导的成功对于组织培养或体细胞杂交,甚至转基因在巨菌草上的应用都具有重要的意义。因此,在本研究基础上进一步对其愈伤组织分化成苗的培养基及培养条件进行研究,为推广巨菌草提供更多的技术支持。
[1] 丁铭,白璐,王龙清.巨菌草引进试验及栽培种植技术[J].农村科技,2013(12):60-61.
[2] 李志文.巨菌草作为能源草的特性研究[J].农业工程技术(新能源产业),2013(6):12-15.
[3] 郑金英,陈丽凤,林占禧.菌草产业成长及其多功能性探析[J].中国农学通报,2011,27(1):304-308.
[4] 董晓娜,陈喜蓉,钟剑锋,林芳能,阳记萍.巨菌草栽培灵芝试验初探[J].林业科技,2013,41(1):39-40.
[5] 林兴生,林占熺,林冬梅,林辉,罗海凌,胡应平,林春梅,朱朝枝.菌草作为生物质燃料的初步研究[J].福建林学院学报,2013,33(1):82-86.
[6] 邱世海,韦立新,席春燕,刘洁,黄焕耀,章超,江日德.生物质发电厂燃料适用预处理技术应用现状[J].轻工科技,2012(5):102-104.
[7] 黄国勇.应用菌草技术治理宁夏荒漠化土地的研究与展望[J].防护林科技,2011(2):46-48.
[8] 曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1996.
[9] 王凭青,段传人,王伯初,周兴龙,谢伟伟.杂交狼尾草不同外植体材料组织培养实验[J].重庆大学学报(自然科学版),2005,28(6):118-120.
[10] 谢妤,张子雯.杂交狼尾草离体培养植株再生体系的建立[J].宜春学院学报,2012,34(12):97-99.
[11] 赵丽君,王雪芳,张金林,王锁民.植物组织培养及其在草类植物中的研究和应用[J].草业科学,2011,28(6):1140-1148.
[12] 缪珊,范继红.绒毛狼尾草幼穗的愈伤组织诱导与植株再生[J].安徽农业大学学报,2011,38(2):255-258.
[13] Mythili P K,Satyavathi V,Pavanku mar G.Genetic analysis of short ter m callus culture and mor phogenesis in pearl millet,Pennisetum gl aucum[J].Plant Cell,Tissue and Organ Culture,1997,50:171-178.
[14] Morrish E M,Hanna W W,Vasil I K.The expression and per petuation of inherent so matic variation in regenerants fro m embryogenic cultures of Pennisetu m gl aucu m (L.)R.Br.(pearl millet)[J].Theoretical and Applied Genetics,1990,80:409-416.
[15] 杨燕妮.甘蔗离体培养的胚性细胞团——诱导与分化研究[D].南宁:广西大学硕士论文,2011.
[16] 张晓莹,张瀚俪,牟彤,龚束芳.外源激素对紫穗狼尾草愈伤组织诱导及分化的影响[J].草业科学,2012,29(7):1066-1071.
[17] 朱广廉.植株组织培养中的外植体灭菌[J].植物生理学通讯,1996,32(6):444-449.
[18] 杨燕妮.甘蔗离体培养的胚性细胞团诱导与分化研究[D].广西:广西大学硕士论文,2011:5-36.
[19] 钟小仙,佘建明,顾洪如,张建丽,倪万潮.象草幼穗离体培养植株再生研究[J].草业学报,2007,16(3):43-48.
