15 份不同暖季型草坪草生长量对长期水淹和水涝胁迫的响应
2015-04-08高艳芝宗俊勤陈静波赵瑞霜刘建秀
高艳芝,宗俊勤,陈静波,赵瑞霜,刘建秀
( 1. 江苏省中国科学院植物研究所( 南京中山植物园) ,江苏南京210014; 2. 南京农业大学园艺学院,江苏南京210095)
随着我国城市化进程的快速发展,作为三大园林观赏植物之一的草坪草,在园林绿化和景观建设中的应用越来越广泛[1],无论是在公园、街道、广场、小区和庭院的绿化,还是运动场、球场的建设,甚至是公路、高速路及山体、水体的边坡防护,都开始广泛使用草坪草。水分作为草坪草生长的关键环境因素,缺乏或者过多均会对草坪草的生长产生不利影响,近年来,极端水分胁迫的频率和严重程度有增加趋势[2]。一般情况下,淹涝胁迫出现的频率不如干旱胁迫那么高,但在某些地区或某个特定时期内,频繁的暴雨或过量灌溉,会导致草坪草受到水涝胁迫甚至是全淹胁迫的伤害。我国南方部分省区年降水量超过2 000 mm,单夏季就集中了全年降水量60% ~80%[3],尤其在梅雨季节,雨季持续时间长,草坪长期处于水涝或水淹环境中,其正常生长受到严重抑制,破坏草坪的观赏性,其中又以黄淮平原和长江中下游地区最为严重,占全国受灾面积3/4 以上[4]。不仅如此,水利工程中,河湖结合岸带常处于水分频繁变化区域,对草坪的耐淹涝性亦提出很高要求。故而,针对该地区常用的暖季型草坪草耐淹涝性的研究显得十分重要。
草坪草生长过程中由水分过多引起的胁迫可分为水涝胁迫和水淹胁迫。水涝胁迫指植物的茎秆和叶片都暴露在空气中,仅植物的根际被水分包围所引起的胁迫[5]。而水淹胁迫是指整个植株,包括地下的根系和地上的茎秆、叶片均浸泡在水中所引起的胁迫,有时水面甚至可能超过草层最高点数米以上。这两种胁迫对狗牙根(Cynodon dactylon)、匍匐剪股颖(Agrostis stolonifera)、毛花雀稗(Paspalum dilatatum)、早熟禾(Poa pratensis)、结缕草(Zoysia japonica)、高羊茅(Festuca arundinacea)及多年生黑麦草(Lolium perenne)等生长的影响均有相关研究报道[1,6-10]。然而草坪草的耐涝性和耐淹性是相当复杂的数量性状,容易受草种、生长阶段、草坪管理、外界环境等因素的影响,且水涝胁迫和水淹胁迫对草坪草的伤害方式是不同的[11],草坪草在这两种胁迫下生长的表现以及植物应对这两种胁迫时生理和形态的变化也有所差异。目前,国内外对不同草坪草的耐淹性或耐涝性的比较评价已经取得了初步进展,但一些暖季型草坪草如杂交狗牙根(Cynodon dactylon × C. transadlensis)、海 滨 雀 稗(Paspalum vaginatum)、伪针茅(Pseudoraphis spinescens)等的耐淹性还不是很明确。
本研究根据长江中下游地区的气温及季节性降水等特点,集中选择在该地区广泛分布的6 种15 份暖季型草坪草种作为研究材料,分别对其在水淹胁迫和水涝胁迫下的生长情况进行比较,采用隶属函数法对其耐淹涝能力进行评价,以期为我国南方地区河湖岸带植物群落修复和生态系统构建植物的选择提供可靠的选项,也为该地区草坪草耐淹涝性机理的研究提供材料。
1 材料与方法
1.1 试验材料
试验材料包括6 种15 份暖季型草坪草种质资源,分别为狗牙根(C106、C134、C291、C851、C852)、杂交狗牙根(C751、C807)、双穗雀稗(P018、P019、P020)、假俭草(E193、E194)、海滨雀稗(P006、P021)和伪针茅(PX02)(表1),材料均取自江苏省中国科学院植物研究所草业中心试验地(32°02' N,118°28' E,海拔30 m)。试验在江苏省中国科学院植物研究所草业中心的温室内进行,采取自然光照,试验期间日最高气温平均值为28.5 ℃、日最低气温平均值为20.5 ℃。
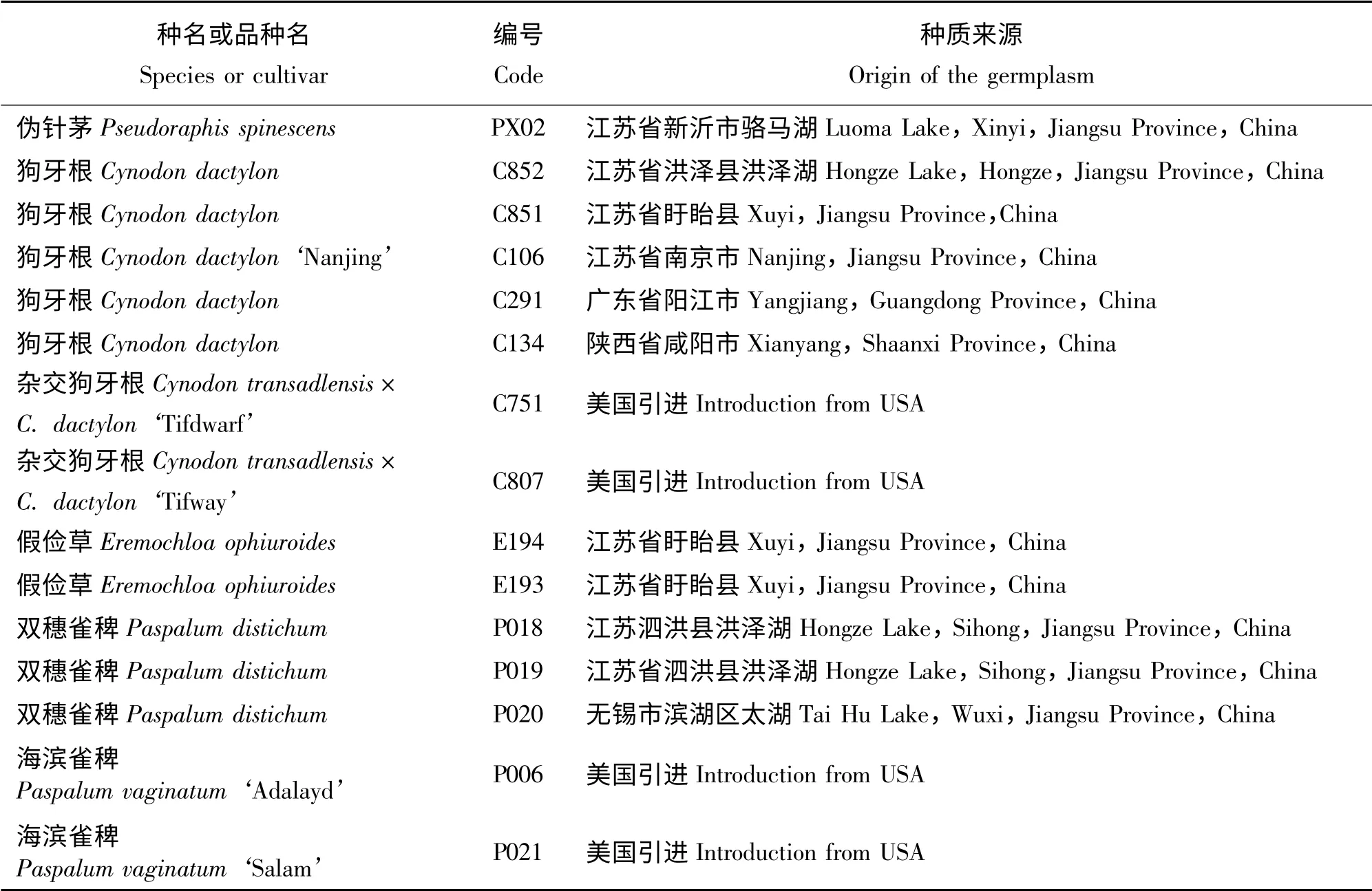
表1 供试草坪草及来源Table 1 Species and cultivar source of turfgrasses used in this experiment
1.2 试验方法
1.2.1 材料培养 2012 年6 月8 日选取长势一致的带一个腋芽的匍匐茎段扦插种植于装有沙∶ 土=1∶ 4 基质的塑料花盆中,每盆种植40 ~50 个茎段,花盆高12 cm,直径14 cm,每份材料设置3 个重复,材料种植后培养两个月。置于光照良好的玻璃温室中培养,培养期间每天清晨和傍晚各浇水一次,保证植株水分,每10 d 进行一次修剪,由于不同草种的生长特性不一样,适宜的修剪高度也不一样,根据不同草种的生长特性,修剪高度分别为:狗牙根、假俭草、海滨雀稗和杂交狗牙根5 cm,伪针茅及双穗雀稗10 cm,待各材料在盆中盖度超过80%后开始进行处理,并于8 月10 日开始处理前进行最后一次修剪。
1.2.2 水涝和水淹处理 8 月10 日利用“双套盆法”对材料进行淹水处理[12],将修剪后的参试材料连花盆一起放入高25 cm,直径29 cm 的水桶中,用自来水进行淹水处理。水面跟花盆内土面相平为水涝胁迫,水面高于草层修剪高度10 cm 以上为水淹胁迫,对照维持土壤含水量40% ~45%,处理时间为两个月。处理期间对照每天用土壤水分测定仪测定土壤含水量,根据需要在清晨或傍晚适时补充水分,水涝和水淹胁迫处理的材料每3 d 对水桶进行补水,每5 d 换水一次,适时去除水中的水藻等杂质,维持水体透明度,以保证植物正常光合作用。
1.2.3 指标测定 水淹胁迫和水涝胁迫60 d 后,按各材料培养阶段要求的修剪高度进行修剪,修剪下来的鲜样于80 ℃恒温下烘干至恒重后称重,得到修剪干重数据;将处理后的各材料从花盆中取出,洗去土壤等杂质并于80 ℃恒温烘干至恒重后,分出烘干的根系后称重即为根系干重;收获材料的剩余部分重量(冠层干重)与修剪干重的总和即为地上部分干重。在水淹胁迫试验结束时已死亡的材料(假俭草‘E193’和假俭草‘E194’),其地上干重、根系干重为0。
1.2.4 统计分析 用Excel 2003 将测得的修剪干重、地上干重和根系干重数值分别与各自的对照相比较,转换成相对值(各指标的相对值=处理测定值/对照测定值×100%),并利用SPSS 17.0 软件对数据进行方差分析,设定显著性水平P <0.05。
利用模糊数学中求隶属函数的方法对数据进行换算[13],换算公式为:
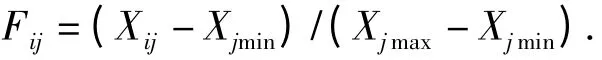
式中,Fij表示i 种类j 指标的隶属函数值,Xij表示i种类j 指标水涝或水淹处理后材料和对照间的比值,Xmax和Xmin分别表示各种类指标的最大和最小值,通过计算水涝胁迫和水淹胁迫下各指标的隶属函数值及其平均值,对供试材料的耐涝性和耐淹性进行分析。
2 结果与分析
2.1 水涝胁迫对6 种15 份材料生长的影响
2.1.1 水涝胁迫对6 种15 份材料相对修剪干重的影响 草坪管理中最常用的一项措施是对其进行特定高度的修剪,通过修剪较容易获得草坪在一定时间、一定环境下累积生物量的数据,可直观反映该草坪在该环境下的生存能力。因此,草层修剪干重成为草坪草耐水涝胁迫评价中常用的一个指标[6-7]。
本试验中供试的6 种15 份材料在水涝胁迫处理两个月后,各草种的生长能力均受到不同程度的影响,而且变异幅度很大,变异系数的平均值达到22.68%(表2)。水涝胁迫两个月后,相对修剪干重最高的为双穗雀稗‘P018’(120.03%),其次为伪针茅‘PX02’(111.74%)和双穗雀稗‘P019’(107.33%),3 份材料在水涝期间生物量的积累均大于对照,并显著高于其他参试材料(P <0.05),说明水涝胁迫在一定程度上促进了其生长。水涝除对上述3 份材料的生长有促进作用外,抑制了绝大部分材料的生长,且这种抑制程度因草种不同而不同,双穗雀稗‘P021’、双穗雀稗‘P020’、海滨雀稗‘P006’、狗牙根‘C291’、假俭草‘E194’、杂交狗牙根‘C751’和狗牙根‘C106’等材料受到的抑制作用相对较小,其相对修剪干重集中在96.69% ~76. 03%,而狗牙根‘C134’、杂交狗牙根‘C807’、狗牙根‘C852’、狗牙根‘C851’和假俭草‘E193’等材料的生长受到明显的抑制,其受到水涝的伤害较重,得到的修剪干重与对照相比均下降了近40%。
2.1.2 水涝胁迫对15 份材料相对地上部分干重的影响 地上部分干重是由修剪干重和冠层干重两部分组成,由于冠层干重所占的比例要偏高于修剪干重,且其受到水涝胁迫的影响较小,所以相对地上干重的变化也较小。15 份供试材料中,双穗雀稗‘P018’的地上部分相对重量达120.78%,显著高于对照并显著高于其他材料(P <0.05)(表2)。双穗雀稗‘P019’、海滨雀稗‘P021’的表现次之,其地上部分相对重量显著高于除双穗雀稗‘P018’之外的其他材料,双穗雀稗‘P019’和海滨雀稗‘P021’之间无显著差异(P >0.05)。再次是双穗雀稗‘P020’和假俭草‘E194’、海滨雀稗‘P006’、杂交狗牙根‘C751’、伪针茅‘PX02’、狗牙根‘C291’、狗牙根‘C106’等草种。狗牙根‘C852’及狗牙根‘C807’、狗牙根‘C851’、狗牙根‘C134’和假俭草‘E193’在水涝处理两个月后,相对地上干重显著低于其他材料,是受伤害较大的几份材料,其中狗牙根‘C134’受到的伤害最大。由此可见,试验中各参试草种受水涝胁迫后相对地上干重的变化趋势与各自地上修剪干重的变化趋势相似。
2.1.3 水涝胁迫对6 种15 份材料相对根系生长的影响 植物体是一个统一的整体,其根系的生长和地上部分的生长是紧密联系的,水涝胁迫下,植物根系处于缺氧的土壤中,这种根际缺氧直接导致根系有氧呼吸受到抑制而出现供能不足,抑制了植物地上部分的生长,而地上部分长势不良又无法提供足够的光合产物给根系,必然导致材料根系生长受阻。本试验中,水涝胁迫对双穗雀稗‘P018’、双穗雀稗‘P019’和海滨雀稗‘P021’材料的根系生长具有一定的促进作用,其根系干重均高于对照(表2);狗牙根‘C291’、杂交狗牙根‘C751’、伪针茅‘PX02’、假俭草‘E194’、双穗雀稗‘P020’、海滨雀稗‘P006’、狗牙根‘C106’和假俭草‘E193’等材料的根系生长基本未受水涝的影响或影响相对较小;而狗牙根‘C134’、‘C852’和‘C851’以及杂交狗牙根‘C807’的根系生长则明显被抑制。由此可见,水涝胁迫下15 份材料的相对根系干重与相对地上干重生长受到的影响基本一致。
2.1.4 供试材料耐涝能力的综合评价 以3 个指标隶属函数值的平均值对15 份草坪草材料在水涝胁迫下的耐涝性强弱进行综合评价(表2),隶属函数值的平均值越大,说明在水涝处理后受到的伤害越小,耐涝性越强。15 份材料的耐涝性由强到弱依次为双穗雀稗‘P018’>双穗雀稗‘P019’>海滨雀稗‘P021’>伪针茅‘PX02’>双穗雀稗‘P020’>假俭草‘E194’>杂交狗牙根‘C751’>狗牙根‘C291’>海滨雀稗‘P006’>狗牙根‘C106’>假俭草‘E193’>杂交狗牙根‘C807’= 狗牙根‘C852’>狗牙根‘C851’>狗牙根‘C134’。
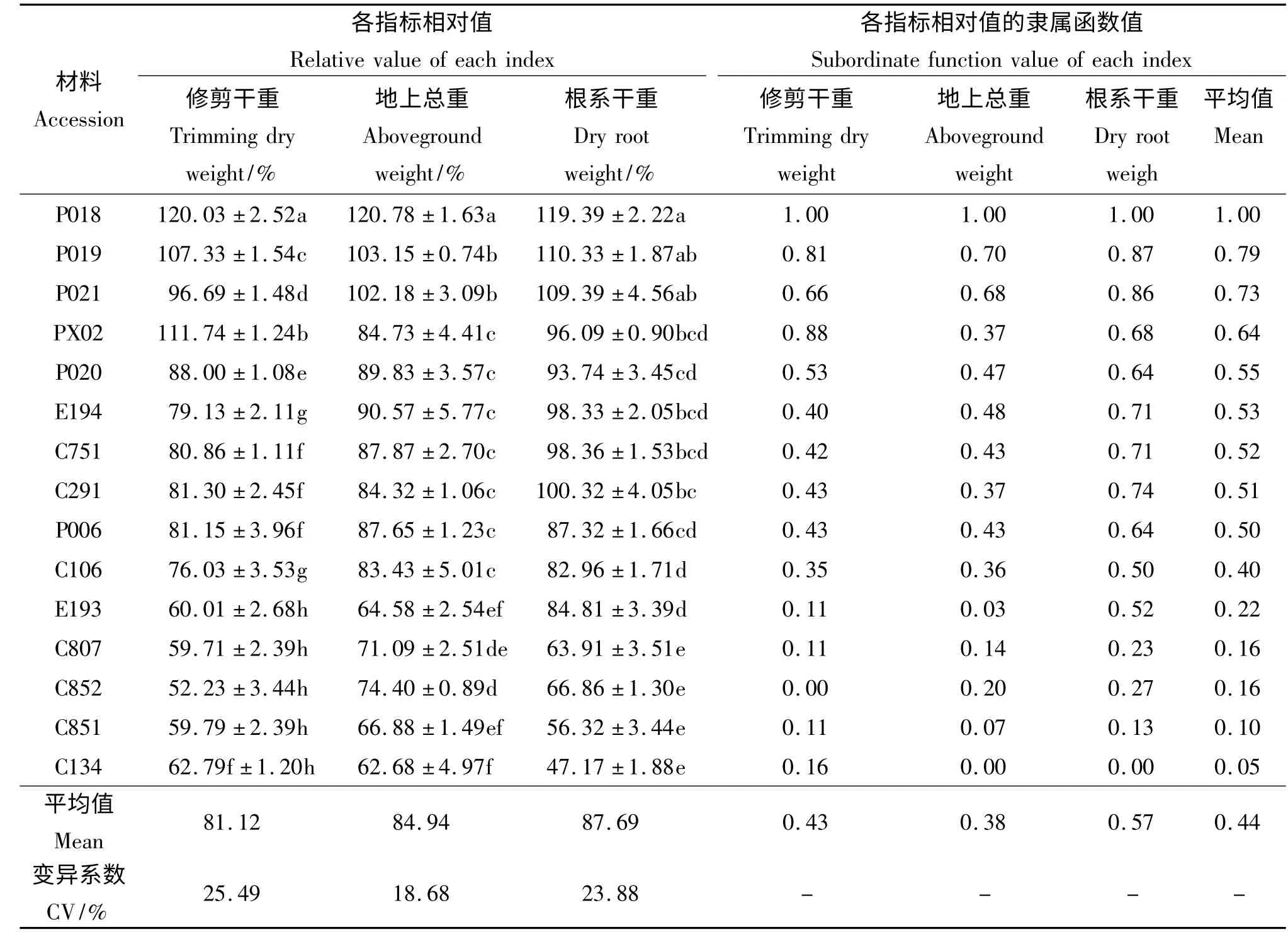
表2 水涝胁迫两个月后材料各个指标相对值及隶属函数值Table 2 Relative value of each index and the subordinate function value of materials under waterlogging stress condition after 2 months
2.2 水淹胁迫对6 种15 份材料生长的影响
2.2.1 水淹胁迫对6 种15 份材料相对修剪干重的影响 近年来研究发现,利用植物在水淹胁迫一定时间后相对生物量的差异,可十分直观地评价其对水淹胁迫的适应性[6]。本试验中15 份草坪草材料在水淹胁迫两个月后的生长情况差异很大(表3),变异系数高达132.16%。水淹胁迫明显抑制所有材料的枝叶生长,其中双穗雀稗‘P018’及伪针茅‘PX02’在水淹期间受到的伤害最小,相对修剪干重分别为85.41%和83.49%,其淹水期间枝叶的再生能力明显优于其他材料;双穗雀稗‘P019’(69.97%)和‘P020’(53.13%)在全淹胁迫下的相对生长量虽然低于上述两份材料,但亦维持在50%以上;而其他11 份材料的相对修剪干重均不足20%,表明水淹胁迫对植株生长已产生严重的伤害。
2.2.2 水淹胁迫对6 种15 份材料相对地上部分干重的影响 15 份供试材料在水淹处理后地上部分生长受到的影响差异显著(P <0.05)。供试草坪草种中,双穗雀稗‘P018’相对地上部分总重最高,为88.62%,双穗雀稗‘P019’(69. 79%)和‘P020’(61.72%)及伪针茅‘PX02’(52.05%)次之,上述材料在水淹胁迫下的生长状况明显优于其他参试材料。其余材料中,狗牙根‘C851’、狗牙根‘C852’和狗牙根‘C291’的地上部分干重较高,杂交狗牙根‘C807’和‘C751’及海滨雀稗‘P006’和狗牙根‘C106’次之,他们受到水淹胁迫的严重伤害,在水淹期间的相对地上部分干重均很小,而受水淹胁迫伤害最严重的是假俭草‘E193’和‘E194’,在水淹处理两个月后全部死亡(表3)。
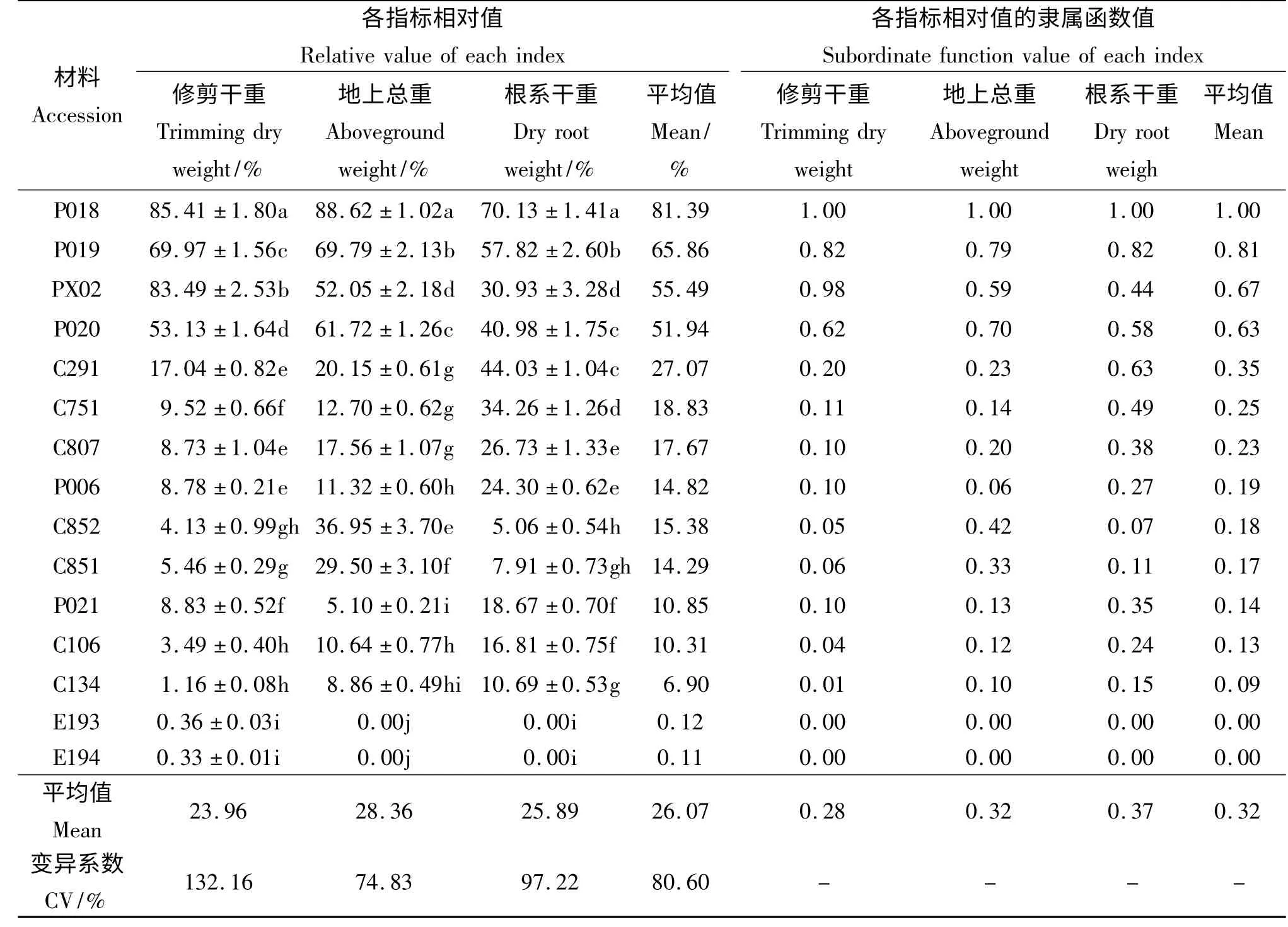
表3 水淹胁迫两个月后材料各个指标相对值和隶属函数值Table 3 Relative value of each index and the subordinate function value of the material under submergence stress condition after two months
2.2.3 水淹胁迫对6 种15 份材料相对根系干重的影响 供试的15 份参试草种中相对根系干重最大的为双穗雀稗‘P018’(70.13%),其次为双穗雀稗‘P019’(57.82%)、狗牙根‘C291’(44.03%)和双穗雀稗‘P020’(40. 98%),再次为杂交狗牙根‘C751’(34.26%)(表3)。水淹对伪针茅‘PX02’根系生长的抑制较大,其相对根系干重仅有30.93%,杂交狗牙根‘C807’的相对根系干重值略低,为26.73%。试验中受水淹胁迫伤害最严重的是假俭草‘E193’和‘E194’,其已全部死亡,因此根系相对干重为0(表3)。
2.2.4 供试材料耐淹能力的综合评价 根据3 个指标隶属函数的平均值(表3),分析这15 份材料的耐淹性强弱。材料‘P018’的隶属函数平均值最大,说明其在供试的15 份材料中适应水淹胁迫的能力最强、受到的伤害是最小。15 份材料的耐淹性由强到弱依次为双穗雀稗‘P018’>双穗雀稗‘P019’>伪针茅‘PX02’>双穗雀稗‘P020’>狗牙根‘C291’>杂交狗牙根‘C751’>杂交狗牙根‘C807’>海滨雀稗‘P006’>狗牙根‘C852’>狗牙根‘C851’>海滨雀稗‘P021’>狗牙根‘C106’>狗牙根‘C134’>假俭草‘E194’=假俭草‘E193’。
3 讨论
草坪草遭受水分过多的胁迫主要是水涝胁迫和水淹胁迫,这两种胁迫对草坪草的伤害程度相差很大。目前对水涝胁迫的定义为仅植物的根际被水分包围,植物的茎秆和叶片都暴露在空气中,一般是由于洪水或在排水不好的土壤中过量灌溉所引起[5,11]。禾本科植物被证实是耐涝性较好的一类植物[11,14],如对匍匐剪股颖和早熟禾等进行水涝胁迫的研究发现,虽然长时间的水涝胁迫后上述材料生物量的累积有所下降,但均未出现完全死亡的情况[6-7,15]。本研究中,参试的15 份暖季型草坪草在夏季高温下水涝处理60 d 后,均可以保证较高的存活率和生物量积累,可能是因为其根离叶鞘的距离相对较近,进入叶鞘的氧气到达根部的运输距离很短,从而使根部的缺氧症状得到缓解,保证植株的相对正常生长[16]。海滨雀稗是在沿海沙丘上生长进化而来,其根系能够适应极端的水涝环境[17],在水涝处理期间地上部分可以维持正常的生长,供试的海滨雀稗的相对生物量可达87.65% 和87. 32%。狗牙根通过改变叶形和减少生物量等方式来增强自身对水涝胁迫的耐受能力,保证在水涝胁迫下植株不会死亡[18]。夏季水涝胁迫后毛花雀稗的叶片水势、气孔导度、蒸腾速率都没有受到明显的影响[9],这与其多孔的根系有关,这种根系结构利于氧气的传导,从而维持根系在缺氧环境下的呼吸和其它功能的正常发挥[19-23]。参试的双穗雀稗等材料在夏季高温遭受水涝胁迫后不但没有死亡,还出现累积的生物量高于对照的情况,可能双穗雀稗与毛花雀稗同属于雀稗属,推测其在根系结构上与毛花雀稗有一定的共性;另外,土壤中充足的水分可以迅速补充高温等引起的强蒸腾后植株缺失的水分,保证其生长所需的水分,从而促进植株的生长[22]。
水淹胁迫是指整个植株,包括地下根系和地上茎秆、叶片都被水覆盖,在这种情况下整个植株的通气组织都淹没在水中,从大气中吸收氧气并继续二氧化碳交换的能力被限制[24-25],随着淹水时间的延长,根系呼吸以及土壤中微生物的呼吸消耗了土壤中大量的氧气,土壤的氧化还原势降低[26],这种变化使得土壤中有毒化合物硫化物、可溶性铁和锰、乙醇、乳酸、乙醛和乙酸等大量积累[27-28],且水淹后整个植株都在水中,无法进行正常的光合作用,随着时间延长,叶片腐烂、脱落,无法正常生长,土壤中氧气的缺乏以及有毒物质的积累给处在水淹环境中的植物带来严重伤害,在外界温度较高的情况下,这种破坏要远强于水涝胁迫[29-30],故在夏季完全水淹两个月的时间内参试的狗牙根、海滨雀稗和假俭草等材料茎秆、叶片停止生长,水淹两个月时间内生物量积累最多的仅有对照的17.04%,最小的仅有对照的1.16%,耐淹性最差的假俭草[31],全淹胁迫60 d 后植株全部死亡。然而,有些植物通过形态、生理和代谢的多种多样的变化来应对水淹胁迫[32-34],如完全水淹下生长受到明显抑制的空心莲子草(Alternanthera philoxeroides)等植物,高速的茎秆生长速度使得茎秆在短时间内伸出水面,进而恢复其地上部分叶片正常的光合能力[35-36]。本研究中全淹胁迫下双穗雀稗、伪针茅等材料可能也是因为其茎秆的纵向生长速率快,伸长生长旺盛,水淹胁迫后茎秆和叶片及时长出水面,恢复了地上叶片的光合速率,维持植株整体相对正常的生长,故而能在相同的水淹处理后保持较高的生物量积累,说明其耐淹性相对较强。
草坪草经受水涝胁迫和水淹胁迫后的生长情况完全不同,参试的杂交狗牙根‘C751’、狗牙根‘C291’、海滨雀稗‘P021’和假俭草‘E194’等的耐涝性均较好,是水涝环境下生态系统构建的理想材料,但不适应种植于长期水淹胁迫的环境中;双穗雀稗‘P018’、‘P019’和伪针茅‘PX02’,由于在两种胁迫下均能维持较好的长势,说明其具有优良的耐淹性和耐涝性,是长期遭受水淹胁迫的河湖岸带理想的植物群落修复和生态系统构建植物。
[1] 胡化广,刘建秀,宣继萍,何秋,程晓丽,郭爱桂.结缕草属植物的抗旱性初步评价[J].草业学报,2007,16(1):47-51.
[2] Bailey-Serres J,Lee S C,Brinton E. Waterproofing crops:Effective flooding survival strategies[J]. Plant Physiology,2012,160(4):1698-1709.
[3] 刘可心,李科云,杨知建.耐淹性草种的研究进展[J].草业科学,2008,25(7):11-18.
[4] 时明芝,周保松.植物涝害和耐涝机理研究进展[J].安徽农业科学,2006,34(2):209-210.
[5] Peeters A J M,Cox M C H,Benschop J J,Vreeburg R A,Bou J,Voesenek L A.Submergence research using Rumex palustris as a model:Looking back and going forward[J].Journal of Experimental Botany,2002,53:391-398.
[6] Jiang Y,Wang K.Growth,physiological and anatomical responses of creeping bentgrass cultivars to different depths of waterlogging[J].Crop Science,2006,46(6):2420-2426.
[7] Wang K,Jiang Y.Waterlogging tolerance of Kentucky bluegrass cultivars[J].HortScience,2007,42(2):386-390.
[8] Mollard F P O,Striker G G,Ploschuk E L,Vega A S,Insausti P.Flooding tolerance of Paspalum dilatatum (Poaceae:Paniceae)from upland and lowland positions in a natural grassland[J].Flora-Morphology,Distribution,Functional Ecology of Plants,2008,203(7):548-556.
[9] Mollard F P O,Striker G G,Ploschuk E L,Insausti P. Subtle topographical differences along a floodplain promote different plant strategies among Paspalum dilatatum subspecies and populations[J].Austral Ecology,2010,35(2):189-196.
[10] Liao J,Jiang M,Li L. Effects of simulated submergence on survival and recovery growth of three species in water fluctuation zone of the three gorges reservoir[J].Acta Ecologica Sinica,2010,30(4):216-220.
[11] Kopp K L,Jiang Y. Turfgrass water use and physiology[A]. Stier J C,Horgan B P,Bonos St A. Turfgrass:Biology,Use and Management[M].Madison:American Society of Agronomy,2012:319-345.
[12] 王俊良,龙启炎,汪李平,骆海波,吕慧芳,徐翠容.淹水胁迫及胁迫解除对甜瓜光合色素和光合特性的影响[J].中国蔬菜,2013,6(8):50-55.
[13] 陈托兄,王铁梅,卢欣石.紫花苜蓿非秋眠型标准品种种子萌发期耐盐性评价[J].草业科学,2011,28(1):121-126.
[14] Striker G G.Flooding Stress on Plants:Anatomical,Morphological and Physiological Responses[A].John Kiogora Mworia.Botany[M].Rijeka:In Tech,2012:3-28.
[15] Wang K,Bian S,Jiang Y.Anaerobic metabolism in roots of Kentucky bluegrass in response to short-term waterlogging alone and in combination with high temperatures[J].Plant and Soil,2009,314(1-2):221-229.
[16] Etherington J R.Relationship between morphological adaptation to grazing,carbon balance and water logging tolerance in clones of Dactylis glomerata L[J].New Phytologist,1984,98(4):647-658.
[17] Duncan R R,Duncan R R,Carrow R N.Seashore Paspalum:The Environmental Turfgrass[M].Chelsea:John Wiley & Sons,2000:81-82.
[18] 陈芳清,黄友珍,曾旭.狗牙根营养繁殖体对模拟水淹的生物学响应[J].热带亚热带植物学报,2010,18(1):15-20.
[19] Insausti P,Grimoldi A A,Chaneton E J,Vasellati V.Flooding induces a suite of adaptive plastic responses in the grass Paspalum dilatatum[J].New Phytologist,2001,152(2):291-299.
[20] Striker G G.Visiting the methodological aspects of flooding experiments:Quantitative evidence from agricultural and ecophysiological studies[J].Journal of Agronomy and Crop Science,2008,194(4):249-255.
[21] Striker G G,Insausti P,Grimoldi A A.Flooding effects on plants recovering from defoliation in Paspalum dilatatum and Lotus tenuis[J].Annals of Botany,2008,102(2):247-254.
[22] Striker G G,Manzur M E,Grimoldi A A.Increasing defoliation frequency constrains regrowth of the forage legume Lotus tenuis under flooding.The role of crown reserves[J].Plant and Soil,2011,343(1-2):261-272.
[23] Insausti P,Grimoldi A A,Chaneton E J,Vasellati V.Flooding induces a suite of adaptive plastic responses in the grass Paspalum dilatatum[J].New Phytologist,2001,152(2):291-299.
[24] Colmer T D,Pedersen O.Underwater photosynthesis and respiration in leaves of submerged wetland plants:Gas films improve CO2and O2exchange[J].New Phytologist,2008,177(4):918-926.
[25] Vashisht D,Hesselink A,Pierik R,Ammerlaan J M H,Bailey-Serres J,Visser E J W,Pedersen O,Van Z M,Vreugdenhil D,Jamar D C L,Voesenek L A C J,Sasidharan R.Natural variation of submergence tolerance among Arabidopsis thaliana accessions[J].New Phytologist,2011,190(2):299-310.
[26] Pezeshki S R.Wetland plant responses to soil flooding[J].Environmental and Experimental Botany,2001,46(3):299-312.
[27] Kozlowski T T.Responses of woody plants to flooding and salinity[J].Tree Physiology Monograph,1997,1(1):1-29.
[28] Fiedler S,Vepraskas M J,Richardson J L.Soil redox potential:Importance,field measurements,and observations[J].Advances in Agronomy,2007,94:1-54.
[29] Perata P,Alpi A.Plant responses to anaerobiosis[J].Plant Science,1993,93(1):1-17.
[30] Geigenberger P.Response of plant metabolism to too little oxygen[J].Current Opinion in Plant Biology,2003,6(3):247-256.
[31] Fry J D.Submersion tolerance of warm-season turfgrasses[J].HortScience,1991,26(7):927-927.
[32] 曾淑华,刘飞虎,覃鹏,刘小莉,郭锦海,郭春明. 淹水对烟草光合作用影响初探[J]. 广西农业科学,2004,35(4):261-264.
[33] 胡田田,康绍忠.植物淹水胁迫响应的研究进展[J].福建农林大学学报:自然科学版,2005,34(1):18-24.
[34] 王海锋,曾波,李娅,乔普,叶小齐,罗芳丽.长期完全水淹对4 种三峡库区岸生植物存活及恢复生长的影响[J].植物生态学报,2008,32(5):977-984.
[35] Luo F L,Nagel K A,Scharr H,Zeng B,Schurr U,Matsubara S.Recovery dynamics of growth,photosynthesis and carbohydrate accumulation after de-submergence:A comparison between two wetland plants showing escape and quiescence strategies[J].Annals of Botany,2011,107(1):49-63.
[36] 罗芳丽,曾波,陈婷,叶小齐,刘巅. 三峡库区岸生植物秋华柳对水淹的光合和生长响应[J]. 植物生态学报,2007,31(5):910-918.
