瓜馥木中一种黄酮的NMR表征
2015-04-07傅春燕

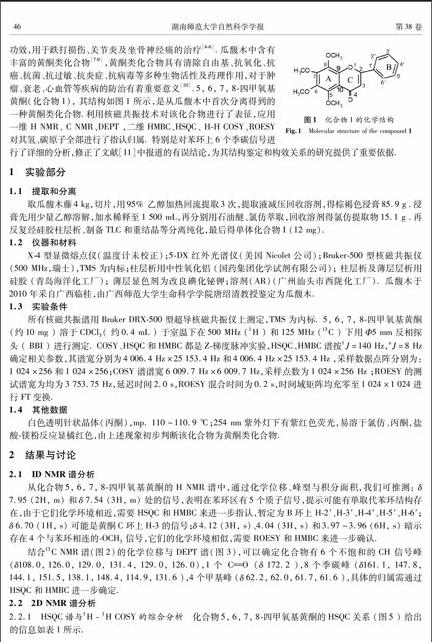
摘要 采用1H、13C、DEPT(无畸变极化转移增益法)、1H 1H COSY(氢氢化学位移相关谱)、1H 1H ROESY(氢氢化学位移空间相关谱) 、HSQC(异核单量子相关谱)、HMBC(异核多键相关谱)等多种NMR分析方法,对从瓜馥木中分离得到的5, 6, 7, 8四甲氧基黄酮的 1H和13C NMR信号进行了全归属,特别是应用1H 1H ROESY空间相关谱和HMBC等平面相关谱相结合的分析方法,对该化合物中苯环上6个季碳信号进行了详细的分析.修正了文献中报道的结论,为其结构鉴定和构效关系的研究提供了重要依据.
关键词瓜馥木; 5, 6, 7, 8 tetramethoxyflavone; 1D NMR; 2D NMR
中图分类号O657.61文献标识码A文章编号10002537(2015)01004505
瓜馥木(Fissistigma oldhamii ( Hems1.) Merr.),又名铁钻、钻山风[1],是番荔枝科瓜馥木属植物[2],为广西特色植物“十八钻”之一[3]. 其根、茎、皮、花都可药用,性温味辛,具有祛风除湿、镇痛消肿、活血化瘀等功效,用于跌打损伤、关节炎及坐骨神经痛的治疗[46].瓜馥木中含有丰富的黄酮类化合物[79],黄酮类化合物具有清除自由基、抗氧化、抗癌、抗菌、抗过敏、抗炎症、抗病毒等多种生物活性及药理作用,对于肿瘤、衰老、心血管等疾病的防治有着重要意义[10].5, 6, 7, 8四甲氧基黄酮(化合物1), 其结构如图1所示,是从瓜馥木中首次分离得到的一种黄酮类化合物.利用核磁共振技术对该化合物进行了表征,应用一维 H NMR、 C NMR、DEPT ,二维HMBC、HSQC、 HH COSY、ROESY对其氢、碳原子全部进行了指认归属. 特别是对苯环上6个季碳信号进行了详细的分析,修正了文献[11]中报道的有误结论,为其结构鉴定和构效关系的研究提供了重要依据.
1实验部分
1.1提取和分离
取瓜馥木藤4 kg,切片,用95% 乙醇加热回流提取3次,提取液减压回收溶剂,得棕褐色浸膏85.9 g .浸膏先用少量乙醇溶解,加水稀释至1 500 mL,再分别用石油醚、氯仿萃取,回收溶剂得氯仿提取物15.1 g .再反复经硅胶柱层析、制备TLC和重结晶等分离纯化,最后得单体化合物I (12 mg).
1.2仪器和材料
X4型显微熔点仪(温度计未校正);5DX红外光谱仪(美国Nicolet公司);Bruker500型核磁共振仪(500 MHz,瑞士),TMS为内标;柱层析用中性氧化铝 (国药集团化学试剂有限公司); 柱层析及薄层层析用硅胶 (青岛海洋化工厂); 薄层显色剂为改良碘化铋钾;溶剂(AR)(广州汕头市西陇化工厂). 瓜馥木于2010年采自广西临桂,由广西师范大学生命科学学院唐绍清教授鉴定为瓜馥木.
1.3实验条件
所有核磁共振谱用Bruker DRX500型超导核磁共振仪上测定,TMS为内标. 5, 6, 7, 8四甲氧基黄酮 (约10 mg ) 溶于CDCl3 ( 约0.4 mL ) 于室温下在500 MHz (1H ) 和 125 MHz (13C ) 下用Φ5 mm 反相探头 ( BBI ) 进行测定. COSY、HSQC和HMBC都是Z梯度脉冲实验,HSQC、HMBC谱按1J=140 Hz,nJ=8 Hz 确定相关参数,其谱宽分别为4 006.4 Hz×25 153.4 Hz 和4 006.4 Hz×25 153.4 Hz ,采样数据点阵分别为: 1 024×256和1 024×256;COSY谱谱宽6 009.7 Hz×6 009.7 Hz,采样点数为1 024×256 Hz ;ROESY的测试谱宽为均为3 753.75 Hz,延迟时间2.0 s,ROESY混合时间为0.2 s,时间域矩阵均充零至1 024×1 024进行FT变换.
1.4其他数据
白色透明针状晶体(丙酮),mp. 110~110.9 ℃;254 nm紫外灯下有紫红色荧光,易溶于氯仿、丙酮,盐酸镁粉反应显橘红色,由上述现象初步判断该化合物为黄酮类化合物.
2结果与讨论
2.1ID NMR谱分析
从化合物5, 6, 7, 8四甲氧基黄酮的H NMR谱中,通过化学位移、峰型与积分面积,我们可推测: δ 795 (2H, m) 和δ 7.54 (3H, m) 处的信号,表明在苯环区有5个质子信号,提示可能有单取代苯环结构存在,由于它们化学环境相近,需要HSQC和HMBC来进一步指认,暂定为B环上H2′、H3′、H4′、H5′、H6′;δ 6.70 (1H, s) 可能是黄酮C环上H3的信号;δ 4.12 (3H, s)、4.04 (3H, s) 和3.97~3.96 (6H, s) 暗示存在4个与苯环相连的OCH3信号,它们的化学环境相似,需要ROESY和HMBC来进一步确认.
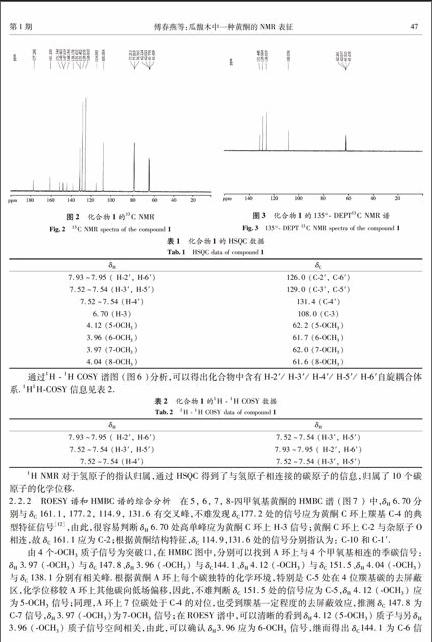
结合13C NMR谱(图2)的化学位移与DEPT谱(图3),可以确定化合物有6个不饱和的CH 信号峰 (δ108.0, 126.0, 129.0, 131.4, 129.0, 126.0),1个CO(δ 172.2 ),8个季碳峰 (δ161.1, 147.8, 1441, 151.5, 138.1, 148.4, 114.9, 131.6 ),4个甲基峰 (δ 62.2, 62.0, 61.7, 61.6 ),具体的归属需通过HSQC和HMBC进一步确定.
2.22D NMR谱分析
2.2.1HSQC谱与1H 1H COSY的综合分析化合物5, 6, 7, 8四甲氧基黄酮的HSQC关系 (图5 ) 给出的信息如表1所示.
1H NMR对于氢原子的指认归属,通过HSQC得到了与氢原子相连接的碳原子的信息,归属了10个碳原子的化学位移.
2.2.2ROESY谱和HMBC谱的综合分析在5, 6, 7, 8四甲氧基黄酮的HMBC谱 (图7 ) 中,δH 6.70分别与δC 161.1, 177.2, 114.9, 131.6 有交叉峰,不难发现δC 177.2处的信号应为黄酮C环上羰基C4的典型特征信号[12],由此,很容易判断δH 6.70处高单峰应为黄酮C环上H3信号;黄酮C环上C2与杂原子O相连,故δC 161.1应为C2;根据黄酮结构特征,δC 114.9,131.6处的信号分别指认为: C10和C1′.
由4个OCH3质子信号为突破口,在HMBC图中,分别可以找到A环上与4个甲氧基相连的季碳信号: δH 397 (OCH3) 与δC 147.8、δH 3.96 (OCH3) 与δC 144.1、δH 4.12 (OCH3) 与δC 151.5、δH 4.04 (OCH3) 与δC 138.1分别有相关峰.根据黄酮A环上每个碳独特的化学环境,特别是C5处在4位羰基碳的去屏蔽区,化学位移较A环上其他碳向低场偏移,因此,不难判断δC 151.5处的信号应为C5,δH 4.12 (OCH3) 应为5OCH3信号;同理,A环上7位碳处于C4的对位,也受到羰基一定程度的去屏蔽效应,推测δC 147.8为C7信号,δH 397 (OCH3)为7OCH3信号;在ROESY谱中,可以清晰的看到δH 4.12 (5OCH3) 质子与另δH 3.96 (OCH3) 质子信号空间相关,由此,可以确认δH 3.96应为6OCH3信号,继而得出δC 144.1为C6信号;在ROESY谱中,还能看到δH 3.96 (6OCH3) 与δH 397 (OCH3) 空间相关,从而进一步确认了δH 397 为7OCH3信号;通过ROESY进一步分析,剩余的一个OCH3质子与7OCH3质子空间相关,故δH 4.04 (8OCH3)指认为8OCH3信号. 至此,完成了对A环上4个OCH3以及与之相连的季碳NMR信号的全归属.由此可知,文献[11]报道的:δC 151.5为C7信号、δC 147.8为C5信号、δC 62.0为6OCH3信号、δC 61.7为7OCH3信号、δH 3.93为5OCH3信号、δH 4.09为7OCH3信号,此几处归属有误.
B环上共有5个芳香质子信号,由于化学环境十分类似,其中,H2′与H6′化学等价,H3′与H5′化学等价,由于H2′与H6′受到C环的去屏蔽效应较大,和H3′,H4′与H5′相比处在较低场,故在一维 H NMR图谱上呈现两组峰. 根据以上分析,在HMBC谱中,以H2′与H6′为突破口,化学等价的H2′与H6′峰组与δC 161.1 (C2),131.6,129.0处的信号相关,故不难得出δC131.6处的信号应归属为季碳C1′,δC 129.0归属为化学等价的C5′,3′;最后C4′只能是131.4.化合物1主要HMBC相关关系见图4.
由以上分析可知:文献[2]报道的δC 151.5为C7信号、δC 147.8为C5信号、δC 62.0为6OCH3信号、δC 61.7为7OCH3信号、δH 3.93为5OCH3信号、δH 4.09为7OCH3信号,此几处归属有误.
3结论
应用多种核磁共振技术对首次从瓜馥木属中分离得到的5, 6, 7, 8四甲氧基黄酮的 1H和13C NMR信号进行了全归属,特别是应用ROESY空间相关谱和HMBC等平面相关谱相结合的分析方法,对有机物结构鉴定起着重要的作用.
参考文献:
[1]HWANG T L, LI G L, LAN Y H, et al. Potent inhibition of superoxide anion production in activated human neutrophils by isopedicin, a bioactive component of the Chinese medicinal herb Fissistigma oldhamii[J]. Free Radical Biol Med, 2009,46(4):520528.
[2]江苏新医学院. 中药大辞典[M]. 上海:上海人民出版社, 1977.
[3]庞声航, 余胜民, 黄琳芸, 等. 广西20 种传统瑶药抗肿瘤筛选研究[J]. 广西中医药, 2006,29(4):5357.
[4]傅春燕, 刘永辉, 陈代武, 等. 紫外分光光度计法测定不同产地瓜馥木中黄酮含量[J]. 安徽农业科学, 2010,38(33):1874418746.
[5]钟瑞建, 李海燕, 官启嘉, 等. RPHPLC 法测定钻山风糖浆中瓜馥木碱甲的含量[J]. 药物分析杂志, 2011,31(9):17941796.
[6]HU X D, YANG Y, ZHONG X G, et al. Antiinflammatory effects of Z23 on LPSinduced inflammatory responses in RAW2647 macrophages[J]. J Ethnopharm, 2008,120(3):447451.
[7]傅春燕. 瓜馥木化学成分研究及抑菌活性初探[D].桂林: 广西师范大学, 2007.
[8]ZHANG Y N, ZHONG X G, ZHENG Z P, et al. Discovery and synthesis of new immunosuppressive alkaloids from the stem of Fissistigma oldhamii (Hemsl.) Merr.[J]. Bioorg Med Chem, 2007,15(2):988996.
[9]李叶, 尹文清, 冯华芬, 等. 瓜馥木总黄酮提取工艺研究[J]. 粮油食品科技, 2011,19(1):5658.
[10]巫志峰, 冯星, 周畅, 等. 黄酮类化合物对心肌缺血的保护作用及其构效关系研究[J]. 湖南师范大学学报:医学版, 2006,3(4):2628.
[11]FRANCISCO A, TOMASBARBERAN J D, KURT H. Antifungal epicuticular methylated flavonoids from heliehrysum nitens[J]. Phytoehemistry, 1988,27(3):753755.
[12]匡学海. 中药化学[M]. 北京: 中国中医药出版社, 2003.
(编辑杨春明)
