奥沙利铂联合胸腺肽治疗肺癌恶性胸腔积液临床疗效分析
2015-04-04梁锡堂马国平高雪平
梁锡堂 马国平 高雪平
肺癌是常见的恶性肿瘤,发病率高及病死率占恶性肿瘤的第一位[1],晚期肺癌浸润或转移至胸膜导致患者出现恶性胸腔积液,由于胸腔积液增长至中量或大量时常压迫周围肺组织及心脏,使患者出现胸闷、呼吸困难等症状,导致生存质量下降,生存期明显缩短,全身状况急剧恶化。由于患者此时体质虚弱及免疫功能低,单纯给予化疗药物胸腔灌注治疗常使免疫功能抑制更加明显。本研究采用中心静脉导管闭式引流给予奥沙利铂及胸腺肽胸腔灌注治疗肺癌恶性胸腔积液,报告如下。
1 资料与方法
1.1 一般资料 2012年1月至2014年12月我院收治肺癌伴恶性胸腔积液患者48例,均由病理组织学、细胞学确诊为原发性肺癌恶性胸腔积液。男29例,女19例;年龄35~66岁,平均年龄(49±12)岁;腺癌15例,鳞癌20例,大细胞肺癌7例,小细胞肺癌6例。经过B超探查证实为中等量以上的胸腔积液,其中中量26例,大量22例;KPS评分≥60分均可耐受化疗。患者血常规、肝肾功能、心电图等检查结果均正常,预计生存期>3个月,1个月内未进行任何放化疗治疗。随机将患者分为2组,每组24例。治疗组给予奥沙利铂联合胸腺肽胸腔给药治疗,对照组仅给予胸腔给予奥沙利铂治疗。2组性别比、年龄、组织病理类型及胸腔积液量比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 所有患者均在B超引导下置中心静脉导管引流胸腔积液,待B超证实胸腔积液已引流干净后即可胸腔内用药。所有患者治疗前1 d,每晚口服开瑞坦10 mg,连服1周,胸腔灌注用药前30 min,给予盐酸异丙嗪25 mg肌内注射以预防过敏,并给予甲氧氯普胺20 mg肌内注射预防胃肠道反应。以地塞米松10 mg和2%利多卡因10 ml用0.9%氯化钠溶液10 ml稀释后经引流导管注入胸腔以减轻和预防胸痛和发热等胸膜反应症状。治疗组给予奥沙利铂100 mg/m2及胸腺肽300 mg由引流管注入胸腔,对照组给予奥沙利铂100 mg/m2稀释后经引流管注入胸腔,注药完毕后使用肝素帽将导管封闭,并嘱患者去枕平卧,15 min左右转动体位90°共翻身3圈以利于药物与胸膜充分接触反应,用药48 h后引流完胸腔积液,1周后重复应用,治疗4周后复查胸片及B超。
1.3 评价标准 采用B超检测,胸腔积液疗效按WHO标准评价:完全缓解(CR):胸腔积液消失并至少维持4周以上;部分缓解(PR):胸腔积液量减少50%以上并维持4周以上;稳定(SD):胸腔积液量减少不足50%或增加不超过25%;进展(PD):胸腔积液量明显增加。CR+PR为有效率(RR)。生活质量参照KPS评分变化评价,以治疗后KPS≥10分为生活质量改善,变化 KPS<10分为生活质量稳定,减少 KPS≥10分为生活质量降低。不良反应则按照WHO抗癌药物急性亚急性分级标准分Ⅰ~Ⅳ度。
1.4 标本采集及检测方法 所有患者于晨起空腹采集肘静脉血4 ml注入一次性玻璃管内,在B超定位引导下行胸腔穿刺各抽取胸腔积液5 ml,分别静置1 h左右后,所有样本以3 000 r/min离心处理10 min分离血清,取上清液,置于-20℃冰箱待测,血液及胸腔积液标本均于同1天采集。用流式细胞仪法测定外周血中T淋巴细胞亚群 CD3+、CD4+、CD8+水平,采用酶联免疫吸附法(ELISA)检测胸腔积液中白细胞介素(IL-6)、肿瘤坏死因子 α(TNF-α);流式细胞仪(美国BECKMAN COULTER公司产品),试剂由厂家配套提供。IL-6、TNF-α试剂盒购自美国R&D公司,按照试剂盒说明步骤进行操作。血常规、肝肾功能由检验科室进行检测。
1.5 统计学分析 应用SPSS 13.0统计软件,计量资料以表示,采用t检验,计数资料采应用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者疗效比较 治疗组患者有效率为87.5%,对照组有效率为66.7%,差异无统计学意义(P>0.05)。见表1。

表1 2组患者疗效比较 n=24,例(%)
2.2 2组患者生活质量情况比较 与对照组比较,治疗组患者治疗后生活质量评分明显改善,差异有统计学意义(P<0.05)。见表2。
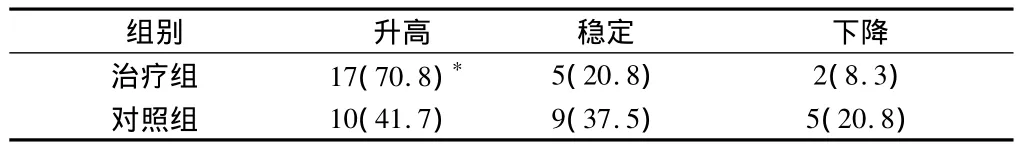
表2 2组患者治疗后KPS评分比较 n=24,例(%)
2.3 2组患者免疫功能比较 2组患者治疗前细胞免疫功能的各项指标差异均无统计学意义(P均>0.05),治疗后,治疗组患者 CD3+,CD4+,CD4+/CD8+水平较治疗前均有明显上升(P均<0.05),而对照组CD3+,CD4+,CD4+/CD8+水平较治疗前差异无统计学意义(P均>0.05),且治疗组治疗后较对照组明显改善(P均<0.05)。见表3。
表3 2组患者免疫功能比较n=24,±s
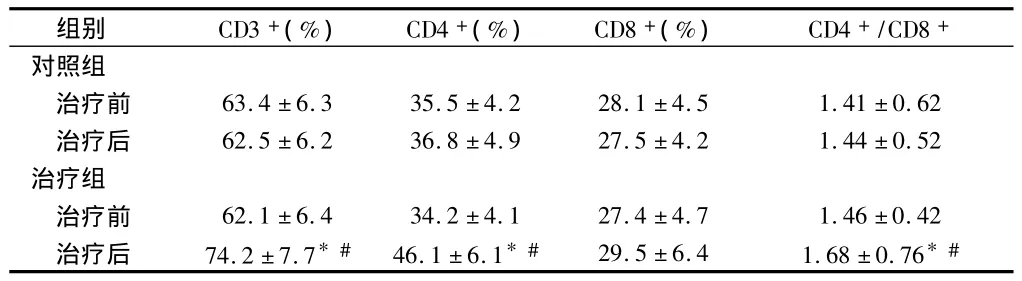
表3 2组患者免疫功能比较n=24,±s
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+对照组治疗前 63.4±6.3 35.5±4.2 28.1±4.5 1.41±0.62治疗后 62.5±6.2 36.8±4.9 27.5±4.2 1.44±0.52治疗组治疗前 62.1±6.4 34.2±4.1 27.4±4.7 1.46±0.42治疗后 74.2±7.7*# 46.1±6.1*# 29.5±6.4 1.68±0.76*#
2.4 2组患者胸腔积液中IL-6、TNF-α水平比较 2组患者治疗后胸腔积液中IL-6、TNF-α水平与治疗前比较均有明显下降(P<0.05),且治疗组患者治疗后IL-6、TNF-α水平较对照组明显下降(P<0.05)。见表4。
表4 2组患者胸腔积液中IL-6、TNF-α水平比较n=24,ng/L,±s
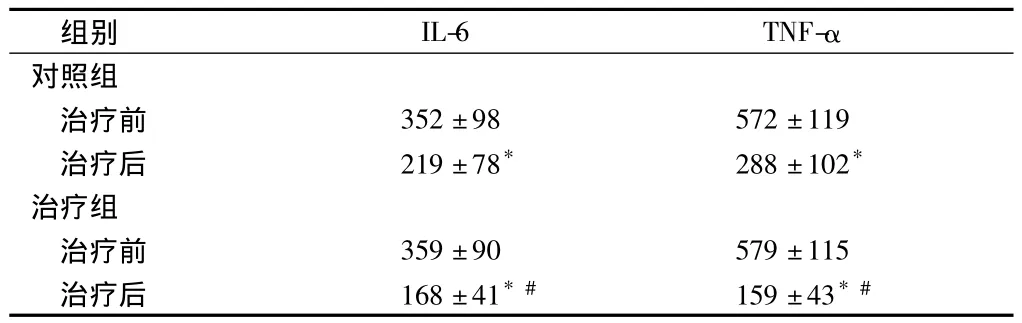
表4 2组患者胸腔积液中IL-6、TNF-α水平比较n=24,ng/L,±s
注:与治疗前比较,*P <0.05;与对照组比较,#P <0.05
组别 IL-6 TNF-α对照组治疗前 352±98 572±119治疗后 219±78* 288±102*治疗组治疗前 359±90 579±115治疗后 168±41*# 159±43*#
2.5 2组不良反应比较 2组均有部分患者出现恶心呕吐、骨髓抑制等不良反应,治疗组中出现消化系统反应2例,出现骨髓抑制1例;对照组中出现消化系统反应8例,出现骨髓抑制6例,2组比较差异有统计学意义(均P<0.05),不良反应均为Ⅰ~Ⅱ度,给予对症处理后全部好转。
3 讨论
肺癌恶性胸腔积液是晚期肺癌的重要并发症,产生机制[2,3]主要包括:原发灶或肿大的淋巴结压迫淋巴管,或癌细胞扩散阻塞淋巴道,使其回流受阻;癌细胞阻塞毛细血管,是其毛细血管压增高导致渗出增加;肺癌侵袭胸膜,大量的癌细胞分泌的递质促使毛细血管通透性增加及再生;癌瘤体表血管自身也分泌液体等。胸腔积液量多时导致患者呼吸困难、胸闷等压迫症状,而单纯的胸腔积液引流只能临时缓解症状,反复抽液不仅增加患者的痛苦而且可导致蛋白质大量丢失、肿瘤种植转移、感染等并发症,因此恶性胸腔积液治疗对减少胸腔积液改善症状以及提高生存质量都是十分重要的,胸腔内药物注入可以增加药物有效浓度并直接杀伤癌细胞,使阻塞的毛细血管、淋巴管再通,促进胸腔积液吸收提高疗效[4]。
奥沙利铂作为第3代铂类化疗药物,是新一代铂类衍生物,是公认的治疗晚期肿瘤最有效的单药之一[5],药理机制主要是通过代谢产物与DNA交联,损伤DNA、抑制DNA和RNA合成,诱导肿瘤细胞的凋亡,触发机体的免疫学反应来发挥细胞毒性作用和抗肿瘤活性[6]。Mir等[7]研究显示,奥沙利铂治疗Ⅳ期非鳞状非小细胞肺癌的有效率为55.3%,且具有良好的耐受性,Belvedere等[8]研究结果显示,多西他赛联合奥沙利铂治疗非小细胞肺癌的治疗效果优于单药多西他赛,并可延长患者的中位生存期。肿瘤的发生与机体的免疫功能状况密切相关,当机体免疫功能下降、免疫监视和免疫清除能力降低时,就会出现肿瘤细胞逃逸,就可能形成肿瘤。而抗肿瘤免疫中细胞免疫发挥关键作用,在肿瘤免疫中T淋巴细胞起着中心调控作用。胸腺肽是由胸腺组织上皮细胞分泌的多肽激素,有效组分主要包括:胸腺素α1、胸腺生成素、胸腺体液因子、血清胸腺因子等,可促进T细胞的成熟,同时参与免疫系统和神经内分泌系统的交互作用,激活细胞免疫。顾爱琴等[9]研究显示,胸腺肽联合化疗治疗晚期非小细胞肺癌后,CD4+和NK细胞活性较化疗前明显提高且高于对照组化疗后水平,其可提高患者的免疫功能,改善生存质量。本研究显示,奥沙利铂联合胸腺肽胸腔灌注治疗肺癌恶性胸腔积液有效率可达87.5%。且经过治疗后,治疗组患者 CD3+,CD4+,CD4+/CD8+水平较治疗前均有明显提高,多数患者乏力情况改善,精神好转,体重下降症状有明显改善,KPS评分明显提高。
炎性因子可以改变细胞的生存微环境,促进细胞增殖,诱导细胞的致癌或抑癌基因的突变,其与多种肿瘤启动和增殖有关[10,11]。TNF-α、IL-6 细胞因子是免疫调控因子及前炎性因子,参与细胞免疫反应、调控功能及炎性反应。TNF-α可以刺激多种血管生成因子受体表达,肿瘤内皮细胞生长,并诱导VE-cad的酪氨酸磷酸化促进细胞间隙形成,从而导致单层内皮细胞的通透性[12]。王艳等[13]研究显示,肺癌患者胸腔积液及血液中TNF-α水平明显高于肺结核患者胸腔积液,胡云良等[14]研究显示,胸腔恶性渗出液组IL-6、CRP值水平明显高于漏出液组。本研究结果显示,奥沙利铂联合胸腺肽胸腔灌注治疗肺癌恶性胸腔积液后,胸腔积液中IL-6、TNF-α水平较治疗前降低,且低于对照组化疗后水平,表明这两种药物联合应用可以抑制炎性因子、减轻炎性反应,减轻疼痛。
综上所述,奥沙利铂联合胸腺肽胸腔灌注治疗肺癌恶性胸腔积液具有协同抗肿瘤作用,控制胸水增长具有良好的效果,提高患者细胞免疫功能,抑制炎性因子、减轻炎性反应,改善患者的生存质量,且患者的不良反应发生率低。
1 Siegel R,Naishadham D,Jemal A.Cancer statistics,2012.CA Cancer J Clin,2012,62:10-29.
2 Stathopoulos GT,Kalomenidis I.Animal models of malignant pleural effusion.Curr Opin Pulm Med,2009,15:343-352.
3 Nam HS.malignant pleural effusion:medical approaches for diagnosis and management.Tuberc Respir Dis(Seoul),2014,76:211-217.
4 Marulli G,Rea F,Nicotra S,et al.Effect of induction chemotherapy on lung function and exercise capacity in patients affected by malignant pleural mesothelioma.Eur J Cardiothorac Surg,2010,37:1464-1469.
5 Cunningham D,Okines AF,Ashley S.Capecitabine and oxaliplatin for advanced esophagogastric cancer.N Engl J Med,2010,362:858-859.
6 Tesniere A,Schlemmer F,Boige V,et al.Immunogenic death of colon cancer cells treated with oxaliplatin.Oncogene,2010,29:482-491.
7 Mir O,Boudou-Rouquette P,Giroux J,et al.pemetrexed,oxaliplatin and bevacizumab as first-line treatment in patients with stageivnon-small cell lung cancer.Lung Cancer,2012,77:104-109.
8 Belvedere O,Follador A,Rossetto C,et al.A randomised phase ii study of docetaxel/oxaliplatin and docetaxel in patients withpreviously treated non-small cell lung cancer:an alpe-adria thoracic oncologymultidisciplinary group trial.Eur J Cancer,2011,47:1653-1659.
9 顾爱琴,熊丽纹,忻宇,等.胸腺肽在晚期非小细胞肺癌化疗中的作用.中国癌症杂志,2007,17:493-495.
10 Bromberg J,Wang TC.Inflammation and cancer:IL-6 and STAT3 Complete the Link.Cancer Cell 2009,15:79-80.
11 Lu CC,Kuo HC,Wang FS,et al.Upregulation of TLRs and IL-6 as a Marker in Human Colorectal Cancer.Int J Mol Sci,2014,24:159-177.
12 Keibel A,Singh V,Mahesh C,et al.Inflammation,microenvironment,and the immune system in cancer progression.Current Pharmaceutical Design,2009,15:1949-1955.
13 王艳,陈璐.LEP、TNF-α、CEA、CRP和IL-6在结核病与恶性肿瘤中的鉴别诊断价值.中国实验诊断学,2014,18:1993-1995.
14 胡云良,李杰,林洁,等.白细胞介素6与C反应蛋白联合检测在胸腔积液诊断中的价值.中华结核和呼吸杂志,2004,27:267-268.
