FeTCPP/Ti0.7W0.3O2复合材料的制备及其H2O2传感器应用*
2015-04-01郑龙珍陈计芳邵爱龙亢晓卫王益民
郑龙珍,陈计芳,邵爱龙,亢晓卫,王益民
(华东交通大学 理学院,江西 南昌330013)
0 引 言
过氧化氢(H2O2)是生物体新陈代谢的副产物,在生物体中可氧化损伤大分子[1~3],在食品、药物、临床、工业及环境分析中也是重要的中间体。因此,对H2O2实现简单、灵敏、有效的实时监测具有非常重要的意义[4,5]。目前,检测H2O2的方法中基于酶的电流型传感器具有简单和高选择性等特点[6],然而,酶生物传感器的性能受各种不同的环境因素和酶的固定过程等的影响[7,8]使酶传感器的应用受到了一定的限制,于是,人们开始考虑使用模拟酶来代替生物酶[9],以降低因生物酶的不稳定性对电极造成的不良影响,实现对H2O2的高效、灵敏检测。
无机纳米材料作为一种模拟酶,表面有大量的催化位点和活性基可进一步功能化等独特的性质[10~13]。金红石型二氧化钛(TiO2)是一种化学性质稳定的半导体,其禁带宽度为3.0~3.5eV[14],满足作为催化剂载体的要求。可以通过阳离子替换或引入氧空穴等方法提高TiO2导电性。WO2具有变形的金红石型结构[15],当把WO2掺杂到红石型TiO2中得到一种同时具有金红石型TiO2的稳定性和WO2的导电性的新材料(金红石Ti1-xWxO2)[16]。金属卟啉作为许多重要酶的模拟物[17~19]被用作电子媒介体对生命过程中许多小分子具有很好的电催化氧化还原性能[20]。
本文合成了金红石相掺钨二氧化钛(Ti0.7W0.3O2)催化剂并将其与铁卟啉(FeTCPP)分子复合并组装到电极表面,制备了铁卟啉FeTCPP/Ti0.7W0.3O2/GCE 修饰电极,该电极对H2O2具有很高的电催化活性、较高的灵敏度和较宽的线性范围,为构建无酶仿生传感器提供了平台。
1 实 验
1.1 复合材料的制备
采用溶胶凝胶法制备Ti0.7W0.3O2。用一定浓度四羧基苯基卟啉(TCPP)和FeCl3·6H2O 反应形成Fe TCPP 配合物。将一定浓度Ti0.7W0.3O2与Fe TCPP 按一定比例超声复合,8 000 rpm 下离心未复合的Fe TCPP 即得FeTCPP/Ti0.7W0.3O2。
1.2 修饰电极的制备
玻碳电极在使用前先经1.0,0.3 μm Al2O3抛光,洗涤。吸取5 μL FeTCPP/Ti0.7W0.3O2分散液滴于GCE 表面,4 ℃下自然干燥,使在电极表面形成均匀的复合物薄膜,即得所制备的生物传感器。
2 结果与讨论
2.1 紫外可见表征
TCPP(a),FeTCPP(b),Ti0.7W0.3O2(c)和FeTCPP/Ti0.7W0.3O2(d)的紫外可见吸收光谱如图1。TCPP(a)在419 nm 处有一个强的吸收峰(Sort 带)和500~700 nm 处4 个中强吸收峰(Q 带)。FeTCPP(b)分子的对称性提高,在419 nm 处强 Sort 带吸收峰蓝移至 416 nm。Ti0.7W0.3O2(c)在200~700 nm 范围内无明显特征吸收峰。FeTCPP/Ti0.7W0.3O2(d)在406 nm 处有明显的吸收峰,可能是由于FeTCPP 与Ti0.7W0.3O2之间的相互作用使得Sort 带吸收峰相对于纯的FeTCPP 出现蓝移,表明FeTCPP 已复合在金红石相Ti0.7W0.3O2上,Ti0.7W0.3O2可作为一个很好的载体用于固定FeTCPP 分子。
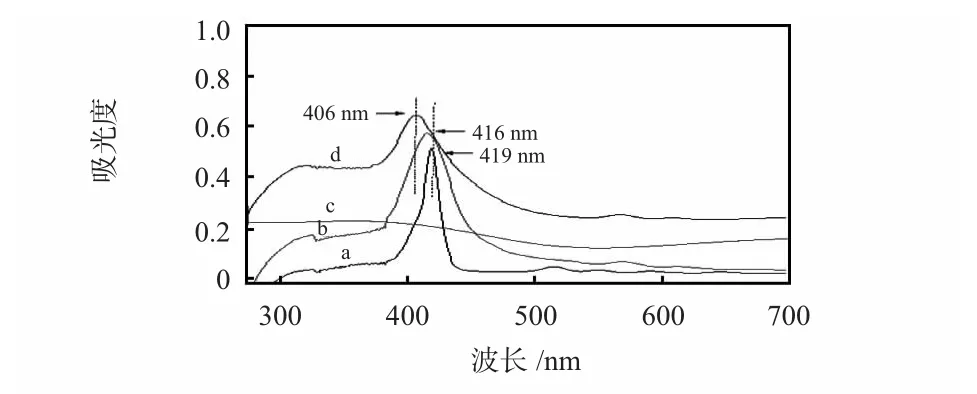
图1 紫外可见吸收光谱Fig 1 UV-Vis absorption spectra
2.2 修饰电极的电化学性质
2.2.1 修饰电极的电化学阻抗表征
不同修饰电极的电子传递性质通过电化学阻抗表征。图2 为GCE 和不同材料修饰电极的在含5.0 mmol/L Fe(CN)6
3-/Fe(CN)64-的0.1 mol/L KCl 溶液中的电化学阻抗图,从图中可以看出:GCE(a)呈现一个很小的半圆,其阻抗值为70 Ω,Ti0.7W0.3O2/GCE(c)阻抗 值为220 Ω,FeTCPP/GCE(b)阻抗值为2 239 Ω,FeTCPP/Ti0.7W0.3O2/GCE(d)阻抗值显著减小为815 Ω,表明该复合材料具有良好的导电性,能提高电子的传递速率。

图2 不同修饰电极的电化学阻抗图Fig 2 EIS spectra of different modified electrode
2.2.2 修饰电极的CV 响应
图3 为GCE,FeTCPP/GCE,FeTCPP/Ti0.7W0.3O2/GCE分别在含0.05 μmol/LH2O2(b,d,f)和不含H2O2(a,c,e)的PBS(0.1 mol/L pH=7.0)中的CV 图。从图中可以看出:在GCE 上未出现催化H2O2还原的阴极峰。FeTCPP 和FeTCPP/Ti0.7W0.3O2催化H2O2还原的电位分别为-0.29 V和-0.182,阴极峰电流为2.8 μA 和3.3 μA,电位正移了108 mV,峰电流为前者的1.21 倍。表明Ti0.7W0.3O2可增强FeTCPP 电催化H2O2还原活性。
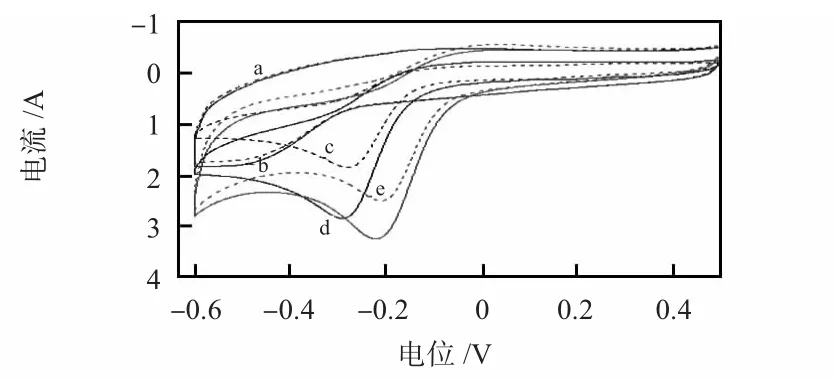
图3 不同修饰电极的CV(扫速为50 mV/s)Fig 3 Cyclic voltammograms(CV)of different modified electrode(scan rate:50 mV/s)
2.2.3 扫描速度与pH 值的影响
图4 为FeTCPP/Ti0.7W0.3O2/GCE 在 除O2的PBS(0.1 mol/L pH=7.0)中扫描速度为20~500 mV/s 下的CV图。从图中可以看出:FeTCPP/Ti0.7W0.3O2修饰电极的还原峰电流随着扫速的增大而增大,并与扫速成良好的线性关系,线性方程为Ipc=0.803+0.018V,R=0.998 表明该复合物修饰电极的电化学是一个表面控制的过程。
图5 为FeTCPP/Ti0.7W0.3O2/GCE 在除O2的不同pH的PBS(0.1 mol/L)中的循环伏安图。随着溶液pH 值的增加,H2O2的氧化还原峰负移,Epc与溶液pH 值之间呈良好的线性关系,线性方程的斜率为-29.58 mV·pH-1,表明FeTCPP/Ti0.7W0.3O2/GCE 上是一电子一质子的过程。
2.3 传感器对过氧化氢的计时电流检测
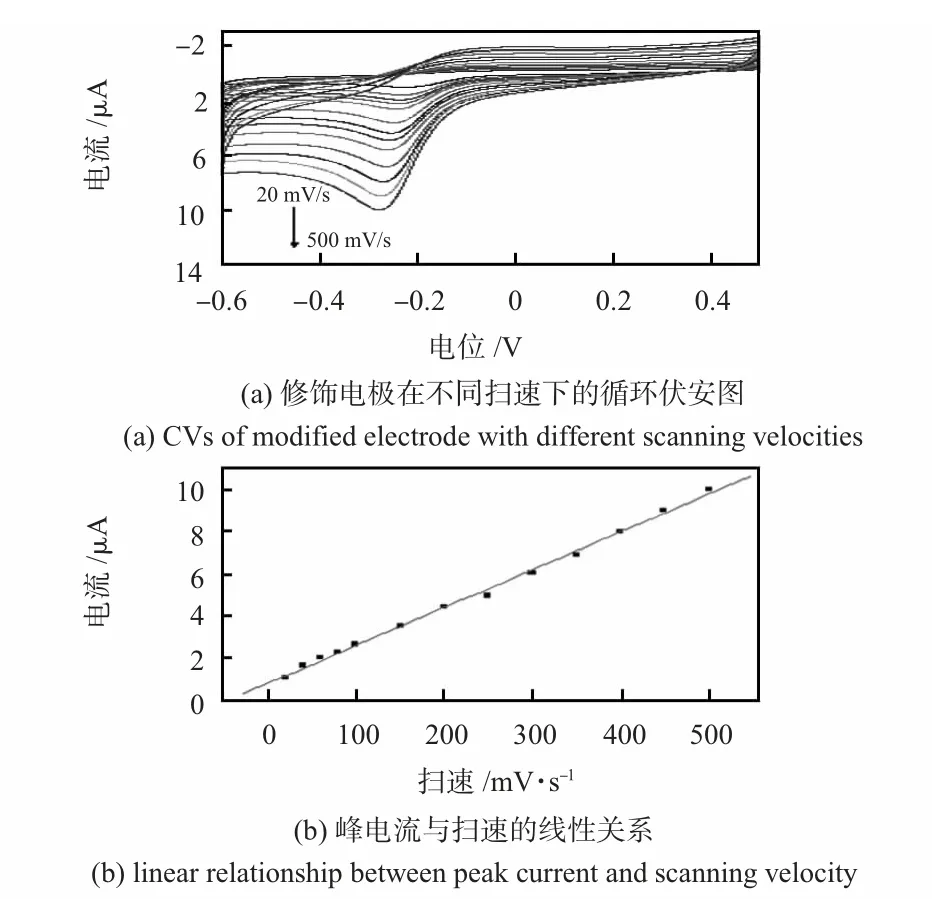
图4 复合物电极的扫速特性Fig 4 Velocity scanning characteristics of compound electrode

图5 复合物电极不同pH 的电位特性Fig 5 Potential characteristics of different pH value of compound electrode
采用计时电流法对H2O2检测。在恒电位-0.2 V 条件下,向通N2除O2的PBS(pH=7.0)中连续加入0.05 μmol/L H2O2时,得到稳定的安培响应。如图6 所示,随着H2O2的累计增加,本底电流发生变化,在2 s 内可达到最小电流的95%,表明修饰电极对H2O2浓度的快速响应变化。H2O2在4.998×10-7~1.194×10-5mol/L 范围内与电流呈良好的线性关系,线性方程为I=0.253+0.252C(R=0.997),检出限为1.105×10-8mol/L(S/N=3)。
2.4 传感器的抗干扰性能
在N2氛围下的PBS 溶液(0.1 mol/L,pH=7.0)中,加入干扰物质研究传感器的抗干扰能力。如图7 所示在300,450,500,750 s 时分别加入10 μmol/L 的抗坏血酸,L—半胱氨酸,尿酸,多巴胺后响应电流很小。说明其对H2O2的测量基本无影响,该修饰电极的抗干扰性能良好。
2.5 样品检测

图6 传感器的计时电流特性Fig 6 Chronoamperometry characteristics of sensor

图7 修饰电极对干扰物质和不同浓度H2O2 的电流响应Fig 7 Amperometric response of modified electrode to interfering materials and different concentration H2O2
为了研究传感器的实际应用性,表1 为在通N2除O2的10 μmol H2O2模拟污水中加入10 倍浓度的尿酸、多巴胺、抗坏血酸、L—半胱氨酸等有机污染物并进行加标回收实验,回收率为99%~102%,表明构建的传感器可用于实际样品检测,测定结果准确、可靠性高。
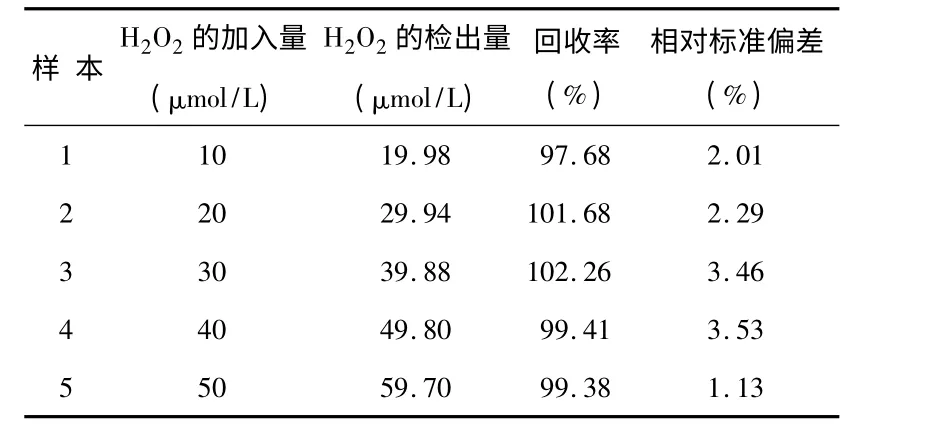
表1 修饰电极对模拟工业污水样品的分析结果Tab 1 Analysis result of modified electrode on simulated industry wastewater samples
3 结 论
本文通过静电吸附的方式制备了具有仿生功能的FeTCPP/Ti0.7W0.3O2复合材料,采用紫外可见吸收光谱对复合材料进行了表征。将复合材料修饰于玻碳电极上构建了无酶仿生传感器并将其用于H2O2的检测,修饰电极对H2O2有良好的电催化还原效果,该修饰电极的稳定性、重现性抗干扰性能良好,为构建无酶仿生传感器提供了平台。
[1] Giorgio M,Trinei M,Migliaccio E,et al.Hydrogen peroxide:A metabolic by-product or a common mediator of ageing signals[J].Nat Rev Mol Cell Biol,2007,8(9):722-728.
[2] Mu J S,Zhang L,Zhao M,et al.Catalase mimic property of Co3O4nanomaterials with different morphology and its application as a calcium sensor[J].Appl Mater,2014,6(10):7090-7098.
[3] Mroz P,Bhaumik J,Dogutan D K,et al.Imidazole metalloporphyrins as photosensitizers for photodynamic therapy:Role of molecular charge,central metal and hydroxyl radical production[J].Cancer Lett,2009,282(1):63-76.
[4] Wang J.Electrochemical glucose biosensors[J].Chem Rev,2008,108(2):814-825.
[5] Wang Q,Li M S,Szunerits S,et al.Environmentally friendly reduction of graphene oxide using tyrosine for nonenzymatic amperometric H2O2detection[J].Electroanal,2014,26(1):156-163.
[6] Privett B J,Shin J H,Schoenfisch M H.Electrochemical sensors[J].Anal Chem,2010,82(12):4723-4741.
[7] Mu Y,Jia D L,He Y Y,et al.Nano nickel oxide modified nonenzymatic glucose sensors with enhanced sensitivity through an electrochemical process strategy at high potential[J].Biosens Bioelectron,2011,26(6):2948-2952.
[8] Wu H,Fan S H,Jin X Y,et al.Construction of a zinc porphyrinfullerene-derivative based nonenzymatic electrochemical sensor for sensitive sensing of hydrogen peroxide and nitrite[J].Anal Chem,2014,86(13):6285-6290.
[9] Mano N,Mao F,Heller A.A miniature biofuel cell operating in a physiological buffer[J].J Am Chem Soc,2002,124(44):12962-12963.
[10]Gao L,Zhuang J,Nie L,et al.Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J].Nat Nanotechnol,2007,2(9):577-583.
[11]Mu J S,Wang Y,Zhao M,et al.Intrinsic peroxidase-like activity and catalase-like activity of Co3O4nanoparticles[J].Chem Commun,2012,48(19):2540-2542.
[12]Dutta A K,Maji S K,Srivastava D N,et al.Synthesis of FeS and FeSe nanoparticles from a single source precursor:A study of their photocatalytic activity,peroxidase-like behavior,and electrochemical sensing of H2O2[J].Appl Mater Interfaces,2012,4(4):1919-1927.
[13]Asati A,Santra S,Kaittanis C,et al.Oxidase-like activity of polymer-coated cerium oxide nanoparticles[J].Angew Chem Int Ed,2009,48(13):2308-2312.
[14]Mikami M,Nakamura S,Kitao O,et al.First-principles study of titanium dioxide:Rutile and rnatase[J].Appl Phys,2000,39(8):847-850.
[15]Palmer D J,Dickens P G,Tungsten dioxide:Structure refinement by powder neutron diffraction[J].Acta Cryst,1979,35(9):2199-2201.
[16]Chinmayee V Subban,Zhou Q,Anthony H,et al.Sol-Gel synthesis,electrochemical characterization,and stability testing of Ti0.7W0.3O2nanoparticles for catalyst support applications in proton-exchange membrane fuel cells[J].J Am Chem Soc,2010,132(49):17531-17536.
[17]Takai A,Barbe J M,Guilard R,et al.Enhanced electron-transfer properties of cofacial porphyrin dimers through π-π Interactions[J].Chem Eur,2009,15(13):3110-3122.
[18]Sgobba V,Giancane G,Conoci S,et al.Growth and characterization of films containing fullerenes and water soluble porphyrins for solar energy conversion applications[J].J Am Chem Soc,2007,129(11):3148-3156.
[19]Calvete M,Yang G Y,Hanack M.Porphyrins and phthalocyanines as materials for optical limiting[J].Synth Met,2004,141(3):231-243.
[20]George R C,Mugadza T,Khene S,et al.Porphyrin nanorods modified glassy carbon electrode for the electrocatalysis of dioxygen,methanol and hydrazine[J].Electroanal,2011,23(7):1699-1708.
