化疗减毒汤对环磷酰胺致骨髓抑制小鼠的保护机制研究
2015-03-29李世杰王颖飞侯晓利叶震中曹红春
唐 振,李世杰,王颖飞,夏 凯,侯晓利,张 聪,叶震中,曹红春
·中医·中西医结合研究·
化疗减毒汤对环磷酰胺致骨髓抑制小鼠的保护机制研究
唐 振,李世杰,王颖飞,夏 凯,侯晓利,张 聪,叶震中,曹红春
目的 观察化疗减毒汤对环磷酰胺致骨髓抑制小鼠的保护作用,并探讨其机制。方法 2013年9月2—21日,利用SPSS统计软件采用随机数字表法将60只小鼠随机分为6组,即对照组、模型组、重组人粒细胞集落刺激因子(G-CSF)组、化疗减毒汤低剂量组(10 g原生药/kg)、化疗减毒汤中剂量组(20 g原生药/kg)及化疗减毒汤高剂量组(30 g原生药/kg),每组10只。对照组给予低蛋白饲料;模型组给予低蛋白饲料并腹腔注射环磷酰胺;G-CSF组给予低蛋白饲料,腹腔注射环磷酰胺,皮下注射G-CSF;化疗减毒汤低、中、高剂量组给予低蛋白饲料,灌胃化疗减毒汤,腹腔注射环磷酰胺。末次给药后24 h检测各组小鼠IL-1α、IL-6水平、造血干细胞免疫表型(CD34-LSK)细胞占骨髓细胞百分比及外周血细胞数量〔红细胞(RBC)计数、血红蛋白(Hb)、白细胞(WBC)计数、血小板(PLT)计数、中性粒细胞(NEUT)计数、NEUT分数、淋巴细胞(LYMPH)计数、LYMPH分数、单核细胞(MONO)计数、MONO分数、嗜碱粒细胞(BASO)计数、BASO分数、嗜酸粒细胞(EO)计数、EO分数〕。结果 模型组IL-1α水平、RBC、Hb、WBC、PLT、NEUT、LYMPH、LYMPH分数、EO分数低于对照组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比高于对照组(P<0.05);G-CSF组IL-6水平、CD34-LSK细胞占骨髓细胞百分比、NEUT分数、MONO分数高于对照组,RBC、Hb、LYMPH分数、EO分数低于对照组,IL-6水平、LYMPH分数低于模型组,WBC、NEUT分数高于模型组(P<0.05);化疗减毒汤低剂量组IL-1α水平、RBC、Hb、LYMPH分数、EO分数低于对照组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比高于对照组,IL-6水平低于模型组,LYMPH高于模型组,LYMPH分数高于G-CSF组(P<0.05);化疗减毒汤中剂量组RBC、Hb、LYMPH分数、EO分数低于对照组,WBC、NEUT、NEUT分数高于对照组,IL-1α水平、WBC、PLT、NEUT、NEUT分数、LYMPH高于模型组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于模型组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比、MONO分数低于G-CSF组,WBC、LYMPH分数高于G-CSF组,IL-1α水平高于化疗减毒汤低剂量组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于化疗减毒汤低剂量组(P<0.05);化疗减毒汤高剂量组RBC、Hb、LYMPH分数低于对照组,WBC、NEUT、NEUT分数高于对照组,IL-1α水平、WBC、PLT、NEUT、NEUT分数、LYMPH高于模型组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于模型组,IL-1α水平、WBC、LYMPH、LYMPH分数高于G-CSF组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比、MONO分数低于G-CSF组,IL-1α水平、PLT高于化疗减毒汤低剂量组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于化疗减毒汤低剂量组(P<0.05)。结论 化疗减毒汤中、高剂量具有很好的对抗环磷酰胺致骨髓抑制作用,在降低环磷酰胺对骨髓造血干细胞慢性毒性方面,化疗减毒汤优于G-CSF,其机制可能与调整IL-1α、IL-6水平、降低CD34-LSK细胞占骨髓细胞的百分比有关。
环磷酰胺;化疗减毒汤;骨髓抑制
唐振,李世杰,王颖飞,等.化疗减毒汤对环磷酰胺致骨髓抑制小鼠的保护机制研究[J].中国全科医学,2015,18(27):3360-3365.[www.chinagp.net]
Tang Z,Li SJ,Wang YF,et al.Protective mechanism of chemotherapy attenuation soup for rats with cyclophosphamide-induced bone marrow suppression[J].Chinese General Practice,2015,18(27):3360-3365.
化疗是目前治疗恶性肿瘤的主要方法之一,骨髓抑制是化疗最常见的剂量限制性反应,外周血象改变是化疗药物对骨髓抑制的主要外周表现[1],目前临床上使用重组人粒细胞集落刺激因子(G-CSF)、白介素(IL)11、促红细胞生成素等生物制剂对化疗后骨髓抑制进行对抗;但此类药物仅能促进血象中的一种细胞恢复,促进短期造血重建干细胞和较晚的祖细胞增殖,加之常有发热、骨痛等毒副作用,长期大量使用还会刺激恶性细胞生长并增加白血病患病的风险[2]。因此,如何减轻化疗药物对机体的损伤,特别是对骨髓的抑制,是医务工作者长期以来追求的目标。化疗减毒汤是成都中医药大学附属医院肿瘤科李世杰教授总结出来的中药复方,在辨证论治基础上根据患者个体情况如舌象、脉相等加减运用,以缓解肿瘤患者化疗后骨髓抑制,收效颇佳[3]。为探讨其具体机制,本研究以环磷酰胺腹腔注射建立小鼠骨髓抑制模型,分别运用低、中、高剂量化疗减毒汤和G-CSF进行治疗,观察小鼠外周血象变化,计数小鼠骨髓中造血干细胞免疫表型(CD34-c-Kit+Sca-1+lineage marker,CD34-LSK)细胞占骨髓细胞百分比[4],分析小鼠骨髓造血干细胞的增殖情况,以期从细胞、分子水平证实本治疗方法的科学性,为临床治疗、新药研究提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 药物 化疗减毒汤(黄芪60 g、人参30 g、当归20 g、白术10 g、生甘草10 g、阿胶5 g、龟板胶5 g、鹿角胶5 g,组方中药物为免煎中药颗粒,棕黄色,1 g相当于原生药1.292 g)由获得药品生产质量管理规范(GMP)认证的四川新绿色药业科技发展股份有限公司制成、成都中医药大学附属医院免煎中药房提供,使用时溶于400 ml煮沸过的饮用水,搅拌使药液混合均匀。药液终体积为414 ml,即1.87 g原生药/ml。本实验剂量按原生药g/kg计算。注射用环磷酰胺(通化茂祥制药有限公司,批号:130105)临用前配制。G-CSF注射液(齐鲁制药有限公司,批号:201304016TC)。
1.1.2 主要检测试剂 Anti-Mouse CD34eFluor 660(规格100 μg,eBioscience),IL-1α酶联免疫吸附剂测定(ELISA)试剂盒〔批号:C22031492,赛默飞世尔生物化学制品(北京)有限公司〕,IL-6 ELISA试剂盒〔批号:C30031493,赛默飞世尔生物化学制品(北京)有限公司〕。
1.1.3 动物 KM雄性小鼠60只,SPF级,体质量18~22 g,由四川省中医药科学院提供,动物合格证编号:SCXK(川)2008-19。自由饮水、标准饲料由四川省中医药科学院实验动物中心提供。本研究经成都中医药大学附属医院伦理委员会审核通过。
1.1.4 主要仪器 血细胞分析仪(XT-2000iv,sysmex公司),流式细胞仪(navios,Beckman Coulter),JA1003A电子天平(上海精天电子仪器有限公司)。
1.1.5 实验环境 四川省中医药科学院药理毒理研究所SPF屏障系统。室内温度20~22 ℃,相对湿度52%左右,24 h明暗交替照明。合格证号SYXK(川)2013-100。
1.2 实验方法
1.2.1 分组及给药方法 2013年9月2—21日,利用SPSS统计软件采用随机数字表法将小鼠随机分为6组,即对照组、模型组、G-CSF组、化疗减毒汤低剂量组(10 g原生药/kg)、化疗减毒汤中剂量组(20 g原生药/kg)及化疗减毒汤高剂量组(30 g原生药/kg),每组10只。对照组从第1天给予自制低蛋白饲料(玉米粉+小麦粉),连续17 d;模型组给予低蛋白饲料,连续17 d,从第8天开始腹腔注射环磷酰胺100 mg/kg,隔天1次,连续3次;G-CSF组给予低蛋白饲料,连续17 d,从第8天开始腹腔注射环磷酰胺100 mg/kg,隔天1次,连续3次,第14~16天皮下注射G-CSF 50 μg/kg,1次/d,连续3 d;化疗减毒汤低、中、高剂量组给予低蛋白饲料,同时每天上午同一时间灌胃给药1次(用JA1003A电子天平对小鼠进行称重以确定每只小鼠所需中药剂量,然后进行灌胃给药),连续17 d,从第8天开始腹腔注射环磷酰胺100 mg/kg,连续3 d。
本文研究价值:
(1)化疗减毒汤中、高剂量具有很好的对抗环磷酰胺致骨髓抑制作用,在降低环磷酰胺对骨髓造血干细胞慢性毒性方面,化疗减毒汤优于重组人粒细胞集落刺激因子(G-CSF),其机制可能与调整白介素(IL)1α、IL-6水平,降低造血干细胞免疫表型(CD34-LSK)细胞占骨髓细胞百分比有关。
(2)本方为李世杰教授根据自己多年的临床经验总结出来的中药复方,临床运用安全有效,适宜长期运用。
1.2.2 观察指标
1.2.2.1 IL-1α、IL-6水平及CD34-LSK细胞占骨髓细胞百分比检测 末次给药后24 h,尾静脉取血,采用ELISA法检测其IL-1α、IL-6水平;处死小鼠,取双侧股骨,用Anti-Mouse CD34eFluor 660试剂标记,用流式细胞仪检测CD34-LSK细胞数,并计算各组CD34-LSK细胞占骨髓细胞百分比[4-5]。
1.2.2.2 外周血细胞数量检测 末次给药后24 h,尾静脉取血,采用血细胞分析仪测定其相关血象:红细胞(RBC)计数、血红蛋白(Hb)、白细胞(WBC)计数、血小板(PLT)计数、中性粒细胞(NEUT)计数、NEUT分数、淋巴细胞(LYMPH)计数、LYMPH分数、单核细胞(MONO)计数、MONO分数、嗜碱粒细胞(BASO)计数、BASO分数、嗜酸粒细胞(EO)计数、EO分数。
2 结果
2.1 IL-1α、IL-6水平及CD34-LSK细胞占骨髓细胞百分比比较 各组IL-1α、IL-6水平及CD34-LSK细胞占骨髓细胞百分比比较,差异均有统计学意义(P<0.05)。模型组IL-1α水平低于对照组,IL-6水平及CD34-LSK细胞占骨髓细胞百分比高于对照组,差异有统计学意义(P<0.05);G-CSF组IL-6水平及CD34-LSK细胞占骨髓细胞百分比高于对照组,IL-6水平低于模型组,差异有统计学意义(P<0.05);化疗减毒汤低剂量组IL-1α水平低于对照组,IL-6水平及CD34-LSK细胞占骨髓细胞百分比高于对照组,IL-6水平低于模型组,差异有统计学意义(P<0.05);化疗减毒汤中剂量组IL-1α水平高于模型组和化疗减毒汤低剂量组,IL-6水平及CD34-LSK细胞占骨髓细胞百分比低于模型组、G-CSF组及化疗减毒汤低剂量组,差异有统计学意义(P<0.05);化疗减毒汤高剂量组IL-1α水平高于模型组、G-CSF组及化疗减毒汤低剂量组,IL-6水平及CD34-LSK细胞占骨髓细胞百分比低于模型组、G-CSF组及化疗减毒汤低剂量组,差异有统计学意义(P<0.05,见表1)。

Table 1 Comparison of the levels of IL-1α and IL-6 and the percentage of CD34-LSK cells in bone marrow cells among 6 groups
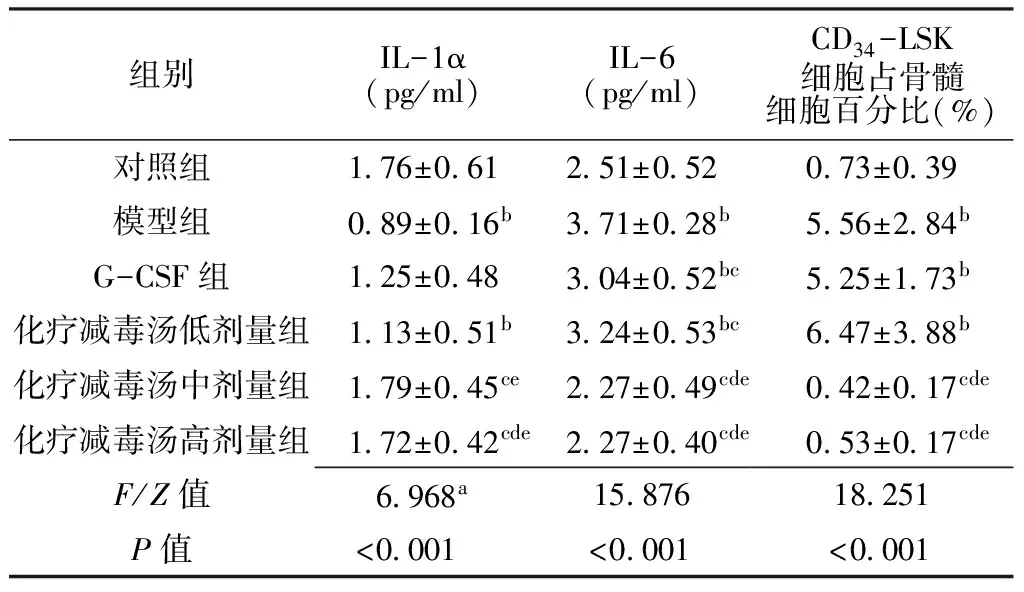
组别IL-1α(pg/ml)IL-6(pg/ml)CD34-LSK细胞占骨髓细胞百分比(%)对照组176±061251±052073±039模型组089±016b371±028b556±284bG-CSF组125±048304±052bc525±173b化疗减毒汤低剂量组113±051b324±053bc647±388b化疗减毒汤中剂量组179±045ce227±049cde042±017cde化疗减毒汤高剂量组172±042cde227±040cde053±017cdeF/Z值6968a1587618251P值<0001<0001<0001
注:G-CSF=重组人粒细胞集落刺激因子,IL-1α=白介素1α,IL-6=白介素6,CD34-LSK=造血干细胞免疫表型;a为Z值;与对照组比较,bP<0.05;与模型组比较,cP<0.05;与G-CSF组比较,dP<0.05;与化疗减毒汤低剂量组比较,eP<0.05
2.2 各组外周血细胞数量比较 各组RBC、Hb、WBC、PLT、NEUT、NEUT分数、LYMPH、LYMPH分数、MONO、MONO分数、EO分数比较,差异有统计学意义(P<0.05);各组BASO、BASO分数、EO比较,差异无统计学意义(P>0.05)。模型组RBC、Hb、WBC、PLT、NEUT、LYMPH、LYMPH分数、EO分数低于对照组,差异有统计学意义(P<0.05);G-CSF组RBC、Hb、LYMPH分数、EO分数低于对照组,NEUT分数、MONO分数高于对照组,WBC、NEUT分数高于模型组,LYMPH分数高于模型组,差异有统计学意义(P<0.05);化疗减毒汤低剂量组RBC、Hb、LYMPH分数、EO分数低于对照组,LYMPH高于模型组,LYMPH分数高于G-CSF组,差异有统计学意义(P<0.05);化疗减毒汤中剂量组RBC、Hb、LYMPH分数、EO分数低于对照组,WBC、NEUT、NEUT分数高于对照组,WBC、PLT、NEUT、NEUT分数、LYMPH高于模型组,WBC、LYMPH分数高于G-CSF组,MONO分数低于G-CSF组,PLT高于化疗减毒汤低剂量组,差异有统计学意义(P<0.05);化疗减毒汤高剂量组RBC、Hb、LYMPH分数低于对照组,WBC、NEUT、NEUT分数高于对照组,WBC、PLT、NEUT、NEUT分数、LYMPH高于模型组,WBC、LYMPH、LYMPH分数高于G-CSF组,MONO分数低于G-CSF组,PLT高于化疗减毒汤低剂量组,差异有统计学意义(P<0.05,见表2)。
3 讨论
化疗药物对骨髓的作用主要表现为急性作用和慢性作用,而环磷酰胺是代表药物。环磷酰胺对骨髓的慢性作用主要表现在抑制骨髓干细胞的功能[5],而其急性作用则表现为两方面,一是直接破坏血细胞,使其数量迅速降低;二是环磷酰胺对骨髓造血干细胞具有一定的动员作用,这种动员作用可导致骨系成骨细胞(bone-lining osteoblasts)消失或形象改变,导致其功能减退,这些现象与其能够减少基质细胞衍生因子(SDF-1)、干细胞因子(SCF)以及血管细胞黏附分子1(VCAM-1)的转录有关[6]。而造血干细胞是血液成分之一,是生成各种血细胞的最起始细胞,存在于骨髓、外周血、胚肝中,具有进一步分化各系统祖细胞的能力。CD34抗原选择地表达于造血祖细胞膜上,是造血干细胞的标志[7]。既往实验研究表明,CD34在造血干细胞及造血祖细胞上存在,能够特异性结合IL-1α、IL-6、IL-3以及G-CSF等细胞因子的受体[8]。de Revel等[9]将反转录IL-1α转移到恒河猴骨髓基质细胞,使其表达IL-1α,结果显示,IL-1α表达的同时,G-CSF以及人粒细胞-巨噬细胞集落刺激因子(GM-CSF)生成显著增加,其外周血WBC也轻度升高。提示IL-1α有一定刺激骨髓细胞形成的作用,IL-1α可显著增强内皮细胞支持造血作用,这种作用来源于上调细胞因子的表达。IL-6对造血干细胞的作用则是多方面的,一方面,IL-6具有刺激造血干细胞生长、分化和协同IL-3促进造血干细胞分化和促巨核细胞成熟等作用;另一方面,IL-6还有促进造血干细胞归巢的作用。Cardier等[10]用IL-3、IL-6、IL-11和铁因子共同处理小鼠造血干细胞24~48 h发现,这些因子能协调并促进造血干细胞向肺癌组织归巢,迁移率大于对照组,并且转化为肺组织细胞的比例增加。另外,IL-1、IL-3能联合启动造血干细胞的早期增殖,而IL-6能阻止这一现象[11]。本研究结果显示,模型组IL-1α水平、RBC、Hb、WBC、PLT、NEUT、LYMPH、LYMPH分数、EO分数低于对照组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比,提示模型组造模成功,其骨髓干细胞动员明显增加,外周血细胞数量的变化可能与注射环磷酰胺后影响IL-1α水平及IL-6水平进而引起骨髓造血干细胞的慢性抑制作用相关,同文献报道一致[5]。G-CSF组IL-6水平、CD34-LSK细胞占骨髓细胞百分比、NEUT分数、MONO分数高于对照组,RBC、Hb、LYMPH分数、EO分数低于对照组,CD34-LSK细胞占骨髓细胞百分比与模型组无差异,WBC、NEUT分数高于模型组,IL-6水平、LYMPH分数低于模型组,提示G-CSF能够用于化疗后骨髓抑制,能够刺激骨髓干细胞动员[12],但不能从根本上保护造血干细胞功能,不适宜长期运用。

表2 各组小鼠外周血细胞数量比较(±s,n=10)
注:RBC=红细胞,Hb=血红蛋白,WBC=白细胞,PLT=血小板,NEUT=中性粒细胞,LYMPH=淋巴细胞,MONO=单核细胞,BASO=嗜碱粒细胞,EO=嗜酸粒细胞;与对照组比较,bP<0.05;与模型组比较,cP<0.05;与G-CSF组比较,dP<0.05;与化疗减毒汤低剂量组比较,eP<0.05
本研究结果显示,化疗减毒汤低剂量组IL-1α水平、RBC、Hb、LYMPH分数、EO分数低于对照组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比高于对照组,IL-6水平低于模型组,LYMPH高于模型组,LYMPH分数高于G-CSF组;化疗减毒汤中剂量组RBC、Hb、LYMPH分数、EO分数低于对照组,WBC、NEUT、NEUT分数高于对照组,IL-1α水平、WBC、PLT、NEUT、NEUT分数、LYMPH高于模型组,IL-1α水平高于化疗减毒汤低剂量组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于模型组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比、MONO分数低于G-CSF组,WBC、LYMPH分数高于G-CSF组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于化疗减毒汤低剂量组,PLT高于化疗减毒汤低剂量组;化疗减毒汤高剂量组RBC、Hb、LYMPH分数低于对照组,WBC、NEUT、NEUT分数高于对照组,IL-1α水平、WBC、PLT、NEUT、NEUT分数、LYMPH高于模型组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于模型组,IL-1α水平、WBC、LYMPH、LYMPH分数高于G-CSF组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比、MONO分数低于G-CSF组,IL-1α水平、PLT高于化疗减毒汤低剂量组,IL-6水平、CD34-LSK细胞占骨髓细胞百分比低于化疗减毒汤低剂量组。提示化疗减毒汤中、高剂量可拮抗环磷酰胺导致的骨髓抑制,具有升高环磷酰胺所致骨髓抑制小鼠WBC的作用,且效果优于G-CSF,临床可运用于需行化疗或化疗后WBC降低的患者。其机理可能是其通过增加实验小鼠血液中的IL-1α水平,促进内皮细胞支持造血干细胞的分化及增殖功能,促进其造血干细胞功能及外周血象的恢复;同时通过降低其IL-6水平,导致造血干细胞归巢的作用、减弱IL-6抑制其他细胞因子对造血干细胞功能的抑制作用,这几方面的综合结果导致化疗减毒汤在不损伤造血干细胞储备的情况下,将外周血象维持在较高水平。
根据化疗后骨髓抑制常见的乏力、头晕、发热等临床表现,可将其归属于中医学“虚劳”“血虚”范畴。化疗后脾肾受损,脾虚则气血生化乏源,肾亏则精血生化无根,基于阴阳互根、五脏相关、气血同源等理论,气虚不能生血,血虚不能化气,气虚者阳渐衰,血虚者阴渐亏,终致脾肾不足,气血两亏[13]。《张氏医通》[14]有云:“人之虚,非气即血,五脏六腑莫能外焉。而血之源头在乎肾,气之源头在乎脾。”可见化疗骨髓抑制患者的关键病理机制是脾肾不足,故治疗应从脾肾入手。化疗解毒汤是治疗化疗后骨髓抑制的经验方,方中黄芪、人参大补元气,健脾益气为君,当归补血活血、白术健脾益气,使补而不滞为丞,佐以阿胶、鹿角胶、龟板胶补血益精滋肾,甘草调和诸药,共奏健脾益肾,补气益血之功。赵静梅[15]研究表明,补气、养血、益肾之法具有解除化疗后骨髓细胞G1期阻滞的作用,能增加造血干祖细胞的数量,对骨髓有核细胞计数及红系、粒系、巨系等的恢复具有较好作用。补肾解毒活血中药可通过促进骨髓造血祖细胞集落生成能力,促进造血细胞的生成[16-17]。本研究所采用的化疗减毒汤方中人参所含的多糖、皂甙可促进大鼠骨髓间充质干细胞造血细胞因子mRNA的表达[18];黄芪具有减轻贫血动物模型的贫血程度、促进造血干细胞增殖和分化的作用,当归多糖可进而促进粒单系血细胞的生成[19];阿胶活性组分能够有效地保护骨髓造血微环境,减轻环磷酰胺对骨髓组织的损伤,保护造血组织[20];白术有抗肿瘤及肿瘤转移的作用,并可调节肿瘤患者胃肠功能[21]。
显然,本研究也存在一定的不足之处。首先,本研究未能完全揭示化疗减毒汤中、高剂量升高外周血WBC、PLT的具体机制,也未能揭示本方升高外周血WBC、PLT的最佳剂量及最佳时机;其次,本研究样本量仍偏小,实验时间较短,今后如能开展针对疗效机制、量效机制的多中心、大样本、随访时间较长的基础研究、临床队列研究可望得到更有说服力的结果。
综上所述,化疗减毒汤能改善环磷酰胺致小鼠骨髓抑制,在骨髓造血干细胞慢性毒性方面,化疗减毒汤明显优于G-CSF,值得推广。但其详细作用机理仍有待进一步深入研究。
[1]程凯,蒋刚.91例化学治疗药物致Ⅳ度骨髓抑制临床分析[J].中国药业,2014,23(12):50-51.
[2]Relling MV,Boyett JM,Blanco JG,et al.Granulocyte colony-stimulating factor and the risk of secondary myeloid malignancy after etoposide treatment[J].Blood,2003,101(10):3862-3867.
[3]谭雪芹,李世杰,何秀云.李世杰教授自拟化疗减毒方临床经验总结[J].光明中医,2013,28(1):2012-2014.
[4]Tian C.Recent research advances on markers,isolation and purification of mouse hematopoietic stem cells-review[J].Journal of Experimental Hematology,2012,20(1):196-199.(in Chinese) 田晨.小鼠造血干细胞表型及其分离纯化的研究进展[J].中国实验血液学杂志,2012,20(1):196-199.
[5]Tian J,Yu P,Sun WX,et al.Effect of cyclophosphamide on murine bone marrow hematopoietic cells and its possible mechanism[J].Journal of Experimental Hematology,2012,20(6):1316-1321.(in Chinese) 田杰,于沛,孙文宣,等.环磷酰胺对正常小鼠骨髓造血细胞的影响及其作用机制[J].中国实验血液学杂志,2012,20(6):1316-1321.
[6]McKinstry WJ,Li CL,Rasko JE,et al.Cytokine receptor expression on hematopoietic stem and progenitor cells[J].Blood,1997,89(1):65-71.
[7]Zhou J,Zhu B,Du HY,et al.Detection and analysis of CD271,CD133and CD34expression in bone marrow cells by flow cytometry with three color flouresence labelling[J].Journal of Experimental Hematology,2009,17(1):133-136.(in Chinese) 周俊,朱兵,杜海燕,等.流式细胞术联合检测骨髓细胞CD271、CD133、CD34的表达与分析[J].中国实验血液学杂志,2009,17(1):133-136.
[8]Mayack SR,Wagers AJ.Osteolineage niche cells initiate hematopoietic stem cell mobilization[J].Blood,2008,112(3):519-531.
[9]de Revel T,Becard N,Sorg T,et al.Retroviral interleukin 1alpha gene transfer in bone marrow stromal cells in a primate model:induction of myelopoiesis stimulation[J].Br J Haematol,2002,118(3):875-884.
[10]Cardier JE,Murphy MJ Jr,Erickson-Miller CL.IL-6 interferes with stimulation of HPP-CFC and large CFU-Mk in conjunction with cytokine combinations from primitive murine marrow cells[J].Stem Cells,1997,15(6):437-442.
[11]Yang Q,Zhang LF.Interleukin family cytokines and stem cell mobilization[J].Chines Journal of Comparative Medicine,2011,21(5):62-65.(in Chinese) 杨青,张连峰.白介素家族细胞因子与干细胞动员[J].中国比较医学杂志,2011,21(5):62-65.
[12]Xu L,Chang CK,Gan WJ,et al.Yield of CD34+cells in graft can be increased significantly by G-CSF used at appropriate time after chemotherapy for Auto PBSCT[J].Journal of Experimental Hematology,2011,19(3):759-763.(in Chinese) 徐黎,常春康,干蔚瑾,等.化疗后恰当时机使用G-CSF能显著提高自体外周血干细胞移植物中CD34+细胞的含量[J].中国实验血液学杂志,2011,19(3):759-763.
[13]Lin CJ,Gan XJ.Experience on treating arrest of bone marrow after chemotherapy with self-made SanZi BuXueTang[J].Western Journal of Traditional Chinese Medicine,2012,25(10):47-48.(in Chinese) 蔺彩娟,甘欣锦.自拟三子补血汤治疗化疗后骨髓抑制的经验[J].西部中医药,2012,25(10):47-48.
[14]张璐.张氏医通[M].北京:人民卫生出版社,2006,卷二:33.
[15]赵静梅.补肾活血法和益气补血法防治化疗后骨髓抑制及作用机制比较研究[D].北京:中国人民解放军学院,2012:1-4.
[16]Wang Q,Yang XH,Gao Y,et al.A comparative study of Bushen Jiedu Huoxue recipe and Yiqi Buxue recipe on the impact of hematopoiesis in marrow-depressed mice[J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(1):192-195.(in Chinese) 王茜,杨旭辉,高月,等.补肾解毒活血法与益气补血法对骨髓抑制小鼠造血功能影响的比较研究[J].中国实验方剂学杂志,2012,18(1):192-195.
[17]Wang Q,Yang XH,Gao Y,et al.A comparative study of Bushen Jiedu Huoxue recipe and Yiqi Buxue recipe on the prevention of bone marrow suppression induced by cyclophosphamide[J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(7):242-245.(in Chinese) 王茜,杨旭辉,高月,等.补肾解毒活血方与益气补血方预防化疗后骨髓抑制的比较研究[J].中国实验方剂学杂志,2012,18(7):242-245.
[18]Wei JA,Cheng ZA,Wen JX,et al.Compative study of enhencing effect on mRNA of hematopoietic growth factors in rat bone marrow mesenchymal stem cells by ginseng polysaccharide and ginsenoside[J].Chinese Journal of Integrated Traditional and Western Medicine,2011,31(3):372-375.(in Chinese) 危建安,程志安,温建炫,等.人参多糖与人参皂苷诱导大鼠骨髓间充质干细胞造血细胞因子表达的作用比较[J].中国中西医结合杂志,2011,31(3):372-375.
[19]沈云辉,陈长勋.中药有效组分促粒系造血及升高白细胞作用的研究[J].中成药,2005,27(4):462-464.
[20]邓皖利,吴宏忠,徐文,等.阿胶补血活性组分对环磷酰胺所致贫血小鼠骨髓造血微环境的影响[J].时珍国医国药,2011,22(10):2542-2544.
[21]Xiang XQ,Ye H.Progress of research and application in tumors of atractylodes macrocephala koidz[J].Chinese Journal of Experimental Traditional Medical Formulae,2013,19(8):367-370.(in Chinese) 向小庆,叶红.白术抗肿瘤作用的研究及应用进展[J].中国实验方剂学杂志,2013,19(8):367-370.
(本文编辑:崔丽红)
Protective Mechanism of Chemotherapy Attenuation Soup for Rats With Cyclophosphamide-induced Bone Marrow Suppression
TANGZhen,LIShi-jie,WANGYing-fei,etal.
SchoolofClinicalMedicine,ChengduUniversityofT.C.M,Chengdu610072,China
Objective To observe the protective mechanism of chemotherapy attenuation soup for rats with cyclophosphamide-induced bone marrow suppression.Methods From September 2 to 21 in 2013,using SPSS statistic software,60 rats were equally divided into 6 groups:control group,model group,G-CSF group,low-dose chemotherapy attenuation soup group (10 g crude drug/kg),medium-dose chemotherapy attenuation soup group (20 g crude drug/kg) and high-dose chemotherapy attenuation soup group (30 g crude drug/kg).Control group was given low protein feed;model group was given low protein feed and cyclophosphamide by intraperitoneal injection;G-CSF group was given low protein feed,cyclophosphamide by intraperitoneal injection and G-CSF by subcutaneous injection;low-dose chemotherapy attenuation soup group,medium-dose chemotherapy attenuation soup group and high-dose chemotherapy attenuation soup group were given low protein feed,chemotherapy attenuation soup by gavage and cyclophosphamide by intraperitoneal injection.24 hours after the last drug administration,examined levels of IL-1α and IL-6,percentage of CD34-LSK cells in bone marrow cells,RBC,Hb,WBC,PLT,NEUT,NEUT score,LYMPH,LYMPH score,MONO,MONO score,BASO,BASO score,EO and EO score.Results Model group was lower(P<0.05) in the level of IL-1α,RBC,Hb,WBC,PLT,NEUT,LYMPH,LYMPH score,EO score and higher (P<0.05) in the level of IL-6,percentage of CD34-LSK cells in bone marrow cells than control group;G-CSF group was higher (P<0.05) in the level of IL-6,the percentage of CD34-LSK cells in bone marrow cells,NEUT score and MONO score and higher (P<0.05) in RBC,Hb,LYMPH score and EO score than control group;G-CSF group was lower(P<0.05) in the level of IL-6 and LYMPH score and higher (P<0.05) in WBC and NEUT score than model group;low-dose chemotherapy attenuation soup group was lower (P<0.05) in the level of IL-1α,RBC,Hb,LYMPH score and EO score and higher (P<0.05) in the level of IL-6 and percentage of CD34-LSK cells in bone marrow cells than control group;low-dose chemotherapy attenuation soup group was lower (P<0.05) in the level of IL-6 and higher (P<0.05) in LYMPH than model group;low-dose chemotherapy attenuation soup group was higher(P<0.05) in LYMPH score than G-CSF group;medium-dose chemotherapy attenuation soup group was lower (P<0.05) in RBC,Hb,LYMPH score and EO score and higher (P<0.05) in WBC,NEUT and NEUT score than control group;medium-dose chemotherapy attenuation soup group was higher (P<0.05) in the level of IL-1α,WBC,PLT,NEUT,NEUT score and LYMPH and lower (P<0.05) in the level of IL-6 and percentage of CD34-LSK cells in bone marrow cells than model group;medium-dose chemotherapy attenuation soup group was lower (P<0.05) in the level of IL-6 and percentage of CD34-LSK cells in bone marrow cells and MONO score and higher (P<0.05) in WBC and LYMPH score than G-CSF group;medium-dose chemotherapy attenuation soup group was higher (P<0.05) in the level of IL-1α and lower (P<0.05) in the level of IL-6 and percentage of CD34-LSK cells in bone marrow cells than low-dose chemotherapy attenuation soup group;high-dose chemotherapy attenuation soup group was lower (P<0.05) in RBC,Hb and LYMPH score and higher (P<0.05) in WBC,NEUT score than control group;high-dose chemotherapy attenuation soup group was higher (P<0.05) in the level of IL-1α,WBC,PLT,NEUT,NEUT score and LYMPH and lower (P<0.05) in the level of IL-6 and percentage of CD34-LSK cells in bone marrow cells than model group;high-dose chemotherapy attenuation soup group was higher (P<0.05) in the level of IL-1α,WBC,LYMPH and LYMPH score and lower (P<0.05) in the level of IL-6,percentage of CD34-LSK cells in bone marrow cells and MONO score than G-CSF group;high-dose chemotherapy attenuation soup group was higher (P<0.05) in the level of IL-1α and PLT and lower (P<0.05) in the level of IL-6 and percentage of CD34-LSK cells in bone marrow cells than low-dose chemotherapy attenuation soup group.Conclusion Medium-dose and high-dose chemotherapy attenuation soup have good protective effect against bone marrow suppression induced by cyclophosphamide.Chemotherapy attenuation soup is superior to G-CSF in reducing the chronic toxicity brought by cyclophosphamide in bone marrow hematopoietic stem cells.The mechanism is probably that it can adjust IL-1α and IL-6 levels and reduce the percentage of CD34-LSK cells in bone marrow cells.
Cyclophosphamide;Chemotherapy attenuation soup;Bone marrow suppression
四川省科技支撑计划项目(2011SZ0312)
610072 四川省成都市,成都中医药大学临床医学院(唐振,王颖飞,夏凯,侯晓利,张聪,叶震中,曹红春);成都中医药大学附属医院(李世杰)
李世杰,610072 四川省成都市,成都中医药大学附属医院;E-mail:chinajef@126.com
R 551.3
A
10.3969/j.issn.1007-9572.2015.27.022
2015-02-25;
2015-05-15)
