气相色谱法测定土壤中柴油含量
2015-03-28李晓森周世坤刘石磊
李晓森,周世坤,刘石磊
(国民核生化灾害防护国家重点实验室,防化研究院,北京 102205)
柴油是应用广泛的石油制品[1]。近年来多次发生因各类生产事故和不法分子盗窃而导致的成品油管线破损的柴油污染事故。柴油对土壤生态环境以及农作物生长破坏严重,有致癌毒性,能够在食物链中累积进而危害人类健康。柴油的沸点介于 160~360℃之间,主要成分为 C10–C24的烃类(包括饱和烷烃、烯烃、芳香烃及醇、胺类化合物等)[2],此外还含有部分硫以及氮的化合物。柴油挥发值为0.25(汽油为77.9),且其与土壤的粘附性较强。研究表明,在含粉粒与粘粒较高的土壤中,一个月内柴油的自然挥发率不足3%[3]。当土壤中的柴油含量超过100 μg/g时,即对生态环境构成危害[3]。
基于修复原理的不同可将土壤修复技术分为物理法[4–5]、化学法[6]及生物法[7–13]三大类。化学法和物理法的修复成本在150~400美元/亩[6],其操作设备复杂、破坏土壤结构而影响耕作、操作不当还会造成土壤的二次污染,如焚烧法会造成大气污染。生物法是指利用外源(酶制剂等)或土著生物(包括微生物、动物以及植物等)的降解能力来分解或者转化土壤中的污染物,通过一系列细胞内或者细胞外氧化还原反应,将污染物最终转化为二氧化碳、水或者其它低毒无害的化合物。生物修复凭借其绿色无污染、操作简便且成本较低的优势,逐渐成为重点研究方向[14]。
目前对于柴油的定量分析主要有紫外–可见分光光度法[15]及气相色谱法[16]等。气相色谱法是基于柴油在气相色谱柱程序升温过程中的出峰情况,通过加入内标物并对色谱峰面积进行归一化处理后得到定量结果,能够消除不同组分变化引起的差异。笔者利用气相色谱法测定柴油污染土壤的生物修复过程中柴油含量的变化,以期为土壤中柴油的测定提供科学的研究方法。
1 实验部分
1.1 主要仪器与试剂
气相色谱仪:Shimadzu GC–2010型,配有FID氢焰离子化检测器,日本岛津公司;
微波萃取仪:MARS–X型,微波输出功率:0~1 600 W,美国CEM公司;
分析天平:Adventurer型,精度为0.001 g,美国奥豪斯公司;
柴油:0#纯品,中关村北大街中石化加油站;正己烷:分析纯,北京现代东方精细化学厂;丙酮:分析纯,北京现代东方精细化学厂;
柴油标准溶液:配制正己烷–丙酮(1∶1)溶液于容量瓶中,定量称取柴油,加入正己烷–丙酮溶液,定容至 100 mL,分别配制成 0.5,1.0,1.5,2,2.5,3 g/L柴油标准溶液系列,备用;
土壤样品:来源于河北省某柴油污染耕地。
1.2 土壤样品处理
土壤样品取样地块曾因输送管道破裂发生柴油泄漏,导致土壤被0#,20#柴油污染,后经生物法修复,投加降解菌株进行治理,土壤中柴油的含量得以降低。污染土壤与正常土壤的采集与保存方法参照中华人民共和国农业行业标准NY/T 1121.1–2006《土壤检测 第1部分:土壤样品的采集、处理和贮存》进行。现场采样记录见表1,土壤pH及电导率的测定由北京农林科学院完成。
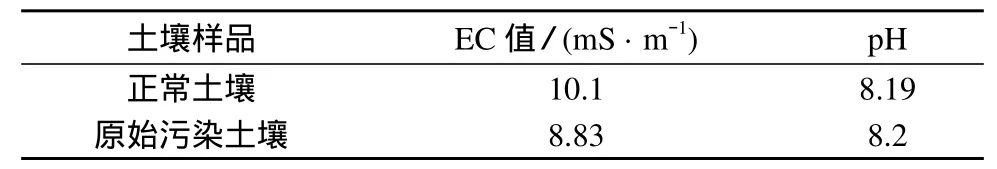
表1 污染土壤与正常土壤的理化性质
由表1可以看出土壤受柴油污染后pH值基本不变,但由于柴油的粘性及其对土壤颗粒的团聚作用,导致电导率下降,影响土壤通透性,对农作物造成破坏。
准确称取来自场地的正常土壤(10.0±0.1) g,分别加入0.1~0.5 g购置的0#柴油,搅拌均匀后配制成为柴油质量分数为1%~5%的污染土壤,与1份正常土壤(作为基质空白)同时进行微波萃取,提取土壤中的柴油,稀释到适宜浓度后利用气相色谱法测定柴油含量,同一添加样品重复测定5次。
利用微波萃取仪对土壤样品进行预处理。实验方法如下:
(1)准确称取2 g土壤样品(湿重)加入微波萃取样品罐,注意土壤样品中不得有任何金属颗粒;
(2)向其中加入25 mL正己烷–丙酮混合萃取剂(1∶1);
(3)检查确认样品罐密闭完好,观察样品罐密封膜无破损,保证样品管外壁无水滴;
(4)将微波萃取仪测温头插入1号罐(指示罐),并将萃取罐按照相应编号放置到萃取仪反应盘上;
(5)设定微波萃取操作参数(反应功率1 200 W,萃取时间30 min,反应温度120℃),进行萃取操作;
(6)反应结束后,待反应室温度降至30℃以下时,取出反应罐。将萃取液过滤,留至气相色谱分析用。
1.3 色谱条件
分析方法:SY/T 5779–1995 《原油全烃气相色谱分析方法》;色谱柱:Ultra Alloy capillary column DX–30不锈钢柱(30 m×0.53 mm);检测器:氢离子火焰检测器;进样方式:自动进样;样品体积:1 μL;分流比:1∶5;进样口温度:300℃;检测器温度:300℃;程序化升温:柱箱温度首先于40℃保持2 min,然后以15℃/min升温至290℃,保持3 min;内标物:1 000 mg/L二硝基甲苯。
1.4 定量方法
样品中加入1%的二硝基甲苯作为内标物。样品测定结束后,根据柴油样品色谱峰的全部面积ΣAi与内标物二硝基甲苯的色谱峰面积A之比与柴油浓度之间的线性关系制作标准曲线,进而测定土壤样品中的柴油含量。
2 结果与讨论
2.1 样品处理条件的选择与优化
发生柴油污染后,由于柴油的粘性,土壤样品会出现部分团聚的情况,影响样品中柴油的萃取以及进一步的定性及定量分析。常规的超声萃取或振荡萃取难以取得良好的效果。通过高功率的微波萃取,可以充分萃取得到样品中的柴油。溶剂选择正己烷–丙酮混合萃取剂(1∶1),对柴油中的极性及非极性组分有良好的萃取效果。微波萃取完毕后可以进行土壤样品的干重测量,得到样品中的柴油含量。
2.2 色谱条件的选择
色谱条件选择时应该充分兼顾样品的极性强弱、相关组分的保留时间以及柱效等因素。柴油的主要组分为正构烷烃、异构烷烃及少量的醇、胺类化合物。针对样品的特性,选择非极性毛细管柱Ultra Alloy capillary column DX–30,其固定相为非极性键合相,对烷烃的分离效果较好。柴油中的多个组分能够独立分开,信噪比≥5,色谱峰形对称尖锐,灵敏度高。土壤中柴油的生物降解过程主要由真菌及细菌等参与。在降解过程中由于存在不同官能团在不同阶段的变化,长链烷烃与芳香烃的裂解效率不同,芳香烃的裂解效率要低于烷烃的降解效率。气相色谱法的测定原理是基于柴油中所有组分的出峰情况,根据峰面积之和进行定量,因此排除了不同组分(芳香烃与长链烷烃)之间的差异,测定精密度较好,结果可信度高,能够反应土壤中柴油的真实含量。
按照1.3样品处理方法,对柴油加标土壤进行微波萃取,在得到的柴油样品中加入二硝基甲苯作为内标物,按照1.4色谱条件以气相色谱法测定柴油含量。色谱图如图1所示。
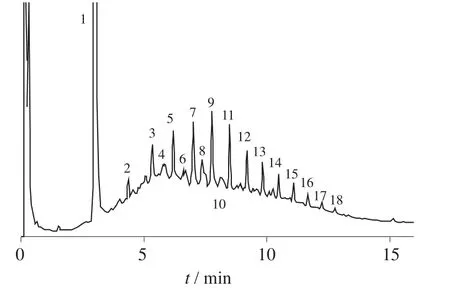
1—二硝基甲苯(内标物);2—癸烷;3—十一烷;4—癸胺;5—十二烷;6—十三醇;7—十三烷;8—十四醇;9—十四烷;10—十五胺;11—十五烷;12—十六烷;13—十七烷;14—十八烷;15—十九烷;16—二十烷;17—二十一烷;18—二十二烷图1 1 000 mg/L柴油加标土壤样品气相色谱图
由图1可知,溶剂为正己烷–丙酮时,柴油各组分出峰情况良好,主要组分为正构烷烃及少量的含N,O的烷烃衍生物,内标物先出峰,柴油各组分出峰时间为3~13 min。
2.3 线性方程和检出限
利用质量浓度分别为 0.5,1,1.5,2,2.5,3 g/L的系列标准溶液所测ΣAi/A(Ai柴油各组分的色谱峰面积,A为内标物二硝基甲苯的色谱峰面积),对柴油的质量浓度c(g/L)进行线性回归,得线性方程、线性相关系数。以3倍信噪比定义检出限,方法的线性范围、线性方程、相关系数和检出限见表2。

表2 方法的线性范围、线性方程、相关系数及检出限
2.4 精密度试验和加标回收试验
利用气相色谱法对1.5中所述的土壤柴油加标样品进行测定,结果见表3。

表3 加标回收试验结果 %
由表3可知,正常土壤柴油加标回收试验,柴油的平均回收率为100.6%~103.6%,测定结果的相对标准偏差为1.16%~1.42%,表明该法具有良好的精密度与准确度。
2.5 土壤样品测定结果
取样地段曾因埋于地下的柴油管道泄漏,发生大面积耕地柴油污染事件。经添加铜绿假单胞菌及黄胞原毛平革菌进行生物修复治理,柴油含量得以下降,土壤污染得到治理。分别对治理后的污染土壤以及周边未污染的正常土壤进行采样,经微波萃取后,采用气相色谱法对生物降解后的柴油含量进行测定,正常土壤和污染土壤的色谱图如图2所示。

图2 土壤样品色谱图
由图2可知,正常土壤的色谱图中无明显色谱峰,表明土壤中不含柴油污染物;污染土壤样品有若干柴油特征色谱峰,表明污染土壤中仍含有柴油。根据样品所获得的气相色谱峰面积ΣAi/A,在标准曲线上得到柴油浓度c(g/L),再根据土壤质量,得到污染土壤中的柴油含量为(22±4) mg/g,测定结果的相对标准偏差为1.19%。
3 结语
采用气相色谱法对土壤中的柴油进行定量检测。实验表明对于针对陈旧性柴油污染及生物降解过程中柴油含量变化定量测定时,气相色谱法能够较好的消除官能团的影响,定量效果较好。该方法适用于土壤中柴油含量的测定。
[1] Gallego J R,LpredoJ,Llamas F J,et al. Bioremediation of dieselcontaminated soils: Evaluation of potential in situ techniques by study of bacterial degradation[J]. Biodegradation,2001,12(5):325–335.
[2] Lu M,Zhang Z,Sun S,et al. Enhanced degradation of bioremediation residues in petroleum-contaminated soil using a two-liquid-phase bioslurry reactor[J]. Chemosphere,2009,77(2): 161–168.
[3] 李玉瑛,郑西来,李冰,等.柴油挥发行为的研究[J].化工环保,2005,25(6): 423–426.
[4] Haapea P,Tuhkanen T. Integrated treatment of PAHs contaminated soil by soil washing,ozonation,and biological treatment[J].J Hazardous Materials,2006,13(6): 244–250.
[5] 宇丽,曾溅辉,陈广.柴油在土壤中迁移的试验模拟研究[J].安全与环境学报,2008,8(3): 1–6.
[6] Rivas F J. Polycyclic aromatic hydrocarbons sorbed on soils:a short review of chemical oxidation based treatments[J]. J Hazardous Materials,2006,138(2): 234–251.
[7] Pao W,Grace L,Tsung C C,et al. Effects of soil organic matter and bacterial community shift on bioremediation of dieselcontaminated soil[J]. International Biodeterioration and Biodegradation,2013,88(85): 661–670.
[8] Reena D,Bhupendra N. Tiwary isolation of a novel strain of Planomicrobiumchinense from diesel contaminated soil of tropical environment [J]. Journal of basic microbiology,2013,53(9):723–732.
[9] 王世杰,王翔,卢桂兰.柴油降解菌的筛选鉴定及降解特性研究[J].农业环境科学学,2011,30(1): 49–54.
[10] Ogochukwu A A,Matthew O. Utilization of Drilling Fluid Base Oil Hydrocarbons by Microorganisms Isolated from Diesel-Polluted Soil[J]. Soil and Sediment Contamination,2013,22(7):817–828.
[11] 龚鹏博,郭明防,李健雄.蚯蚓净化环境的生态功能[J].生物学通报,2007,42(12): 20–21.
[12] 孙敏,沈先荣,侯登勇,等.高效柴油降解菌Acinetobacter sp.W3分离鉴定及降解酶基因扩增分析[J].生物技术通报,2012,6: 159–165.
[13] Ortega G,Katherine O G,Zaragoza D. Degradation of benzene,toluene,and xylene isomers by a bacterial consortium obtained from rhizosphere soil of Cyperussp grown in a petroleumcontaminated area[J]. Folia Microbiologica,2013,58(6):569–577.
[14] 刘伟,刘红玉,曾光明,等.产表面活性剂菌筛选及其对柴油降解影响研究[J].环境工程学报,2010,4(1): 219–225.
[15] Ralunan K S M,Banat I M,Thahlra J,et al. Bioremediation of gasoline contaminated soil by a bacterial consortium amended with poultry litter,coir pith,and rhamnolipidbiosurfactant[J].Bioresource Technology, 2002,81(1): 25–32.
[16] 谢园园,花磊,陈平,等.气相色谱-单光子电离飞行时间质谱的联用及在柴油组分表征中的应用[J].色谱,2015,33(2):188–194.
