土壤碳循环主要过程对气候变暖响应的研究进展
2015-03-27陈龙飞何志斌杜军杨军军朱喜
陈龙飞,何志斌,杜军,杨军军,朱喜
(1.中国科学院寒区旱区环境与工程研究所,中国生态系统研究网络临泽内陆河流域研究站,中国科学院内陆河流域生态水文重点实验室,甘肃 兰州730000;2.中国科学院大学,北京100049)
IPCC第5次评估报告预测,2016年至2035年间全球地表平均气温将升高0.3至0.7℃,2081年至2100年间将升高0.3至4.8℃;并明确指出,气候变暖作为全球变化的主要表现之一,已是毋庸置疑的事实[1]。由于温度影响着几乎所有的陆地生态系统碳循环过程,气候变暖将会对全球陆地生态系统碳循环过程产生巨大影响[2]。气候变暖可以通过以下机制影响陆地生态系统碳循环过程:通过改变物候期及生长期的长短影响地表植物的生长及群落结构[3-4];通过改变土壤微生物的活性及土壤有机碳的分解速率影响土壤呼吸及养分循环[4-8],最终影响地表植被的生长及格局[9-10];通过从大尺度上影响降雨和蒸发[11],从小尺度上影响地表蒸散改变土壤水分的盈亏[12-13],对生态及水文过程产生影响[14]。陆地生态系统碳平衡主要由光合作用和呼吸作用(包括地表植被呼吸和土壤呼吸)两个过程决定[14]。气候变暖对陆地生态系统碳循环过程改变将促进或抑制上述过程,导致原有的碳平衡发生变化,进而对气候变暖产生反馈,这种反馈作用有可能加快或减缓气候变暖的进程。
土壤是陆地生态系统重要组成部分,它为地表植物、土壤动物及微生物生存提供基地和营养[15]。由气候变暖导致的土壤物质、能量循环过程及速率的变化,不仅直接影响土壤的碳排放,同时也影响到地表植被的养分供应,对植被的生长及格局产生影响[15]。土壤同时也是陆地系统中最大的碳库载体[16],其碳贮量是全球陆地植被碳库的近4倍,大气碳库的2倍多[17]。由气候变暖导致土壤碳库的微小变化都有可能对陆地生态系统碳平衡产生巨大影响。由于土壤的高度异质性,且受到研究手段的局限,相较于地表过程,目前关于土壤碳循环过程对气候变暖响应的认识远远不足,使得现有的气候变化模型存在较大的不确定性[5,18-19]。一般认为气候变暖会加快土壤有机碳分解,增加土壤呼吸速率;且大部分模型预测结果都表明,土壤碳库的这一响应会对气候变暖产生正反馈作用,即加速气候变暖的进程[19]。但是近些年来的一些研究却发现:增温虽然可以在短期内促进土壤呼吸,但是随时间的延长这种促进作用会慢慢的减弱,即会表现出一定的适应性(acclimation)[8,20-21]。因此,目前关于土壤碳循环过程对气候变暖的响应的认识存在很大变数。土壤碳循环过程仍是当前全球变化中亟需研究的热点和难点问题。
土壤呼吸是土壤碳输出的主要途径,气候变暖可以改变土壤微生物的活性(土壤呼吸的主体)、土壤有机碳的分解速率(土壤呼吸的主要反应底物),影响土壤呼吸速率,最终影响碳的输出;同时可以通过改变凋落物的总量、质量及根际物的分泌影响土壤碳的输入[22];此外,气候变暖可以联合CO2浓度升高、降水变化、氮沉降等气候变化因子共同影响土壤碳循环过程[23]。基于此,本文首先论述土壤呼吸过程对气候变暖的响应及适应机制,并从土壤微生物、土壤有机碳分解的温度敏感性等方面探讨了土壤碳循环过程对气候变暖的响应;随后论述了气候变暖与其他气候变化因子之间、地上部分与地下部分之间的协同作用对土壤碳循环过程的影响;最后指出了该领域未来的研究重点及发展方向。
1 土壤呼吸对气候变暖的响应
1.1 气候变暖对土壤呼吸速率的影响
土壤呼吸是陆地生态系统碳排放的主要途径[24],在全球尺度上,每年因土壤呼吸排放的碳相当于化石原料燃烧排放碳总量的11倍多[25]。尽管土壤呼吸是当前陆地碳循环研究领域中引人关注的热点问题,但是目前对土壤呼吸的具体过程及机理的认识依旧欠缺[26-28]。
土壤呼吸包括3个生物学过程(微生物呼吸、根呼吸及动物呼吸)和1个非生物学过程(含碳矿物质的化学氧化作用)[29]。与其他生物化学反应过程一样,这些过程都受到温度的驱动。Q10是指示生物化学反应速率随温度变化的参数。一般认为,温度每增加10℃,生物化学反应的速率将增加一倍。很多学者由此认为温度每增加10℃,土壤呼吸速率将增加一倍[22]。目前已有的研究普遍认为气候变暖可以增加土壤呼吸速率。Rustad等[9]对全球范围内位于高海拔/高纬度的32个研究点的增温试验结果进行分析发现:经过2~9年的增温后,所有研究点的土壤呼吸速率都显著增加。Reth等[30]在德国南部的模拟增温实验表明:经过10年的增温后,土壤呼吸速率依旧呈现增加趋势。Bond-Lamberty和Thomson[26]构建了覆盖全球的土壤呼吸数据库,研究发现:土壤呼吸速率与气温呈现不规则的显著正相关关系,在全球尺度上土壤呼吸的Q10值为1.5。此外,土壤呼吸的Q10值并不恒定,随温度条件不同而发生变化。Bond-Lamberty和Thomson[28]的研究发现:温度为0~10℃时,Q10平均值为3.3±1.5;5~15℃时,Q10平均值为2.9±1.2;10~20℃时,Q10平均值为2.6±1.1;而0~20℃时,Q10平均值为3.0±1.1。
1.2 气候变暖对土壤呼吸不同组分的影响
根据CO2产生的具体过程,土壤呼吸可划分为自养呼吸和异养呼吸[31-33]。自养呼吸主要来自根呼吸、根外菌根菌丝的呼吸(根源呼吸),异养呼吸来自于微生物对有机碳的分解[32-34]。Hanson等[31]的研究发现:随着植被类型及季节的变化,自养呼吸可占到土壤呼吸的10%~90%。由于产生CO2的具体过程的差异,自养呼吸和异养呼吸对增温的响应有可能不同[27,35-36]。Boone等[35]在美国马萨诸塞州混交阔叶林的研究发现,根呼吸对温度的敏感度高于非根际土壤。Schindlbacher等[36]的模拟增温实验也表明,增温前12h自养呼吸对温度响应较异养呼吸敏感,但是随后自养呼吸的Q10值开始降低,增温24h后与异养呼吸趋于一致。Wang等[27]对全球范围森林土壤呼吸的文献资料进行整理,却发现土壤异养呼吸对温度的敏感性要大于自养呼吸。也有一些研究结果表明,土壤自养呼吸和异养呼吸对增温响应没有区别[37-38]。目前关于土壤自养呼吸和异养呼吸对温度敏感性的研究结果差异较大[39],一般认为自养呼吸特别是根呼吸,对温度的响应较异养呼吸更加敏感,因为这些呼吸过程主要是以光合作用的初级产物为利用碳源的[34]。
当前对土壤呼吸不同组分温度敏感性进行研究的手段主要有:野外原位模拟增温观测[33,38]和微尺度控制试验(一般是通过设置控制试验对单株幼苗的不同土壤呼吸组分进行研究)[37]。前者容易受到温度以外的其他因素的干扰以及不同分组方法的局限;后者因为是对幼苗进行研究,很难真实的反映植物根系、根外菌根菌丝及土壤微生物之间的复杂相互作用关系。目前关于土壤呼吸不同组分的温度敏感性研究很多,但是受研究手段及分组方法不同的限制,许多研究之间无法进行比较,使得相关的研究进展缓慢。因此,积极探索新的研究手段,并对分组及研究手段进行统一是未来研究的重点。
2 土壤呼吸对气候变暖的适应及其适应机制
许多短期的增温实验表明,增温可以促进土壤呼吸,但是从长期来看这种作用是否能延续还不确定。近些年的研究结果表明,增温虽然可以在短期内促进土壤呼吸,但是随着时间的延长这种促进作用会慢慢的减弱,表现出一定的适应性[8,20-21]。Oechel等[20]观测到:20世纪80年代早期,由于气候变暖,位于阿拉斯加的北极苔原生态系统从碳汇转变为碳源,但是近40年的观测数据显示,在温度最高和最干旱的年份,北极生态系统在夏季竟然成为碳汇。Luo等[21]在美国大平原高草草原的增温实验发现,土壤呼吸对温度的敏感性随温度的升高而降低,并由此认为土壤呼吸对增温的适应性可能会缓和陆地生态系统对全球变暖的正反馈效应。Melillo等[8]在美国中纬度阔叶林布设了长达10年的增温实验,研究表明:虽然短期增温可以促进土壤碳排放,但是随着时间的延长,这种促进作用会慢慢减弱。Melillo等[8]从两个方面解释了这一现象:一方面由于土壤活性有机碳库的不足;另一方面因为中纬度森林存在氮限制,增温提高了氮素的有效性,可以在一定程度上促进碳的积累。Bradford等[40]在该点开展的长达15年的增温实验,也得到类似的结论,认为土壤呼吸对增温的适应性缘于土壤活性有机碳不足及土壤微生物对增温适应的综合作用[40]。
关于土壤呼吸对气候变暖适应机制的认识,目前尚未统一。刘洪升等[41-42]、徐小峰等[2]从“生物适应性”、“底物不足”、“氮素过量”及“水分限制”等方面对这一适应机制做了较为全面地归纳。本文也从上述4个角度对土壤呼吸对增温的适应机制进行阐述,其中有关氮素对土壤呼吸的调控机理有不一样的理解,故将“氮素过量”的表达改成了“氮素限制”。
1)土壤微生物适应性(thermal adaptation)。增温可以影响土壤微生物的生理功能,甚至改变微生物群落组成,从而使土壤呼吸对增温产生适应[5,40,43-44]。Zhang等[43]在美国大平原高草草原布设的增温实验表明:3年增温后,土壤微生物的群落结构发生了变化,真菌在群落中占的比例较细菌有明显升高。真菌的碳同化率一般较细菌高,即代谢时可同化较多的碳,释放较少的碳;且真菌的细胞壁主要由碳聚合物构成,相比于细菌的细胞壁(主要由磷脂和肽聚糖构成)更难分解。因此,以真菌为主导的生态系统的土壤呼吸速率一般较低[44]。Allison等[45]提出了微生物-酶模型,从土壤微生物和酶的角度分析了土壤呼吸对增温的适应机理。该模型的思路是:土壤有机碳首先要转化成可溶性有机碳才能被土壤微生物利用,土壤微生物生理特性的变化不仅直接导致其碳源利用效率的变化,同时还会通过控制胞外酶的释放来调控土壤有机碳向可溶性有机碳的转化。Allison等[45]认为,土壤呼吸对增温的适应源于土壤微生物生理功能、组成结构的改变和酶活性的降低。
2)底物不足(substrate-depletion)。许多土壤碳模型包括 Century模型[46]和 Roth-C模型[47],根据土壤有机碳分解的难易程度及周转时间将土壤碳库划分成活性、惰性等多个组分。一般认为惰性组分较活性组分难分解[22]。在增温初期,土壤活性有机质快速分解消耗,导致后期没有充足的活性有机碳作为底物来支持土壤呼吸,从而使土壤呼吸表现出适应性[40,48-49]。
3)氮素限制。以CO2为代表的温室气体浓度上升是气候变暖的主因[1]。CO2浓度的增加会促进植被的生长及根部分泌糖类、有机酸、氨基酸等根际物[50],在短期内提高微生物的活性;但从长期来看,植物的生长以及微生物活性的提高会加快氮素等矿质养分的固定,导致氮素等矿质元素不足,提高贫营养型微生物(例如真菌)在土壤微生物群落中的比例,使土壤呼吸产生适应性[5]。这种情况比较容易发生在氮素缺乏的环境中,例如温带森林[51]。此外,由于矿物燃料的燃烧以及化学肥料的施用[52],20世纪末大气中氮沉降量增加了3~5倍[53],这种天然的施肥作用将会对陆地生态系统特别是土壤的碳循环过程产生重要影响[54-55]。Janssens等[56]认为,除了在极端缺氮的情况下,氮沉降一般可以通过降低地下部分碳的分配量、改变土壤微生物的群落结构及促进土壤有机碳朝着更加难分解的方向转化来降低土壤呼吸速率。
4)水分限制。气候变暖会直接增加土壤水分的蒸散强度,同时会伴随着降水分布格局和强度的变化,使得土壤变得过干或者过湿。这一变化将引起土壤通气状况的变化,对土壤微生物及酶的活性产生影响[57-58]。Schjōnning等[59]的研究表明,增加土壤水分后,土壤的水解酶和过氧化物酶的活性明显降低。土壤过干还会通过抑制呼吸反应底物的扩散来降低土壤呼吸速率[31]。此外,土壤水分的变化,还会对土壤CO2扩散速率产生影响。
3 土壤微生物对气候变暖的响应
3.1 土壤微生物在土壤碳循环中的核心作用
土壤微生物是土壤有机碳分解的主体,同时也是土壤异养呼吸的主要来源,它在土壤碳氮循环及养分转化等关键生化过程中起着驱动作用[5,59],且对气候变化响应敏感[5]。气候变暖可以通过多种途径影响土壤微生物:1)气候变暖伴随的降水格局变化及极端气候可以通过改变土壤的温湿度直接影响微生物活性;2)气候变暖可以通过改变地表植被的代谢、生长及多样性,影响凋落物的质量,最终影响土壤的理化性质(例如,土壤含水量、C∶N),间接的对土壤微生物产生影响[50];3)作为气候变暖的主因,CO2浓度的升高可以增加光合作用促进植被生长,并促进光合作用产物向根部转移,对微生物产生影响[60-61]。土壤微生物反过来通过控制土壤有机碳分解速率直接对气候变暖产生反馈,这种反馈作用有可能加速或减缓气候变暖的进程。Allison等[45]认为土壤碳循环过程对增温的响应主要依赖于土壤微生物活性,并提出在采用模型对气候变化过程进行预测时必须考虑土壤微生物的反馈作用。Singh等[5]认为土壤微生物在调控温室气体排放中起着核心作用,提出通过合理管理和调控土壤微生物过程来降低温室气体排放前景广阔。可见深入研究气候变化背景下土壤微生物对土壤碳循环的调控作用及机理对于准确地预测气候变化过程具有重要意义[62]。
3.2 气候变暖对土壤微生物活性及群落结构的影响
近年来,关于土壤微生物对气候变暖响应的研究越来越受到重视,但是研究结果受研究区气候条件、生态及土壤类型、增温的幅度及时间等因素的影响差异较大[63-66]。一般认为,增温可以对高山区、寒区及温带地区生态系统的土壤微生物活性产生显著影响[5,66]。因为在这些区域,温度是最主要的环境限制因子。Fu等[63]在青藏高原北部的高山草甸的增温实验表明,经过2年增温后,增温2.54℃显著增加土壤微生物生物量,而增温4.99℃显著降低土壤微生物生物量。Rinnan等[64]在亚北极地区的苔原生态系统设置了长期增温实验,研究发现,增温5,6,10a后,土壤微生物对增温的响应并不明显,但是增温15a后,土壤微生物生物量较于对照明显降低。Zhang等[65]在内蒙古半干旱温带草原布设的增温实验表明,增温3年(增温2.32℃)后,土壤微生物生物量显著降低,但是增加降雨量显著增加了土壤微生物的生物量。因为在半干旱区土壤水分往往是主要的限制因子,增温后会导致土壤水分降低,抑制了土壤微生物的活性,当土壤水分恢复后,土壤微生物活性将增加。Liu等[66]也认为在半干旱温带草原土壤水分的有效性对土壤微生物的影响比温度大。理论上,短期的增温可以促进土壤微生物活性,而随着增温时间的延长或增温幅度变大,土壤微生物的活性会由于碳利用能力的降低[45]或可利用有机碳不足[67]而减弱。面对这种情况,土壤微生物可以通过改变生理功能,甚至群落组成而产生适应性[65]。
一些研究发现增温不仅可以改变土壤微生物的活性,还可以对其群落结构产生影响。Zhang等[43]在美国大平原高草草原的增温实验表明:增温后,土壤微生物生物量并没有显著变化,但是真菌在群落中所占的比例较细菌有明显升高。但Frey等[67]在美国哈佛森林和Rinnan等[64]在亚北极地区的苔原生态系统的长期增温实验都发现,长期增温后,土壤微生物中真菌的丰度降低。此外,土壤微生物种类繁多,不同种类微生物对增温的响应有可能不一样。Bardgett和Shine[68]采用模拟栽培试验研究了土壤微生物对增温的响应,发现:在增温前期,由于细菌的快速生长,微生物生物量不断增加,但是到后期生物量却下降,而真菌和放线菌基本无变化。Frey等[67]在美国哈佛森林的增温实验发现,长期增温后,真菌的丰度降低,但是革兰氏阳性细菌和放线菌丰度增加。因此,研究不同种类土壤微生物对增温的响应以及这一响应如何影响整个微生物群落对增温的响应显得十分必要。
3.3 分子生物学技术在土壤微生物研究中的应用
目前关于土壤微生物对气候变暖响应的认识还很模糊,仅仅对少数真菌和固氮细菌一些特性有所了解[5]。由于土壤微生物种类繁多,且很多微生物是不可培养的,采用传统的研究方法来研究土壤微生物组成及功能性状面临巨大的挑战。近年来,宏基因组学、稳定性同位素探测技术等生物学技术由于在研究不可培养微生物方面的独特优势,已经开始在土壤微生物领域应用[62]。宏基因组学是采用克隆技术直接从环境样品中提取全部微生物的DNA,构建宏基因组文库,利用基因组学的研究策略研究样品所包含的全部微生物的遗传组成及其群落功能[5]。稳定性同位素探测技术是通过在稳定性同位素富集的基质中培养土壤微生物,土壤中某些微生物会以基质中的稳定性同位素为碳源或氮源进行物质代谢,并参与DNA、RNA及磷脂脂肪酸等特定物质的合成,通过提取分析微生物体内被标记的生物标志物,从而将微生物的组成与其功能建立联系[69]。与基因组学相比,稳定性同位素探测技术由于可以根据具体功能分离出特定土壤微生物,明显降低了所需克隆的微生物数量;同时还可以将土壤微生物的种类与其功能建立联系,研究气候变暖背景下土壤微生物在土壤碳循环过程中的具体功能作用,在土壤微生物的研究中有着广阔的应用前景。
4 气候变暖背景下土壤有机碳分解温度敏感性的探讨
土壤有机碳是土壤呼吸的主要反应底物,土壤有机碳分解对增温的敏感性直接影响了土壤碳循环过程对气候变暖的响应。早期,一些模型对短期内土壤有机碳对增温敏感性的模拟主要是套用Arrhenius方程,或者简单的用参数Q10来表示,并将Q10值定为恒值2[70-71]。但是,土壤有机碳组成极度不均一,不同有机碳组分的周转时间从1a到6000a不等,将土壤有机碳视为一个简单的均质体来研究其对增温响应显然不合理,并且也无法解释长期增温后土壤呼吸表现出的适应性[47,72]。基于此,一些较为成熟的土壤碳模型,如Century模型和Roth-C模型,根据土壤有机碳分解的难易程度及周转时间将土壤碳划分成活性、惰性等多个组分[47-48]。一般认为惰性组分较活性组分难分解,有学者将长期增温后土壤呼吸表现出的适应性归结为由于长期增温消耗导致的活性有机碳不足,即“底物不足”机制[40,49]。
根据热动力学原理,化学结构越复杂、反应所需要活化能越高的物质对温度的响应越敏感[22,73]。土壤惰性有机碳组分化学结构较活性组分复杂,很多学者由此认为惰性有机碳组分对增温的响应较活性组分更敏感。近年来,越来越多研究结论印证了这一观点[72,74-77]。Hopkins等[77]采用碳同位素示踪方法研究了不同年龄土壤有机碳对温度的敏感性,发现:年龄大于10a的有机碳组分与小于10a的组分对温度的敏感性一样,其中年龄为7~13a的土壤有机碳对温度的敏感性最高。Knorr等[72]由此推断土壤有机碳分解对增温响应将长期敏感。针对这一观点,有些学者提出质疑,认为土壤有机碳惰性组分分解速率较活性组分要低得多,即便其对增温的敏感性较活性组分高,与活性有机碳相比惰性有机碳的分解速率仍可忽略[76]。例如,葡萄糖(活性组分)反应所需的激活能为30kJ/mol,增温2℃后反应速率增加10%;丹宁酸(惰性组分)反应所需的激活能为70kJ/mol,增温2℃后反应速率增加21%;但是葡萄糖的反应速率为丹宁酸的6500000倍,即便增温2℃后,葡萄糖的反应速率仍为丹宁酸的5800000倍多[22]。
由于植物残体的最初分解速率与其主要化学成分密切有关,如氮含量、木质素,一般认为土壤有机碳的分解速率也主要由其化学组成结构决定[78]。但是,近年来的研究却发现原本认为较难分解的木质素、植物脂质等有机碳组分竟然比其他组分分解得更快,并且一些较容易分解的活性有机碳组分,如糖类,也可以在土壤中储存数十年[79-82]。关于土壤有机碳对增温的敏感性也产生了一些新的认识,即:土壤有机碳分解对温度的敏感性不仅取决于化学组成结构,还取决于土壤矿质颗粒对其的物理化学保护作用,如团聚体的包裹、与土壤矿质颗粒的化学键吸附、冰冻作用[22,81-82]。因此,在定义土壤惰性有机碳组分时不仅要考虑化学组成结构,土壤矿质颗粒的物理化学保护作用、冰冻及干旱等环境因素也许要纳入考虑。Davidson和Janssens[22]认为环境因子的抑制作用,如干旱、洪水、冰冻,掩盖了土壤有机碳对增温敏感性,当这些环境因子被解除后,土壤有机碳对增温的敏感性将恢复。泥炭地、湿地及冻土区由于受到环境因子的抑制储蓄了大量的有机碳,气候变暖引起的增温干旱有可能使这些地区的碳排放剧增,对全球气候变化产生正反馈作用[22]。
土壤微生物以土壤有机碳为主要碳源进行物质代谢,并通过分泌酶参与土壤有机碳的解吸附、解聚、溶解等分解过程[76]。增温对土壤微生物及酶活性的影响必然直接决定着土壤有机碳对增温的响应。因此,在研究土壤有机质对增温的敏感性时,还必须考虑土壤微生物及分泌的酶对增温的响应。土壤有机碳的化学组成结构决定其潜在的热动力学性质,环境因素的保护作用决定土壤有机碳能否被微生物利用,土壤微生物的生理特性及组成结构决定其分解有机碳的能力及效率,这三者共同决定了土壤有机碳对增温的敏感性[45,76]。基于这一认识,很多学者提出了描述土壤有机碳分解过程对增温响应的概念模型。本文对其中有代表性的模型进行归纳(主要包括Conant等[76],Allison等[45]提出的模型),提出了土壤有机碳分解过程对增温响应概念模型(图1)。
5 气候变暖与CO2浓度升高、降水变化、氮沉降等气候变化因子之间的协同作用
由人类不合理活动引起的气候变暖是全球变化的主要表现之一。气候变暖同时伴随着CO2浓度升高、降水格局变化、氮沉降等多个全球变化过程。大量研究表明,这些过程相互作用通过直接或间接的方式共同影响着土壤碳循环过程[23]。
气候变暖、CO2浓度升高、降水格局变化、氮沉降等气候变化因子可以通过改变地上部分植被的生长及格局[83-84],影响碳的输入总量和质量,间接的影响土壤碳循环过程。一般情况下,气候变暖、CO2浓度升高、氮沉降都可以促进地表植被生长,提高初级生产力及凋落物量[2,23,56]。例如,Zhou等[85]在美国大平原南部的增温实验表明:增温可以延长植物生长季节,增加生物量;但是同时也促进物种组成朝C4植物转化,降低了凋落物的质量;由于C4植物的凋落物较难分解,虽然前期增温可以提高土壤氮的活性,从长远来看,土壤氮的有效性将降低。氮沉降则可以缓解土壤氮限制,并通过刺激叶片生长或光合作用酶的活性来促进光合作用,提高生产力,增加生态系统碳蓄积量[51,54-55]。Magnani等[54]甚至认为氮沉降是森林生态系统固碳的主要驱动力。氮沉降还可以通过影响凋落物的分解速率直接影响碳的输入量。一般认为,氮沉降会抑制低质量凋落物(低氮素木质素比)的分解,但是低水平的氮沉降可以促进高质量凋落物(高氮素木质素比)分解[56,80]。此外,气候变暖及降水格局的变化除了直接影响植被的生长及格局,还可以通过影响人为转变土地利用方式间接的影响土壤碳的输入[86]。
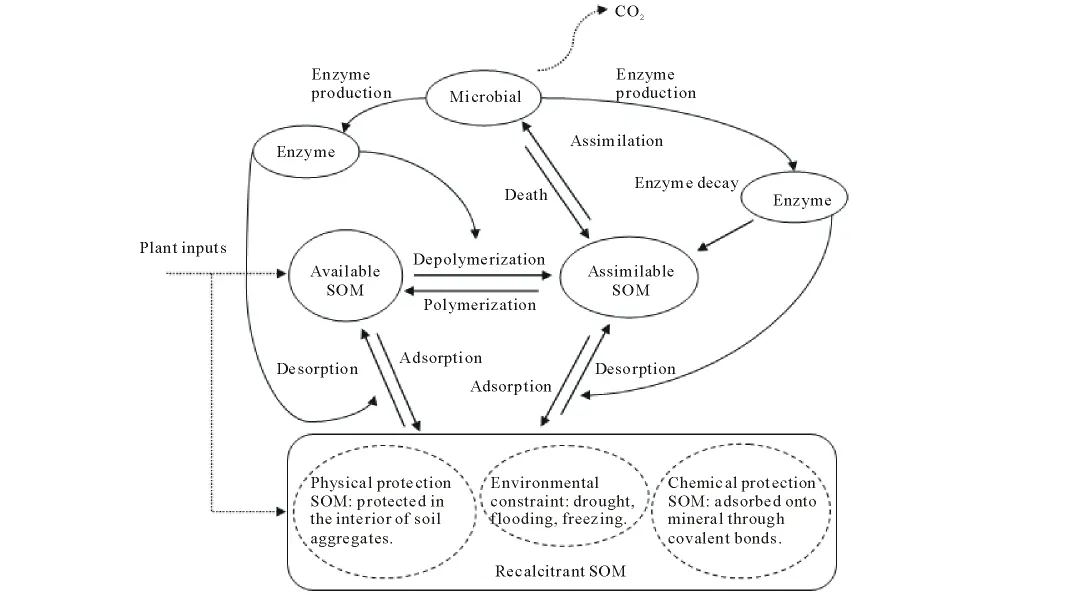
图1 土壤有机碳分解过程对增温响应概念模型[45,76]Fig.1 A conceptual model illustrating the response of soil organic matter decomposition to warming
气候变暖、CO2浓度升高、降水变化、氮沉降等气候变化因子还可以通过影响地下部分土壤有机碳的有效性及微生物的活性,直接影响土壤碳循环过程。增温可以提高土壤有机碳的活性,并通过改变土壤微生物生理活性及群落结构影响土壤呼吸及氮素等矿质元素的有效性。一般认为,短期的增温可以提高土壤微生物活性,但是长时间的增温或增温幅度较大时,土壤微生物的活性会受到抑制。CO2浓度的升高会促进植物生长及碳向地下部分转移,并促进根部释放糖类、有机酸、氨基酸等根际物[50],在短期内提高微生物的活性;但是从长期来看,植物的生长以及微生物活性的提高会加速氮素等矿质养分的固定,导致氮素等矿质元素不足[5]。氮沉降一般可以通过多种途径影响土壤的碳循环过程[56]:1)氮沉降可以促进植物碳向地上部分转移,降低地下根部碳的分配量,影响根系特别是菌根的活性,由于根系分泌的活性有机碳减少,土壤微生物的活性将受到抑制,导致土壤呼吸速率降低;2)氮沉降可以改变土壤微生物的群落结构,促进土壤微生物朝着碳利用率高的微生物(在分解有机碳时,同化较多的碳和氮,释放较少碳)种群转变;3)氮沉降可以增强土壤有机碳的化学固定,促进更多的有机碳转化为惰性有机碳。气候变暖及伴随的降水格局的变化,可以通过改变土壤水分含量及通气状况,影响土壤微生物及酶的活性,以及土壤CO2扩散速率[57-58]。此外,土壤过干还会通过抑制呼吸反应底物的扩散来降低土壤呼吸速率[31]。
以气候变暖为主要标志的气候变化通过多个驱动因子共同影响着土壤碳循环过程。目前相关的研究主要集中于单个因子,缺乏对多个气候变化因子之间相互作用的综合研究,使得很多研究结果很难真实的反映土壤碳循环过程对气候变化的响应,以致无法为气候变化过程准确的预测提供可靠的实验数据支撑[87]。因此,在研究气候变暖对土壤碳循过程的影响时,还需关注其他气候变化因子及它们之间的交互作用。
此外,土壤地上与地下部分紧密联系,是一个相互作用的有机整体[88]:地上部分的植物通过凋落物及根际分泌物向土壤输入碳,同时为土壤微生物提供代谢所需的营养;地下部分土壤微生物则通过分解土壤有机碳为植物提供养分,并以土壤呼吸的方式输出CO2;此外,地表植被的光合作用可以通过影响根系同化物的供应,调控根际分泌物,直接对根呼吸及根源呼吸产生影响[89]。地上部分及地下部分的相互作用共同影响着土壤碳的收支及碳循环过程。因此,在研究土壤碳循环过程对气候变暖响应时,必须系统的考虑地上部分、地下部分碳循环过程对气候变暖的响应。
6 结论及展望
气候变暖对土壤碳循环过程影响过程十分复杂。目前关于土壤碳循环过程对气候变暖响应已经开展了大量的研究,并达成了一些共识。本文对近年来相关的研究结果进行总结,得到以下主要结论:
1)土壤呼吸不同组分对气候变暖响应的敏感性有差异。一般认为,自养呼吸特别是根呼吸,由于直接以光合作用产物为利用碳源,对温度的响应较异养呼吸更加敏感。
2)气候变暖在短期内可以增强土壤呼吸,但随着时间延长会表现出适应性,这种适应性可能缘于土壤微生物的适应、土壤活性有机碳的不足、氮素等矿质元素及水分的限制;
3)不同种类微生物对气候变暖的响应有差异。气候变暖可以影响土壤微生物的生理活性,甚至改变其群落结构,从而使土壤呼吸对增温产生适应。
4)土壤有机碳分解对增温的敏感性由三方面因素决定:土壤有机碳的化学组成结构决定其潜在的热动力学性质;土壤矿质颗粒对其的物理化学保护作用,以及冰冻、干旱等环境因素的保护作用决定土壤有机碳能否有效的被微生物利用;土壤微生物的生理特性及群落组成决定土壤有机碳被利用的效率。
由于受研究手段的局限,相较于地表过程,目前关于土壤碳循环过程对气候变暖响应的认识仍存在较大分歧,且很多认识是基于短期的模拟增温实验,无法为气候变化过程的准确预测提供可靠的支持。因此,针对这些分歧开展长期定位实验研究,并不断的探索新的研究方法和手段是未来该领域的主要方向。具体有以下几个方面:
1)土壤微生物在土壤碳循环及养分转化等过程中扮演着关键作用,且对气候变化响应敏感。但现有的气候变化预测模型并没有将土壤微生物过程纳入考虑,很多模型只是简单基于热动力学方程,将土壤有机碳的分解与土壤碳库的大小建立关系,导致一些在土壤微生物领域的重要研究结论无法在气候变化模型中得到应用。因此,将土壤有机碳的分解过程与土壤微生物过程建立联系,并将其耦合到气候变化模型中显得十分必要。
2)目前关于土壤微生物组成结构及其功能性状的认识还很模糊,仅仅对少数真菌和固氮细菌一些特性有所了解。然而,土壤微生物种类繁多、功能各异,且很多微生物是不可培养的。这些问题给传统的研究方法带来了巨大的挑战。因此,积极探索新的研究方法和手段是应对这些挑战的主要途径。
3)以气候变暖为主要标志的气候变化通过CO2浓度升高、降水变化、氮沉降等多个过程共同影响着土壤碳循环。目前相关的研究主要集中于某一到两个因子,缺乏对多个气候变化因子之间相互作用综合研究。因此,在研究气候变暖对土壤碳循过程的影响时,还需设置长期定位实验,研究多个气候变化因子之间的综合作用。
4)土壤地上与地下部分是一个相互作用的有机整体。地上部分及地下部分的相互作用共同影响着土壤碳的收支及碳循环过程。因此,在研究土壤碳循环过程对气候变暖响应时,必须系统的考虑地上部分、地下部分生态过程对气候变暖的响应。
[1]Qin D,Plattner G K,Tignor M,et al.Climate Change 2013:the Physical Science Basis[M].Cambridge and New York:Cambridge University Press,2014.
[2]Xu X F,Tian H Q,Wan S Q.Climate warming impacts on carbon cycling in terrestrial ecosystems.Journal of Plant Ecology,2007,31(2):175-188.
[3]Walther G R,Post E,Convey P,et al.Ecological responses to recent climate change.Nature,2002,416(6879):389-395.
[4]Nemani R R.Climate-driven increases in global terrestrial net primary production from 1982to 1999.Science,2003,300(5625):1560-1563.
[5]Singh B K,Bardgett R D,Smith P,et al.Microorganisms and climate change:terrestrial feedbacks and mitigation options.Nature Reviews Microbiology,2010,8(11):779-790.
[6]Grogan P,Chapin III F S.Initial effects of experimental warming on above-and belowground components of net ecosystem CO2exchange in Arctic tundra.Oecologia,2000,125(4):512-520.
[7]Johnson L C,Shaver G R,Cades D H,et al.Plant carbon-nutrient interactions control CO2exchange in Alaskan wet sedge tundra ecosystems.Ecology,2000,81(2):453-469.
[8]Melillo J M,Morrisseau S,Steudler P A,et al.Soil warming and carbon-cycle feedbacks to the climate system.Science,2002,298(5601):2173-2176.
[9]Rustad L,Campbell J,Marion G,et al.A meta-analysis of the response of soil respiration,net nitrogen mineralization,and aboveground plant growth to experimental ecosystem warming.Oecologia,2001,126(4):543-562.
[10]Welker J M,Fahnestock J T,Henry G H R,et al.CO2exchange in three Canadian High Arctic ecosystems:response to long-term experimental warming.Global Change Biology,2004,10(12):1981-1995.
[11]Huntington T G.Evidence for intensification of the global water cycle:review and synthesis.Journal of Hydrology,2006,319(1):83-95.
[12]Llorens L,Penuelas J,Beier C,et al.Effects of an experimental increase of temperature and drought on the photosynthetic performance of two ericaceous shrub species along a north-south European gradient.Ecosystems,2004,7(6):613-624.
[13]Wan S,Luo Y,Wallace L L.Changes in microclimate induced by experimental warming and clipping in tallgrass prairie.Global Change Biology,2002,8(8):754-768.
[14]Luo Y.Terrestrial carbon-cycle feedback to climate warming.Annual Review of Ecology,Evolution,and Systematics,2007,38(1):683-712.
[15]Wang Y X,Zhao S D,Niu D.Research state of soil carbon cycling in terrestrial ecosystem.Chinese Journal of Ecology,1999,18(5):29-35.
[16]Qin Y,Yi S H,Li N J.Advance in studies of carbon cycling on alpine grasslands of the Qinghai-Tibetan Plateau.Acta Prataculturae Sinica,2012,21(6):275-285.
[17]Post W M,Emanuel W R,Zinke P J,et al.Soil carbon pools and world life zones.Nature,1982,298(5870):156-159.
[18]Cox P M,Betts R A,Jones C D,et al.Acceleration of global warming due to carbon-cycle feedbacks in a coupled climate model.Nature,2000,408(6809):184-187.
[19]Friedlingstein P,Fung I,Bala G,et al.Climate-carbon cycle feedback analysis:results from the C4MIP model inter comparison.Journal of Climate,2006,19(14):3337-3353.
[20]Oechel W C,Vourlitis G L,Hastings S J,et al.Acclimation of ecosystem CO2exchange in the Alaskan Arctic in response to decadal climate warming.Nature,2000,406(6799):978-981.
[21]Luo Y,Wan S,Hui D,et al.Acclimatization of soil respiration to warming in a tall grass prairie.Nature,2001,413(6856):622-625.
[22]Davidson E A,Janssens I A.Temperature sensitivity of soil carbon decomposition and feedbacks to climate change.Nature,2006,440(7081):165-173.
[23]Balser T C,Gutknecht J L M,Liang C.How Will Climate Change Impact Soil Microbial Communities[M].Berlin:Springer Netherlands,2010:373-397.
[24]Schimel D S,House J I,Hibbard K A,et al.Recent patterns and mechanisms of carbon exchange by terrestrial ecosystems.Nature,2001,414(6860):169-172.
[25]Raich J W,Potter C S,Bhagawati D.Inter annual variability in global soil respiration,1980-94.Global Change Biology,2002,8(8):800-812.
[26]Bond-Lamberty B,Thomson A.Temperature-associated increases in the global soil respiration record.Nature,2010,464(7288):579-582.
[27]Wang W,Chen W L,Wang S P.Forest soil respiration and its heterotrophic and autotrophic components:global patterns and responses to temperature and precipitation.Soil Biology and Biochemistry,2010,42(8):1236-1244.
[28]Bond-Lamberty B,Thomson A.A global database of soil respiration data.Biogeosciences,2010,7(6):1915-1926.
[29]Zhou P,Liu G B,Xue S.Review of soil respiration and the impact factors on grassland ecosystem.Acta Prataculturae Sinica,2009,18(2):184-193.
[30]Reth S,Graf W,Reichstein M,et al.Sustained stimulation of soil respiration after 10years of experimental warming.Environmental Research Letters,2009,4(2):24005.
[31]Hanson P J,Edwards N T,Garten C T,et al.Separating root and soil microbial contributions to soil respiration:a review of methods and observations.Biogeochemistry,2000,48(1):115-146.
[32]Bond-Lamberty B,Wang C,Gower S T.A global relationship between the heterotrophic and autotrophic components of soil respiration.Global Change Biology,2004,10(10):1756-1766.
[33]Subke J A,Inglima I,Francesca Cotrufo M.Trends and methodological impacts in soil CO2efflux partitioning:a meta analytical review.Global Change Biology,2006,12(6):921-943.
[34]Kuzyakov Y,Gavrichkova O.Review:time lag between photosynthesis and carbon dioxide efflux from soil:a review of mechanisms and controls.Global Change Biology,2010,16(12):3386-3406.
[35]Boone R D,Nadelhoffer K J,Canary J D,et al.Roots exert a strong influence on the temperature sensitivity of soil respiration.Nature,1998,396(6711):570-572.
[36]Schindlbacher A,Zechmeister-Boltenstern S,Kitzler B,et al.Experimental forest soil warming:response of autotrophic and heterotrophic soil respiration to a short-term 10℃temperature rise.Plant and Soil,2008,303(1):323-330.
[37]B..th E,Wallander H.Soil and rhizosphere microorganisms have the same Q10for respiration in a model system.Global Change Biology,2003,9(12):1788-1791.
[38]Irvine J,Law B E,Kurpius M R.Coupling of canopy gas exchange with root and rhizosphere respiration in a semi-arid forest.Biogeochemistry,2005,73(1):271-282.
[39]Wei Y Y,Yin H J,Liu Q,et al.Advance in research of forest carbon cycling under climate warming.Chinese Journal of Applied Environmental Biology,2009,15(6):888-894.
[40]Bradford M A,Davies C A,Frey S D,et al.Thermal adaptation of soil microbial respiration to elevated temperature.Ecology Letters,2008,11(12):1316-1327.
[41]Liu H S,Liu H J,Wang Z P,et al.The temperature sensitivity of soil respiration.Progress in Geography,2008,27(4):51-60.
[42]Yang Y,Huang M,Liu H S,et al.The interrelation between temperature sensitivity and adaptability of soil respiration.Journal of Natural Resources,2011,26(10):1812-1820.
[43]Zhang W,Parker K M,Luo Y,et al.Soil microbial responses to experimental warming and clipping in a tall grass prairie.Global Change Biology,2005,11(2):266-277.
[44]Six J,Frey S D,Thiet R K,et al.Bacterial and fungal contributions to carbon sequestration in agroecosystems.Soil Science Society of America Journal,2006,70(2):555-569.
[45]Allison S D,Wallenstein M D,Bradford M A.Soil-carbon response to warming dependent on microbial physiology.Nature Geoscience,2010,3(5):336-340.
[46]Allison S D,Treseder K K.Warming and drying suppress microbial activity and carbon cycling in boreal forest soils.Global Change Biology,2008,14(12):2898-2909.
[47]Parton W J,Schimel D S,Cole C V,et al.Analysis of factors controlling soil organic matter levels in Great Plains grasslands.Soil Science Society of America Journal,1987,51(5):1173-1179.
[48]Jenkinson D S,Andrew S P S,Lynch J M,et al.The turnover of organic carbon and nitrogen in soil.Philosophical Transactions of the Royal Society of London Series B-biological Sciences,1990,329(1255):361-368.
[49]Hartley I P,Heinemeyer A,Ineson P.Effects of three years of soil warming and shading on the rate of soil respiration:substrate availability and not thermal acclimation mediates observed response.Global Change Biology,2007,13(8):1761-1770.
[50]Bardgett R D,De Deyn G B,Ostle N J.Plant-soil interactions and the carbon cycle.Journal of Ecology,2009,97(5):838-839.
[51]Janssens I A,Luyssaert S.Carbon cycle:nitrogen’s carbon bonus.Nature Geoscience,2009,2(5):318-319.
[52]Davidson E A.The contribution of manure and fertilizer nitrogen to atmospheric nitrous oxide since 1860.Nature Geoscience,2009,2(9):659-662.
[53]IPCC.Climate Change 2007:The Physical Science Basis[M].Cambridge:Cambridge University Press,2007.
[54]Magnani F,Mencuccini M,Borghetti M,et al.The human footprint in the carbon cycle of temperate and boreal forests.Nature,2007,447(7146):849-851.
[55]Thomas R Q,Canham C D,Weathers K C,et al.Increased tree carbon storage in response to nitrogen deposition in the US.Nature Geoscience,2010,3(1):13-17.
[56]Janssens I A,Dieleman W,Luyssaert S,et al.Reduction of forest soil respiration in response to nitrogen deposition.Nature Geoscience,2010,3(5):315-322.
[57]Fierer N,Schimel J P,Holden P A.Influence of drying-rewetting frequency on soil bacterial community structure.Microbial Ecology,2003,45(1):63-71.
[58]Waldrop M P,Firestone M K.Altered utilization patterns of young and old soil C by microorganisms caused by temperature shifts and N additions.Biogeochemistry,2004,67(2):235-248.
[59]Schjōnning P,Thomsen I K,Moldrup P,et al.Linking soil microbial activity to water-and air-phase contents and diffusivities.Soil Science Society of America Journal,2003,67(1):156-165.
[60]H9gberg P,Read D J.Towards a more plant physiological perspective on soil ecology.Trends in Ecology & Evolution,2006,21(10):548-554.
[61]Keel S G,Siegwolf R T W,K9rner C.Canopy CO2enrichment permits tracing the fate of recently assimilate carbon in a mature deciduous forest.New Phytologist,2006,172(2):319-329.
[62]Todd-Brown K E O,Hopkins F M,Kivlin S N,et al.A framework for representing microbial decomposition in coupled climate models.Biogeochemistry,2012,109(1-3):19-33.
[63]Fu G,Shen Z,Zhang X,et al.Response of soil microbial biomass to short-term experimental warming in alpine meadow on the Tibetan Plateau.Applied Soil Ecology,2012,61:158-160.
[64]Rinnan R,Michelsen A,B..th E,et al.Fifteen years of climate change manipulations alter soil microbial communities in a subarctic heath ecosystem.Global Change Biology,2007,13(1):28-39.
[65]Zhang N,Liu W,Yang H,et al.Soil microbial responses to warming and increased precipitation and their implications for ecosystem C cycling.Oecologia,2013,173(3):1125-1142.
[66]Liu W,Zhang Z H E,Wan S.Predominant role of water in regulating soil and microbial respiration and their responses to climate change in a semiarid grassland.Global Change Biology,2009,15(1):184-195.
[67]Frey S D,Drijber R,Smith H,et al.Microbial biomass,functional capacity,and community structure after 12years of soil warming.Soil Biology and Biochemistry,2008,40(11):2904-2907.
[68]Bardgett R D,Shine A.Linkages between plant litter diversity,soil microbial biomass and ecosystem function in temperate grasslands.Soil Biology and Biochemistry,1999,31(2):317-321.
[69]Ge Y,He J Z,Zheng Y M,et al.Stable isotope probing and its applications in microbial ecology.Acta Ecologica Sinica,2006,26(5):1574-1582.
[70]Lloyd J,Taylor J A.On the temperature dependence of soil respiration.Functional Ecology,1994,8(3):315-323.
[71]Trumbore S E,Chadwick O A,Amundson R.Rapid exchange between soil carbon and atmospheric carbon dioxide driven by temperature change.Science,1996,272(5260):393-396.
[72]Knorr W,Prentice I C,House J I,et al.Long-term sensitivity of soil carbon turnover to warming.Nature,2005,433(7023):298-301.
[73]Wagai R,Kishimoto-Mo A W,Yonemura S,et al.Linking temperature sensitivity of soil organic matter decomposition to its molecular structure,accessibility,and microbial physiology.Global Change Biology,2013,19(4):1114-1125.
[74]Coxall H K,Wilson P A,P-like H,et al.Rapid stepwise onset of Antarctic glaciation and deeper calcite compensation in the Pacific Ocean.Nature,2005,433(7021):53-57.
[75]Conant R T,Steinweg J M,Haddix M L,et al.Experimental warming shows that decomposition temperature sensitivity increases with soil organic matter recalcitrance.Ecology,2008,89(9):2384-2391.
[76]Conant R T,Ryan M G,gren G I,et al.Temperature and soil organic matter decomposition rates-synthesis of current knowledge and a way forward.Global Change Biology,2011,17(11):3392-3404.
[77]Hopkins F M,Torn M S,Trumbore S E.Warming accelerates decomposition of decades-old carbon in forest soils.Proceedings of the National Academy of Sciences,2012,109(26):E1753-E1761.
[78]Melillo J M,Aber J D,Muratore J F.Nitrogen and lignin control of hardwood leaf litter decomposition dynamics.Ecology,1982,63(3):621-626.
[79]Marschner B,Brodowski S,Dreves A,et al.How relevant is recalcitrance for the stabilization of organic matter in soils.Journal of Plant Nutrition and Soil Science,2008,171(1):91-110.
[80]Knorr M,Frey S D,Curtis P S.Nitrogen additions and litter decomposition:a meta-analysis.Ecology,2005,86(12):3252-3257.
[81]Schmidt M W I,Torn M S,Abiven S,et al.Persistence of soil organic matter as an ecosystem property.Nature,2011,478(7367):49-56.
[82]Kleber M,Nico P S,Plante A,et al.Old and stable soil organic matter is not necessarily chemically recalcitrant:implications for modeling concepts and temperature sensitivity.Global Change Biology,2011,17(2):1097-1107.
[83]Peng H Y,Li X Y,Tong S Y.Advance in shrub encroachment in arid and semiarid region.Acta Prataculturae Sinica,2014,23(2):313-322.
[84]Yan Z Q,Qi Y C,Dong Y S,et al.Nitrogen cycling in grassland ecosystems in response to climate change and human activities.Acta Prataculturae Sinica,2014,23(6):279-292.
[85]Zhou X,Liu X,Wallace L L,et al.Photosynthetic and respiratory acclimation to experimental warming for four species in a tallgrass prairie ecosystem.Journal of Integrative Plant Biology,2007,49(3):270-281.
[86]Jolankai M,Birkás M.Global climate change impacts on crop production in Hungary.Agriculturae Conspectus Scientificus,2007,72(1):17-20.
[87]Fan Y J,Hou X Y,Shi H X,et al.Effect of carbon cycling in grassland ecosystems on climate warming.Acta Prataculturae Sinica,2012,21(3):294-302.
[88]Jiang J,Song M H.Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling.Chinese Journal of Plant Ecology,2010,34(8):979-988.
[89]Jing Y L,Guan D X,Wu J B,et al.Research progress on photosynthesis regulating and controlling soil respiration.Chinese Journal of Applied Ecology,2013,(1):269-276.
参考文献:
[2]徐小锋,田汉勤,万师强.气候变暖对陆地生态系统碳循环的影响.植物生态学报,2007,31(2):175-188.
[15]汪业勖,赵士洞,牛栋.陆地土壤碳循环的研究动态.生态学杂志,1999,18(5):29-35.
[16]秦彧,宜树华,李乃杰.青藏高原草地生态系统碳循环研究进展.草业学报,2012,21(6):275-285.
[29]周萍,刘国彬,薛萐.草地生态系统土壤呼吸及其影响因素研究进展.草业学报,2009,18(2):184-193.
[39]卫云燕,尹华军,刘庆,等.气候变暖背景下森林土壤碳循环研究进展.应用与环境生物学报,2009,15(6):888-894.
[41]刘洪升,刘华杰,王智平,等.土壤呼吸的温度敏感性.地理科学进展,2008,27(4):51-60.
[42]杨毅,黄玫,刘洪升,等.土壤呼吸的温度敏感性和适应性研究进展.自然资源学报,2011,26(10):1812-1820.
[69]葛源,贺纪正,郑袁明,等.稳定性同位素探测技术在微生物生态学研究中的应用.生态学报,2006,26(5):1574-1582.
[83]彭海英,李小雁,童绍玉.干旱半干旱区草原灌丛化研究进展.草业学报,2014,23(2):313-322.
[84]闫钟清,齐玉春,董云社,等.草地生态系统氮循环关键过程对全球变化及人类活动的响应与机制.草业学报,2014,23(6):279-292.
[87]范月君,侯向阳,石红霄,等.气候变暖对草地生态系统碳循环的影响.草业学报,2012,21(3):294-302.
[88]蒋婧,宋明华.植物与土壤微生物在调控生态系统养分循环中的作用.植物生态学报,2010,34(8):979-988.
[89]井艳丽,关德新,吴家兵,等.光合作用调控土壤呼吸研究进展.应用生态学报,2013,(1):269-276.
