细胞自噬对牛病毒性腹泻病毒复制的影响
2015-03-27宫晓炜郑福英陈启伟刘永生李兆才周继章才学鹏
宫晓炜,郑福英,陈启伟,刘永生,李兆才,周继章,才学鹏,殷 宏
(中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室 草食动物细菌病创新团队,兰州 730046)
细胞自噬对牛病毒性腹泻病毒复制的影响
宫晓炜,郑福英,陈启伟,刘永生*,李兆才,周继章*,才学鹏,殷 宏
(中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室 草食动物细菌病创新团队,兰州 730046)
本研究旨在了解牛病毒性腹泻病毒(BVDV)诱导的细胞自噬在病毒感染过程中所起的作用。用Oregon C24V株感染MDBK细胞,以Western blot、间接免疫荧光、透射电镜三种方法鉴定细胞自噬的产生;通过自噬抑制药物Wortmannin和自噬基因Beclin-1的RNAi干扰阻断自噬,探究自噬对BVDV复制的影响。结果显示,病毒感染可以引起LC3I向LC3Ⅱ的转化及p62的降解;转染GFP-LC3质粒的细胞,在病毒感染后出现增多的聚集颗粒;透射电镜能观察到细胞中出现大量的双层膜结构;此外,抑制细胞自噬或干扰Beclin-1的表达,细胞上清中病毒的滴度及病毒蛋白质的表达量都有所降低。BVDV感染早期可以诱导自噬的产生,且自噬对病毒的复制有利。
牛病毒性腹泻病毒;细胞自噬;病毒复制
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)是一种有包膜的单股正链RNA病毒,为黄病毒科瘟病毒属成员[1]。BVDV感染动物能引起以急慢性黏膜病、持续性感染和免疫抑制为主要特征的传染性疾病[2]。近二十多年来,欧盟多个国家采取了净化BVDV的措施,包括持续性感染动物的检测和清除、疫苗保护性的提高及严格的生物安全操作,取得了不错的效果,但流行病学调查数据显示,BVDV感染在全球流行的形势依然严峻,如亚洲、中欧、美洲等[3-6]。在中国,BVDV的流行也明显呈上升趋势[7-8]。目前,从宿主角度研究黄病毒科病毒致病机制的报道越来越多,但探索与BVDV复制相关的研究极为有限。
自噬是一种进化保守的细胞自救行为,对维持细胞稳态和应激条件下细胞的存活有重要意义[9]。目前已鉴定的自噬相关基因(ATGs)有36个,它们通过多种机制严格调控细胞自噬,包括自噬空泡和自噬溶酶体的形成[10]。而作为真核细胞早期的保护防御机制,细胞自噬可通过相应机制清除胞内病原体,水泡性口炎病毒(VSV)和裂谷热病毒(RVFV)感染诱导的自噬能有效抑制病毒复制[11-12]。但也有许多病毒,如猪瘟病毒(CSFV)、柯萨奇病毒B3(CVB3)、丙型肝炎病毒(HCV)、乙型脑炎病毒(JEV)、登革热病毒(DV)可进化出各种不同的机制来破坏、逃避和抑制细胞自噬,甚至会利用自噬来增强自身的繁殖能力[13-16]。
鉴于细胞自噬在病毒感染中的重要调节作用,本试验用BVDV Oregon C24V感染MDBK细胞,检测细胞内自噬空泡的形成及自噬相关蛋白质的表达;并通过影响自噬产生的信号通路,明确自噬与病毒复制之间的关系。
1 材料与方法
1.1 毒株和细胞株
Oregon C24V毒株购于中国兽医药品监察所;MDBK细胞为笔者实验室保存。
1.2 质粒和相关抗体
兔抗-LC3B多克隆抗体(Anti-LC3B antibody produced in rabbit,L7543)购自Sigma公司;兔源BECN1(H-300)抗体购自SANTA GRUZ公司;Anti-p62/SQSTM1购自MBL公司;小鼠抗β-actin单克隆抗体和山羊抗兔IgG-HRP购自Earthox公司;羊抗兔IgG-TRITC抗体购自北京康为世纪生物科技有限公司;兔抗Npro多克隆抗体、pEGFP-N1-LC3质粒为笔者实验室制备。
1.3 相关试剂
雷帕霉素(Rapamycin,R0395)和Wortmannin(W1628)为Sigma公司产品;Trizol Reagent、脂质体2000(Lipofectamin 2000 Reagent)为Invitrigen公司产品;X-tremeGENE siRNA Transfection Reagent为罗氏公司产品;OPTI-MEM培养基为Gibco公司产品;DAPI封片剂为Southern Biotech公司产品。
1.4 Western blot检测LC3脂酰化及Npro蛋白的表达
1.4.1 接毒和细胞处理 将待接毒和处理的细胞铺于细胞板,当细胞密度达80%~90%时,用感染复数MOI为1的BVDV感染MDBK细胞,37 ℃吸附2 h,然后弃掉含病毒的液体,加入完全培养基培养;在不同的时间点收取细胞;试验中阳性对照组加入100 nmol·L-1的Rapamycin,阴性对照不感染BVDV。
1.4.2 细胞样品制备及检测 收集细胞沉淀,加入细胞裂解液混匀沉淀,冰上裂解40 min,12 000 r·min-1离心10 min后移出上清,进行SDS-PAGE电泳。转膜后,用5%的脱脂奶粉封闭2 h,兔抗-LC3B多克隆抗体(1∶1 000稀释)和兔抗Npro多克隆抗体(1∶200稀释)作为一抗37 ℃孵育2 h;山羊抗兔IgG-HRP(1∶10 000稀释)作为二抗37 ℃孵育45 min;最后利用ECL显色液进行X光胶片曝光。
1.5 Wortmannin处理对LC3脂酰化及Npro蛋白表达的影响
将待接毒和处理的细胞铺于细胞板,当细胞密度达80%~90%时,预先在培养基中添加100 nmol·L-1的Wortmannin,处理4 h,然后用感染复数MOI为1的BVDV感染MDBK细胞,37 ℃吸附2 h,弃掉含毒的液体,加入完全培养基培养;阳性对照组加入100 nmol·L-1的Rapamycin,阴性对照组接毒后不加Wortmannin;其余方法同1.4.2。
1.6 检测GFP-LC3在细胞中的聚集
1.6.1 pEGFP-N1-LC3质粒的转染 将待接毒和处理的细胞铺于细胞板,细胞密度达80%~90%时,使用Lipofectamin 2000转染试剂,按质粒∶Lipofectamin 2000 = 1∶2的比例进行转染。
1.6.2 接毒和细胞的处理 Rapamycin阳性对照组:质粒转染之前预先在培养基中添加100 nmol·L-1的Rapamycin,处理2 h后,用相同浓度的完全培养基培养;病毒感染组:待转染质粒后24 h,细胞接毒;阴性对照组:单转质粒的正常细胞。
1.6.3 间接免疫荧光检测 pEGFP-LC3转染后的细胞用4%多聚甲醛室温固定30 min;0.1%的Triton X-100透化15 min;10%的羊血清室温封闭2 h;兔抗Npro多克隆抗体(1∶200稀释)作为一抗37 ℃孵育2 h;羊抗兔IgG-TRITC(1∶100稀释)作为二抗37 ℃孵育45 min;最后用DAPI染色并封片,并在荧光显微镜下观察拍照。
1.7 透射电镜观察自噬体的形成
收集感染组、阴性和阳性对照组的细胞,用2.5%的戊二醛4 ℃固定4 h,1%的锇酸室温固定2 h,经乙醇梯度脱水和丙酮置换,对样品进行包埋、修块和切片;经醋酸双氧铀和柠檬酸铅染色后在透射电镜下进行观察。
1.8 Western blot检测p62的降解
方法同1.4.1,不感染病毒的细胞为阴性对照组;细胞样品进行Western blot时,Anti-p62/SQSTM1(1∶1 000稀释)作为一抗,山羊抗兔IgG-HRP(1∶10 000稀释)作为二抗。
1.9Beclin-1的干扰对LC3脂酰化及病毒复制的影响1.9.1Beclin-1的RNA干扰 所用Beclin-1的干扰性小RNA(siRNA)分子浓度为200 nmol·L-1,采用两条Beclin-1干扰siRNA,其核苷酸序列:GAGCTTCAAGATTCTGGACCGTGT(siBeclin-1-1)和CACCATCCAGGAGCTCACAGCTC(siBeclin-1-2),由南京金斯瑞生物科技有限公司合成。转染细胞时,按说明书推荐的比例,用相应体积的OPTI-MEM分别稀释siRNA和X-tremeGENE siRNA Transfection regent,试验中设置阴性对照组即转染无序的siRNA;细胞接毒同方法1.4.1。
1.9.2 BVDV滴度的测定 用无血清的DMEM将病毒做连续10倍的稀释,从10-1到10-10;接种96孔的细胞培养板中,每个稀释度接种一纵排,共8个孔,每孔100 μL,最后两纵排为正常细胞对照;逐日观察细胞5~7 d并记录细胞病变的结果,按Reed-Muench法计算病毒滴度。
1.9.3 Western blot检测 方法同1.4.1,其中兔抗LC3多克隆抗体(1∶1 000稀释)、兔抗Beclin-1多克隆抗体(1∶1 000稀释)和兔抗Npro多克隆抗体(1∶200稀释)作为一抗,山羊抗兔IgG-HRP(1∶10 000稀释)作为二抗。
2 结 果
2.1 病毒感染对LC3脂酰化及Npro蛋白表达的影响
以自噬诱导剂Rapamycin诱导的细胞为阳性对照组,未处理的细胞为阴性对照组;用Oregon C24V毒株感染MDBK细胞,在感染后12、24、36 h分别收集细胞,检测自噬蛋白LC3Ⅱ的表达,与阴性对照组相比,结果显示(图1):BVDV感染细胞后24 h,形成脂酰化的LC3(LC3Ⅱ),而在感染36 h,LC3Ⅱ的水平与对照组相比无差别,说明在BVDV感染早期,可以诱导细胞发生自噬。同时,用兔抗Npro多克隆抗体检测病毒蛋白质表达的情况,发现LC3Ⅱ水平的增高与Npro蛋白的表达呈正相关。

图1 Western blot检测LC3I向LC3Ⅱ的转化及Npro蛋白的表达Fig.1 Westen blot analysis of the coversion of LC3Ito LC3Ⅱ and expression of Npro
2.2 Wortmannin处理对LC3脂酰化及Npro蛋白表达的影响
从2.1结果中得知,病毒感染24 h可以诱导细胞自噬的产生,因此用Wortmannin处理细胞,结果表明(图2),处理后的细胞在BVDV感染24 h,LC3Ⅱ的含量明显减少,说明Wortmannin的确阻断了自噬的发生,而对应的Npro蛋白含量显著降低,说明病毒的复制依赖细胞自噬的发生。
2.3 检测EGFP-LC3在细胞中的聚集
pEGFP-N1/LC3瞬时转染MDBK细胞,24 h后用Oregon C24V感染细胞;感染24 h后,通过荧光显微镜观察EGFP荧光是否形成点状分布。结果证明(图3),用Rapamycin处理的阳性细胞和BVDV感染的细胞中有EGFP-LC3点状聚集,而在阴性处理组中EGFP荧光是呈弥散状分布的;进一步证实,BVDV感染24 h可以促进细胞发生自噬。

图2 Western blot检测Wortamannin处理后LC3I向LC3Ⅱ的转化及Npro蛋白的表达Fig.2 Westen blot analysis of the coversion of LC3Ito LC3Ⅱ and expression of Npro in the presence of Wortamannin

图3 EGFP-LC3在感染细胞中的分布Fig.3 The redisturbution of EGFP-LC3 in BVDV-infected cells
2.4 透射电镜观察自噬体
为了在超微水平检测自噬体的形成,利用透射电镜对Rapamycin阳性对照组、病毒感染组和阴性对照组的细胞进行观察;结果发现(图4),Rapamycin组和病毒感染组均能诱导细胞出现双层膜的典型自噬体结构,如自噬体包裹溶酶体和线粒体(C、E),自噬体与溶酶体融合(F)。而相比之下,阴性对照组的细胞质内未见到双层膜的结构出现。
2.5 Western blot检测p62的降解
p62/SQSTM1蛋白在细胞自噬过程中插入自噬小体,连接LC3和泛素化底物,随后被自噬溶酶体降解。因此,p62的特异性降解代表了完整自噬的形成。通过Western blot检测了BVDV感染过程中p62蛋白的水平;其中对照组的细胞培养24 h进行收集,试验组分别在BVDV感染后 6、12和24 h收取样品;结果表明(图5)病毒感染24 h发生p62蛋白的降解,进一步证实BVDV感染增加了细胞的基本自噬,并诱导了自噬流量的产生。
2.6 Beclin-1的干扰对LC3脂酰化及病毒复制的影响 2.6.1 Beclin-1的RNA干扰 为进一步说明细胞自噬在BVDV复制中所起的作用,通过RNAi技术对Beclin-1基因进行了干扰,Western blot结果证实(图6),相比转染无序siRNA的MDBK,设计的siRNA可以有效地干扰内源性Beclin-1蛋白的表达。

图4 透射电镜观察细胞内自噬样空泡的形成Fig.4 The autophagosome-like vesicle formation in MDBK cells observed by transmission electron microscope
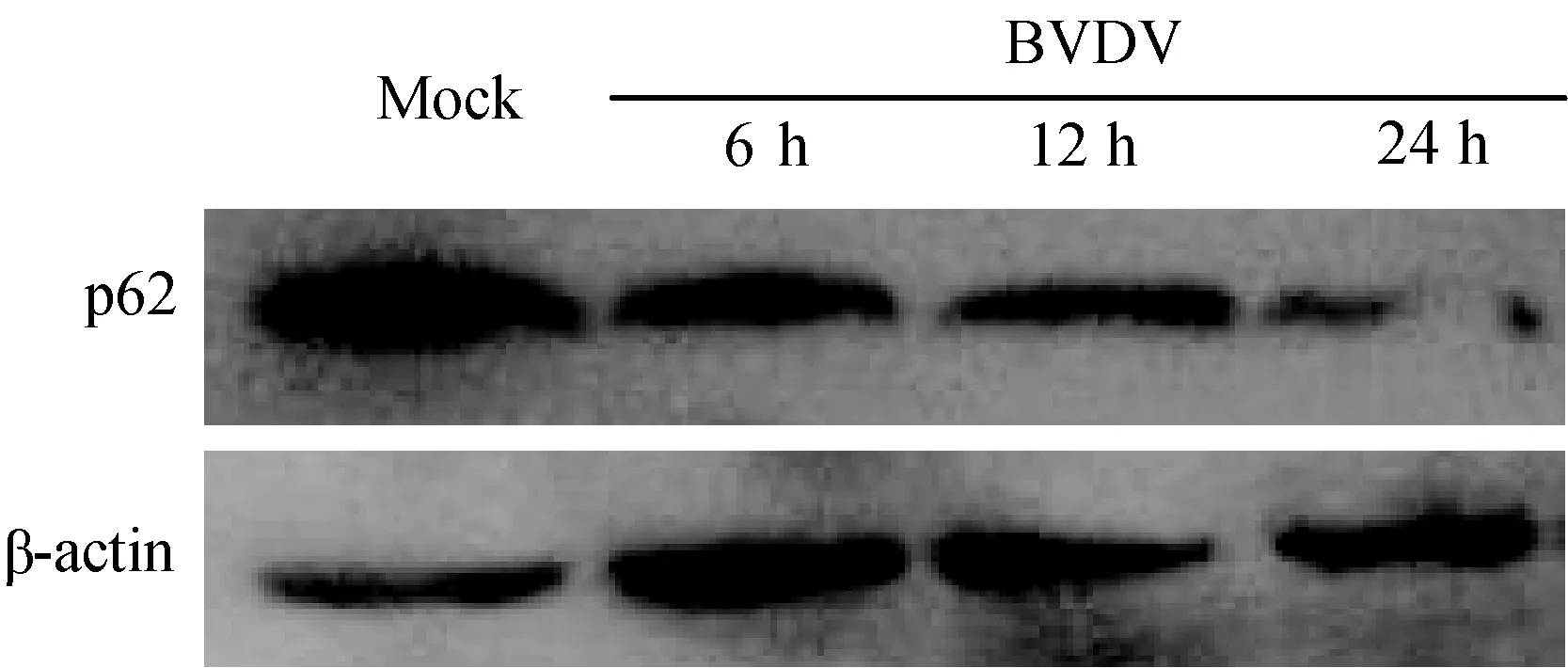
图5 BVDV感染MDBK细胞后诱导p62的降解Fig.5 Degradation of p62 in MDBK cell after BVDV infection

图6 Western blot检测RNA干扰的效果Fig.6 The silencing efficiency was detected by Western blot
2.6.2 Beclin-1的干扰对LC3脂酰化和Npro蛋白的影响 抑制内源性表达的Beclin-1,检测病毒感染细胞中LC3Ⅱ的水平和病毒蛋白Npro的表达,结果显示(图7)RNAi可以降低LC3I向LC3Ⅱ的转化和Npro蛋白的表达量,说明干扰自噬相关基因可以有效抑制BVDV蛋白的表达。

图7 Beclin-1的干扰对LC3I向LC3Ⅱ的转化及Npro蛋白表达的影响Fig.7 Impact of siBeclin-1 on the coversion of LC3Ito LC3Ⅱ and expression of Npro
2.6.3 Beclin-1的干扰对病毒滴度的影响 抑制内源性表达的Beclin-1,对MDBK细胞上清中的BVDV滴度进行了检测,结果发现(图8)与转染无序siRNA的细胞相比,转染siBeclin-1的细胞上清中病毒滴度下降2.13倍,说明干扰自噬相关基因可以有效抑制BVDV的复制。

*P<0.05图8 Beclin-1的干扰对病毒滴度的影响Fig.8 Impact of siBeclin-1 on the virus titers
3 讨 论
绝大多数RNA病毒在感染细胞之后可以引起自噬稳态的产生和自噬体的蓄积。自噬稳态检测的方法主要包括Western blot检测LC3的转化、荧光显微镜观察EGFP-LC3的分布及透射电镜鉴定自噬体的形成[17]。本试验以Oregon C24V毒株感染MDBK细胞,在不同时间点收取样品,利用上述三种方法进行检测,结果表明:LC3I向LC3Ⅱ发生了转化,LC3Ⅱ的水平增高,表明前体LC3I与自噬体表面的磷脂酰肌醇相连,形成了脂酰化LC3Ⅱ;细胞质中,EGFP-LC3发出的荧光由弥散状转为颗粒状,说明转变的LC3Ⅱ定位在自噬体膜上;透射电镜下可看到包裹细胞质成分和异物的双层囊膜结构,以及正在发生融合的自噬体和溶酶体;这些均表明BVDV感染可以诱导自噬稳态的产生。值得注意的是,在试验过程中,正常的细胞也会发生自噬,因此在细胞转染、病毒感染及药物处理后,均换成完全培养基进行细胞培养,以确保细胞生长的良好状态。
自噬稳态的产生主要指细胞自噬诱导发生的起始阶段,在自噬后期,自噬体需要和溶酶体融合发生降解,而判断这一过程就看是否诱导了“自噬流量”的产生;p62/SQSTM1蛋白可以在后期形成自噬溶酶体时被溶酶体降解,因此对它进行检测可以明确是否发生了完整的自噬[18]。本试验表明p62在BVDV感染后24 h发生了降解,初步证明BVDV感染能诱导自噬流量的产生。自噬流量的增加更能反映出细胞内自噬发生的程度,新城疫病毒(NDV)可诱导自噬流量的增加,从而诱导完整的细胞自噬[19];猪繁殖和呼吸综合征病毒(PRRSV)通过抑制自噬体向溶酶体的降解,不能诱导自噬流量的产生,从而诱导不完全的自噬[20-21]。因此,要明确BVDV感染后细胞自噬发生水平的高低,还需要通过检测溶酶体抑制后LC3Ⅱ的转化试验、EGFP-LC3和晚期溶酶体标记物LAMP1共定位试验等进一步验证。
很多研究表明细胞自噬参与病毒的复制过程,是一把“双刃剑”;一方面可通过阻断或诱导自噬体的形成限制病毒在细胞中的复制,另一方面病毒可利用自噬为自身服务。为了进一步探究自噬对BVDV复制的影响,我们通过添加自噬抑制药物Wortmannin和干扰自噬关键基因Beclin-1的内源性表达来检测细胞内病毒蛋白质的表达和病毒滴度的变化。Wortmannin可通过阻断ClassI和ClassⅢ PI3K途径抑制早期自噬体的形成[22],Western blot结果证实抑制自噬可以降低病毒蛋白质Npro的表达。据报道,瘟病毒属病毒的Npro蛋白不仅参与病毒粒子的包装,而且在病毒复制过程中也起关键作用[23]。此外,干扰Beclin-1的表达也有效抑制了Npro蛋白的表达和细胞上清中BVDV滴度;从而说明Beclin-1在BVDV的复制感染中起关键的作用,细胞自噬的诱导能够促进病毒的增殖。
最近,S.Shrivastava等证明,黄病毒科成员丙型肝炎病毒(HCV)可诱导自噬以增加自身的复制,更重要的是,HCV引发的自噬可以抑制干扰素的表达[24]。BVDV是一种免疫抑制性疾病,可影响宿主IFN的生成,能在机体内持续性感染,然而BVDV在复制的时候是如何调控自噬通路的,又是如何利用自噬逃避宿主免疫防御系统的,还有待于进一步研究。
4 结 论
BVDV感染早期可以诱导MDBK细胞发生自噬,并且自噬在BVDV的复制中发挥有利的作用。
[1] ZEMKE J,KÖNIG P,MISCHKALE K,et al.Novel BVDV-2 mutants as new candidates for modified-live vaccines [J].VetMicrobiol,2010, 142(1-2):69-80.
[2] JONES L R,WEBER E L.Application of single-strand conformation polymorphism to the study of bovine viral diarrhea virus isolates [J].JVetDiagnInvest,2001,13(1):50-56.
[3] NAGAI M,HAYASHI M,ITOU M,et al.Identification of new genetic subtypes of bovine viral diarrhea virus genotype 1 isolated in Japan [J].VirusGenes,2008,36(1):135-139.
[4] ROBESOVA B,KOVARCIK K,VILCEK S.Genotyping of bovine viral diarrhoea virus isolates from the Czech Republic [J].VetMed-czech,2009,54(9):393-398.
[5] KUTA A,POLAK M P,LARSKA M,et al.Predominance of bovine viral diarrhea virus 1b and 1d subtypes during eight years of survey in Poland [J].VetMicrobiol,2013,166(3-4):639-644.
[6] FULTON R W,RIDPATH J F,SALIKI J T,et al.Bovine viral diarrhea virus (BVDV) 1b:predominant BVDV subtype in calves with respiratory disease [J].CanJVetRes,2002,66(3):181-190.
[7] DENG Y,SUN C Q,CAO S J,et al.High prevalence of bovine viral diarrhea virus 1 in Chinese swine herds [J].VetMicrobiol,2012,159(3-4):490-493.
[8] GONG X,CAO X,ZHENG F,et al.Identification and characterization of a novel subgenotype of bovine viral diarrhea virus isolated from dairy cattle in Northwestern China [J].VirusGenes, 2013,46(2):375-376.
[9] LEVINE B,KLIONSKY D J.Development by self-digestion:molecular mechanisms and biological functions of autophagy [J].DevCell,2004,6(4):463-477.
[10] KLIONSKY D J,CREGG J M,DUNN W A,et al.A unified nomenclature for yeast autophagy-related genes [J].DevCell,2003,5(4):539-545.
[11] SHELLY S,LUKINOVA N,BAMBINA S,et al.Autophagy is an essential component of drosophila immunity against vesicular stomatitis virus [J].Immunity,2009,30(4):588-598.
[12] MOY R H,GOLD B,MOLLESTON J M,et al.Antiviral autophagy restricts rift valley fever virus infection and is conserved from flies to mammals [J].Immunity,2014,40(1):51-65.
[13] WONG J,ZHANG J,SI X,et al.Autophagosome supports coxsackievirus B3 replication in host cells [J].JVirol,2008,82(18):9143-9153.
[14] PEI J,ZHAO M,YE Z,et al.Autophagy enhances the replication of classical swine fever virusinvitro[J].Autophagy,2013,10(1):93-110.
[15] LEE Y R,LEI H Y,LIU M T,et al.Autophagic machinery activated by dengue virus enhances virus replication [J].Virology,2008,374(2):240-248.
[16] LI J K,LIANG J J,LIAO C L,et al.Autophagy is involved in the early step of Japanese encephalitis virus infection [J].MicrobesInfect,2012,14(2):159-168.
[17] KLIONSKY D J,ABDALLA F C,ABELIOVICH H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy [J].Autophagy,2012,8(4):445-544.
[18] ZHANG Y,LI Z,GE X,et al.Autophagy promotes the replication of encephalomyocarditis virus in host cells [J].Autophagy,2011,7(6):613-628.
[19] SUN Y,YU S,DING N,et al.Autophagy benefits the replication of Newcastle disease virus in chicken cells and tissues [J].JVirol,2014,88(1):525-537.
[20] CHEN Q,FANG L,WANG D,et al.Induction of autophagy enhances porcine reproductive and respiratory syndrome virus replication [J].VirusRes, 2012,163(2):650-655.
[21] LIU Q,QIN Y,ZHOU L,et al.Autophagy sustains the replication of porcine reproductive and respiratory virus in host cells [J].Virology,2012,429(2):136-147.
[22] KNIGHT Z A,SHOKAT K M.Chemically targeting the PI3K family [J].BiochemSocTrans,2007,35(2):245-249.
[23] LI D,LI S,SUN Y,et al.Poly (C)-binding protein 1,a novel Npro-interacting protein involved in classical swine fever virus growth [J].JVirol,2013,87(4):2072-2080.
[24] SHRIVASTAVA S,RAYCHOUDHURI A,STEELE R,et al.Knockdown of autophagy enhances the innate immune response in hepatitis C virus-infected hepatocytes [J].Hepatology,2011,53(2):406-414.
(编辑 白永平)
Impact of Cellular Autophagy on Bovine Viral Diarrhea Virus Replication
GONG Xiao-wei,ZHENG Fu-ying,CHEN Qi-wei,LIU Yong-sheng*,LI Zhao-cai,ZHOU Ji-zhang*,CAI Xue-peng,YIN Hong
(StateKeyLaboratoryofVeterinaryEtiologicalBiology,BacterialDiseaseinGrazingAnimalTeam,LanzhouVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Lanzhou730046,China)
The objective of this study was to investigate the role of cellular autophagy in bovine viral diarrhea virus (BVDV) infection.We used Oregon C24V strain to determine whether BVDV infection induced autophagy by using western blot,indirect immunofluorescent assay and transmission electron microscopy.To analyze the effect of autophagy on the replication of BVDV in MDBK cell,wortmannin and small interfering RNAs targeting Beclin-1 were used to inhibit autophagy.The results showed that BVDV infection results in LC3-I/Ⅱ conversion,p62 degradation,an increased accumulation of punctate GFP-LC3-expressing cells,and a higher number of autophagosome-like double-membrane vesicles in the cytoplasm of host cells.Inhibition of autophagy or interfering expression of Beclin-1 led to a significant reduction in BVDV titers and protein expression.These results demonstrate that BVDV infection induces autophagy which in turn enhances BVDV replication.
bovine viral diarrhea virus;cellular autophagy;virus replication
10.11843/j.issn.0366-6964.2015.07.017
2014-10-10
国家肉牛产业技术体系项目(CARS-38)
宫晓炜(1982-),女,甘肃兰州人,助理研究员,博士,主要从事动物疫苗与分子免疫学研究,Tel:0931-8342673,E-mail:gongxiaowei@caas.cn
*通信作者:刘永生,主要从事细菌病致病机制及防控技术研究,E-mail:liuyongsheng@caas.cn;周继章,主要从事动物疫苗及分子免疫学研究,E-mail:zhoujizhang@126.com
S852.659.6
A
0366-6964(2015)07-1201-07
