Renieramycins类生物碱的分离提取及其生物活性研究进展*
2015-03-25陈瑞蛟孔庆胜综述
陈瑞蛟 孔庆胜 综述
(济宁医学院山东省出生缺陷研究与转化协同创新中心,山东 济宁272067)
海洋双四氢异喹啉生物碱是一大类结构复杂,种类众多的天然产物,包括Renieramycins、Saframycins、Ecteinascidins等[1-2]。此类生物碱及其类似物具有显著的抗肿瘤、抗菌等活性,在化学、生物学、医学等研究领域受到广泛关注[3]。其中Ecteinascidin 743(ET-743)自2007年开始率先在欧洲、韩国等成为治疗多种晚期软组织肿瘤的抗癌药物(药 品 名:Trabectedin;Yondelis)[4-5]。研 究 表明,在抗肿瘤活性上ET-743比目前临床上广泛使用的喜树碱、紫杉醇、阿霉素、博来霉素、丝裂霉素C、顺铂及依托泊苷等著名抗癌药物高出1~3个数量级,且具有独特的多重作用机制。
1 Renieramycins类生物碱的结构特点
1974年,加拿大科学家Kluepfel等[6]从葡萄牙链霉菌Streptomyces lusitanus AYB-1206中分离得到了第一例具有抗肿瘤活性的四氢异喹啉类生物碱Naphthyridinomycin。到目前为止,已经有60多个此类化合物被报道,虽然具有抗肿瘤活性的四氢异喹啉类生物碱结构复杂、数量繁多,但其在化学结构上有相似性和差别,根据其结构特点[1-2],可以 将 其 分 为 3 大 家 族:1)Saframycin 家族;2)Naphthyridinomycin家族;3)Quinocarcin家族。
Renieramycins类生物碱属于第一类Saframycin家族,它的结构特点是[1-2]:1)含有2个四氢异喹啉结构单元;2)C1位上的侧链不再是Saframycins类的酰胺基,而是含有酯基或者是游离羟基。从1982年至今,化学家从海洋生物中分离得到一系列具有此类似结构和良好生物活性的分子[1-2],从而引起了药物及有机化学家们的广泛关注。其中很多个化合物及其衍生物显示了很好的抗癌活性,如乳腺癌、直肠癌、肺癌等。见图1。
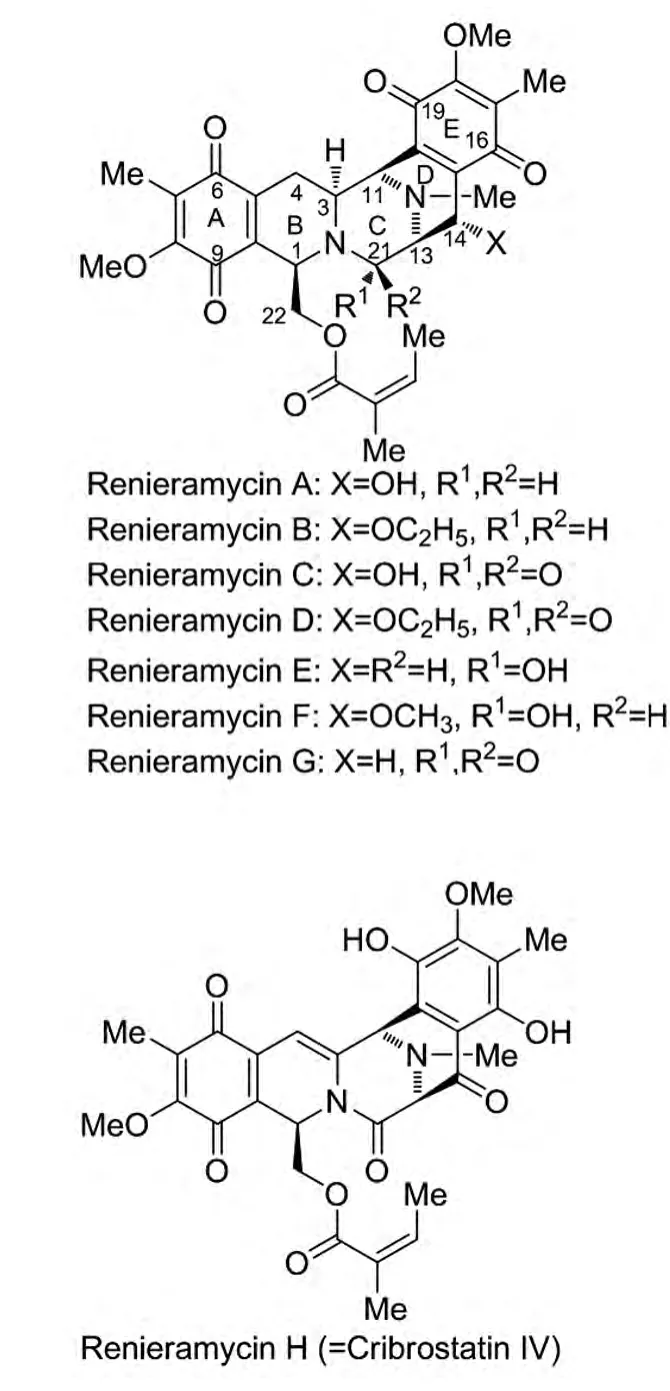
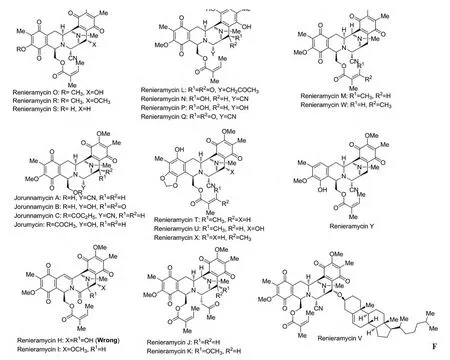
图1 Renieramycins类生物碱
2 Renieramycins类生物碱的分离和生物活性
1982年,Faulkner等[7]从海绵体 Reniera sp.中分离得到4个类似于Saframycin类的新化合物,并且把他们命名为Renieramycin A,B,C,D。他们发现这4个新化合物具有抗菌活性,但是不能确定是否具有和Saframycin A一样的抗癌活性。
1989年,Faulkner等[8]从海绵体 Reniera sp.中又分离了2个新化合物——Renieramycin E,F。这2个化合物很不稳定,特别是溶于氯仿并暴露在空气中或者是在柱色谱分离时,降解速度非常快。
1992年,Davidson[9]从深蓝色的Fijian海绵体Xestospongia caycedoi.中分离到Renieramycin G。研究发现,Renieramycin G的稳定性要好于Renieramycin E,F,可能是由于它的C21位是酰胺而不是Renieramycin E,F中的甲醇胺。虽然稳定性好了,但是它的活性却表现为中等强度。见表1。

表1 Renieramycin G的癌细胞毒性实验
1998年,Parameswaran等[10]从海绵体 Haliclona cribicutis中分离到了 Renieramycin H,I。他们认为Renieramycin H是具有独特结构的双四氢异喹啉生物碱,区别于其他Renieramycins类生物碱的地方是在C3-C4之间存在一个双键,并且在桥头C13上连接一个羟基。
2000年,Pettit等[11]在马尔代夫共和国的珊瑚礁通道上收集的蓝色海绵体Cribrochalina中分离得到了Cribrostatin IV,它的结构与Parameswaran等分离报道的Renieramycin H很类似,在C3-C4之间也存在一个双键。在生物活性方面,Cribrostatin IV在微摩尔等量级上具有一定的细胞毒素和抗菌活性。结果见表2。

表2 Cribrostatin IV的癌细胞毒性实验
2001年,Kubo等[12]通过氢谱和碳谱对 Renieramycin H进行分析研究,并且结合Pettit等分离得到Cribrostatin IV的波谱信息,发现Parameswaran等鉴定的结构是错误的,其实Renieramycin H和Cribrostatin IV是同一个化合物。Kubo等对Renieramycin H的结构进行了修饰更正后,化学家们对于Renieramycin I结构的对与错至今仍存在争议。
2000年,Fontana等从太平洋裸鳃亚目动物Jorunna funebris的皮和黏液中分离得到一个新的双四氢异喹啉生物碱——Jorumycin。它与之前分离的Renieramycins类生物碱的区别在于C1位上的侧链由当归酰基变为乙酰基[3,13-14]。他们研究发现Jorumycin具有很好的抗癌活性。结果见表3。

表3 Jorumycin的癌细胞毒性实验
2003年,Fusetani课题组[15]从海绵体 Neopetrosia sp.中分离出一个新的四氢异喹啉生物碱——Renieramycin P。它同后面Saito课题组分离出来的Renieramycin N结构很类似,区别就在于C21位上的取代基由氰基变为羟基。Fusetani等研究表明,Renieramycin P也具有很好的抗癌活性。结果见表4。

表4 Renieramycin P的癌细胞毒性实验
随后,Saito课题组[16]报道了从蓝色的泰国海绵体Xestospongia sp.中分离得到的3个新型的双四氢异喹啉生物碱——Renieramycin J,K,L,它们的特点是在C21位上连接了一个烷烃链。但是他们不能确切地证明这3个化合物到底是天然产物还是人造产物,因为这3个化合物很有可能在分离过程中与丙酮进行了分子交换。这种结果可以预测Renieramycin J可能是Renieramycin E与丙酮在C21位上进行反应生成的,根据这个结论,他们课题组对海绵体Xestospongia sp.先用KCN进行预处理,然后从处理后的海绵体Xestospongia sp.中分离得到了两个相对稳定的新化合物——Renieramycin M,N,通过KCN预处理,这样就可以使C21位上的羟基转化为氰基,这样的结构相对来说就比较稳定了。使用这种方法,他们分离出克级以上的Renieramycin M和Ecteinascidin 770。但是,Renieramycin N对光和氧气特别的敏感,很容易氧化成另一个新化合物Renieramycin O。Saito课题组对分离的几个化合物进行了活性探究,发现它们也具有很好的抗肿瘤活性。结果见表5。
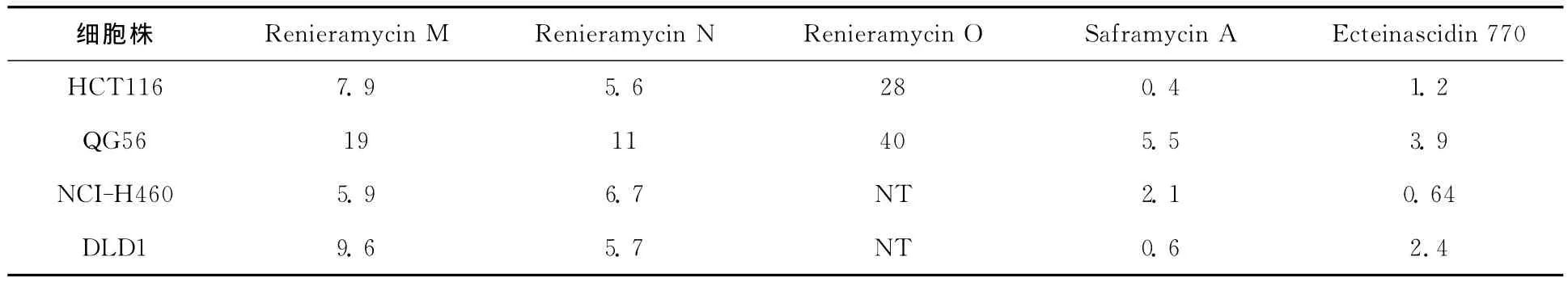
表5 Renieramycin M-O的癌细胞毒性实验(IC50/nM)
2004年,Saito课题组[17]通过深入研究,从KCN预处理过的海绵体Xestospongia sp.中又分离出4个 Renieramycins类生物碱——Renieramycin O,Renieramycin Q,R,S。这4个新化合物与以前报道的Renieramycins类生物碱非常类似,区别最大的是Renieramycin S,其C18位上第一次发现是游离的酚羟基。Saito课题组并对它们的生物活性进行了深入研究,发现它们具有很好的抗癌活性,并且与自身的结构有很大的关联。结果见表6。

表6 Renieramycin M-O的癌细胞毒性实验(IC50/nM)
2007年,Saito等[18]从 KCN预处理过的泰国裸鳃亚目动物Jorunna funebris的外皮、内脏器官和附着卵的带状物中又分离出3个稳定的Renieramycins型的双四氢异喹啉生物碱——Jorunnamycin A-C。这3个化合物同2000年由Fontana课题组分离的Jorumycin结构类似,侧链从乙酰基变为游离羟基或者丙酰基。他们对这类化合物进行了生物活性研究。结果见表7。

表7 Jorunnamycins类化合物的癌细胞毒性实验(IC50/nM)
2009年,Saito课题组[19]通过对蓝色的泰国海绵体Xestospongia sp.深入研究,从其中又提取出2个新型的双四氢异喹啉生物碱——Renieramycin T,U。区别于其它Renieramycins类化合物的地方在于它们拥有1个高芳香性的A环,这两个化合物就像是Renieramycins和Ecteinascidins的杂交结构。他们研究发现这类化合物也具有不错的抗癌活性。结果见表8。种人类癌细胞没有活性。结果见表9。

表9 Renieramycin V的癌细胞毒性实验(IC50/μM)

表8 Renieramycin T的癌细胞毒性实验(IC50/nM)
2012年,Saito课题组[20]从蓝色的泰国海绵体Xestospongia sp.分出的小极性部分提取得到一个新型的 Renieramycins类天然产物——Renieramycin V,它区别于其它Renieramycins类化合物的地方是C14位上连接一个甾醇醚,是此类生物碱中第一例与甾族化合物偶联在一起的化合物。虽然Renieramycin V的结构新颖,但是它对很多
随后,Saito课题组[21]报道了从经过KCN预处理的菲律宾海绵体Xestospongia sp.中提取了3个新的双四氢异喹啉天然产物——Renieramycin W,X,Y。第一次发现在Renieramycin W和Renieramycin X化合物的C1侧链上连接一个顺芷酰基,很明显看出它们俩分别是Renieramycin M和Renieramycin T的双键顺反异构体。而Renieramycin Y的特点是它的A环上拥有一个五取代的苯酚,这也是在这一家族中第一次出现。Renieramycin Y化合物的分离提取更进一步证实了这一家族生物合成的正确性,骨架由L-酪氨酸转化为L-3-甲基-4甲氧基-5羟基-苯丙氨酸进一步演变而成。
3 总结和展望
在天然产物化学研究中,四氢异喹啉类生物碱的研究是非常活跃的领域,也是寻找和发现天然抗癌、抗肿瘤药物先导性分子以及其它功能分子的重要源泉。本文对具有抗肿瘤活性的Renieramycins生物碱进行了分离和生物活性的综述。经研究发现多个Renieramycin类化合物表现出很强的抗肿瘤活性,很有可能成为潜在的抗肿瘤药物分子。由于大多数这类生物碱在天然生物中含量低,来源有限,限制了对其大规模的活性筛选,同时鉴于四氢异喹啉类生物碱的结构多样性及其高抗癌抗肿瘤的生物活性,有机化学家对它们产生了浓厚的兴趣[3]。
[1] Scott J D,Williams R M.Chemistry and biology of the tetrahydroisoquinoline antitumor antibiotics[J].Chem Rev,2002,102(5):1669-1730.
[2] Avendaño C,de la Cuesta E.Recent synthetic approaches to 6,15-iminoisoquino[3,2-b]3-benzazocine compounds[J].Chem Eur J,2010,16(32):9722-9734.
[3] 陈瑞蛟.四氢异喹啉生物碱jorumycin的全合成研究进展[J].济宁医学院学报,2014,37(1):2-4.
[4] Molinski T F,Dalisay D S,Lievens S L,et al.Drug development from marine natural products[J].Nat Rev Drug Discovery,2009,8(1):69-85.
[5] Cuevas C,Francesch A.Development of Yondelis○R(trabectedin,ET-743).A semisynthetic process solves the supply problem[J].Nat Prod Rep,2009,26(3):322-337.
[6] Kluepfel D,Baker H A,Piattoni G,et al.Naphthyridinomycin,a new broad-spectrum antibiotic[J].J Antibiot,1975,28(7):497-502.
[7] Frincke J M,Faulkner D J.Antimicrobial metabolites of the sponge Reniera sp[J].J Am Chem Soc,1982,104(1):265-269.
[8] He H Y,Faulkner D J .Renieramycins E and F from the sponge Reniera sp.:reassignment of the stereochemistry of the renieramycins[J].J Org Chem,1989,54(24):5822-5824.
[9] Davidson B S.Renieramycin G,a new alkaloid from the sponge Xestospongia caycedoi[J].Tetrahedron Lett,1992,33(26):3721-3724.
[10]Parameswaran P S,Naik C G,Kamat S Y,et al.Renieramycins H and I,two novel alkaloids from the sponge Haliclona cribricutis Dendy[J].Indian J Chem,1998,37B,1258-1263.
[11]Pettit G R,Knight J C,Collins J C,et al.Antineoplastic A-gents 430.Isolation and Structure of Cribrostatins 3,4,and 5 from the Republic of Maldives Cribrochalina Species[J].J Nat Prod,2000,63(6):793-798.
[12]Saito N,Sakai H,Suwanborirux K,et al.13CNMR Spectral Assignment of 5-Hydroxy-1,5-imino-3-benzazocin-4,7,10-trione Derivatives:The Revised Structure of Renieramycin H[J].Heterocycles,2001,55(1):21-28.
[13]Fontana A,Cavaliere P,Wahidulla S,et al.A New Antitumor Isoquinoline Alkaloid from the Marine Nudibranch Jorunna funebris[J].Tetrahedron,2000,56(37):7305-7308.
[14]Saito N,Tanaka C,Koizumi Y,et al.Chemistry of renieramycins.Part 6:Transformation of renieramycin M into jorumycin and renieramycin J including oxidative degradation products,mimosamycin,renierone,and renierol acetate[J].Tetrahedron,2004,60(17):3873-3881.
[15]Oku N,Matsunaga S,Van Soest RWM,et al.Renieramycin J,a highly cytotoxic tetrahydroisoquinoline alkaloid,from a marine sponge neopetrosia sp.[J].J Nat Prod,2003,66(8):1136-1139.
[16]Suwanborirux K,Amnuoypol S,Plubrukarn A,et al.Chemistry of Renieramycins.Part 3.Isolation and Structure of Stabilized Renieramycin Type Derivatives Possessing Antitumor Activity from Thai Sponge Xestospongia Species,Pretreated with Potassium Cyanide[J].J Nat Prod,2003,66(11):1441-1446.
[17]Amnuoypol S,Suwanborirux K,Pummangura S,et al.Chemistry of Renieramycins.Part 5.Structure Elucidation of Renieramycin-Type Derivatives O,Q,R,and S from Thai Marine Sponge Xestospongia Species Pretreated with Potassium Cyanide[J].J Nat Prod,2004,67(6):1023-1028.
[18]Charupant K,Suwanborirux K,Amnuoypol S,et al.Jorunnamycins A-C,new stabilized renieramycin-type bistetrahydroisquinolines isolated from the Thai nudibranch Jorunne fuhebris[J].Chem Pharm Bull,2007,55(1):81-86.
[19]Daikuhara N,Tada Y,Yamaki S,et al.Chemistry of renieramycins.Part 7:Renieramycins T and U,novel renieramycin–ecteinascidin hybrid marine natural products from Thai sponge Xestospongia sp[J].Tetrahedron Lett,2009,50(29):4276-4278.
[20]Saito N,Yoshino M,Charupant K,et al.Part 10:Structure of Renieramycin V,a Novel Renieramycin Marine Natural Product Having a Sterol Ether at C-14Position[J].Heterocycles,2012,84(1):309-314.
[21]Tatsukawa M,Punzalan LLC,Magpantay HDS,et al.Chemistry of renieramycins.Part 13:Isolation and structure of stabilized renieramycin type derivatives,renieramycins W – Y,from Philippine blue sponge Xestospongia sp.,pretreated with potassium cyanide[J].Tetrahedron,2012,68(36):7422-7428.
