白介素33下调高迁移率族蛋白1保护大鼠缺血再灌注心肌的研究
2015-03-24马瑞松李元红胡笑容李雪飞
马瑞松,江 洪,李元红,胡笑容,李雪飞
基础研究
·论著·
白介素33下调高迁移率族蛋白1保护大鼠缺血再灌注心肌的研究
马瑞松,江 洪,李元红,胡笑容,李雪飞
目的 探讨白介素33(IL-33)是否可以通过调控高迁移率族蛋白1(HMGB1)表达保护大鼠缺血再灌注(I/R)心肌。方法 将32只成年雄性SD大鼠随机分为4组:假手术(SO)组(n=10)、I/R模型组(n=10)、IL-33组(n=6)、HMGB1抗体(HMGB1 Ab)组(n=6)。SO组大鼠开胸,左前降支(LAD)下穿线,但不结扎;其余3组制作大鼠I/R模型,IL-33组于造模前30 min予尾静脉注射IL-33 10 μg,HMGB1 Ab组于造模前30 min予尾静脉注射IL-33 10 μg及HMGB1中和抗体。检测各组血清乳酸脱氢酶(LDH)、肌酸激酶(CK)水平,心肌组织肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)、HMGB1、总半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、活化Caspase-3、Bcl-2、Bax表达,定量检测SO组、I/R组、IL-33组心肌组织中HMGB1 mRNA。结果 再灌注4 h后,IL-33可明显降低I/R大鼠血清LDH、CK水平,降低心肌组织TNF-α、IL-6、HMGB1、Bax的表达和Caspase-3活化(P<0.05),升高Bcl-2表达(P<0.05);HMGB1可减弱IL-33的上述作用(P<0.05)。结论 IL-33可通过抑制心肌组织中HMGB1表达进而抑制心肌炎症反应和细胞凋亡,保护I/R心肌。
心肌再灌注损伤;白介素33;高迁移率族蛋白1;大鼠,Sprague-Dawley
研究发现,炎症反应是心肌缺血再灌注(ischemia and reperfusion, I/R)损伤的一个重要的病理生理过程。调控高迁移率族蛋白1(high mobility group protein, HMGB1)是一种非组织核蛋白,一旦从胞核内释放到细胞外,便会成为促炎因子加重心肌I/R损伤[1-2],同时,HMGB1可以促进经典炎症因子肿瘤坏死因子-α(TNF-α)、白介素(IL-6)的表达,进而加重心肌I/R损伤[2]。抑制HMGB1的表达可以减轻心肌I/R损伤[2]。这些结果均提示HMGB1在心肌I/R损伤中发挥了重要作用。白介素33(IL-33)是2005年发现的白介素1家族的新成员[3],存在于细胞核内,当细胞坏死和凋亡时被释放到细胞外,通过与其特异性受体ST2L结合发挥炎症因子的作用。近年的研究发现,IL-33对多种心血管疾病所致心肌损伤有保护作用,包括I/R损伤[4-6]。另外,前期的研究显示IL-33可以调节HMGB1的表达[7-8]。因此,笔者推测,IL-33可以通过调控HMGB1表达保护I/R心肌。本研究试对上述推断及可能的机制进行验证。
1 材料与方法
1.1 动物模型制作和实验分组 SPF级成年雄性大鼠(200~250 g)32只,购自武汉大学动物实验中心(动物许可证号:42000500004956,42000500005085)。于可控的环境中(明/暗12 h交替)给予充足的水和食物,喂养48 h。大鼠I/R模型制作方法参照文献[9]。随机将大鼠分为4组,SO组(n=10):大鼠开胸,左前降支(LAD)下穿线,但不结扎;I/R组(n=10):大鼠开胸,结扎LAD 30 min,再灌注4 h;IL-33组(n=6):结扎大鼠LAD 30 min前,尾静脉注射IL-33(10 μg/只,美国Peprotech),后缺血30 min,再灌注4 h;HMGB Ab组(n=6):大鼠麻醉后,尾静脉注射HMGB1中和抗体(100 μg/只,德国IBL),在另一条尾静脉注射IL-33(10 μg/只),30 min后,结扎大鼠LAD,缺血30 min后,再灌注4 h。
1.2 血清乳酸脱氢酶(LDH)、肌酸激酶(CK)测定 大鼠缺血再灌注4 h后,经颈静脉取血2 ml,3000 r/min离心15 min,取血清,-80℃冰箱保存,选用南京建成生物工程研究所试剂盒,根据说明书规范操作,测定血清LDH和CK水平。
1.3 心肌组织TNF-α和IL-6检测 再灌注4 h后,取结扎线水平以下的心肌,并剪除右心室,-80℃冰箱冻存至检测。选用南京建成生物工程研究所试剂盒进行ELASIA检测,根据说明书规范操作,测定心肌组织中TNF-α和IL-6。
1.4 心肌组织HMGB1、Caspase-3、Bcl-2、Bax检测 Western blot法检测心肌组织中相关蛋白的表达。取材方法同“1.3”,检测方法参照文献[10],根据分子质量配制12%PAGE胶,电泳后转膜,用5%的脱脂奶粉封闭,4℃孵育一抗过夜,对HMGB1、Caspase-3、Bcl-2、Bax、β-actin采用对应的HRP标记的二抗孵育后,用ECL显色。以β-actin为内参计算上述蛋白的相对表达量。
1.5 HMGB1 mRNA定量检测 参照文献[11]从心肌组织中提取RNA,逆转录为cDNA。引物设计如表1所示,定量PCR反应体系如表2所示。反应条件:第1个循环,50℃×2 min,95℃×10 min;后40个循环,95℃×30 s,60℃×30 s。应用实时定量PCR仪(美国ABI,Vii7)测算出HMGB1 mRNA的含量。

表1 定量PCR引物
F为前向引物,R为反向引物

表2 实时定量PCR反应体系(以b-240为例)
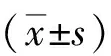
2 结果
2.1 血清LDH和CK水平 与SO组比较,I/R组血清中LDH和CK显著升高(P<0.05);与I/R组比较,IL-33组和HMGB1 Ab组血清LDH和CK显著降低(P<0.05);与IL-33组比较,HMGB1 Ab组CK显著升高(P<0.05)。见表3。
2.2 心肌组织TNF-α和IL-6表达 与SO组比较,I/R组心肌组织中TNF-α和IL-6的表达水平明显升高(P<0.05);与I/R组比较,IL-33组和HMGB1 Ab组心肌组织TNF-α和IL-6表达明显降低(P<0.05);HMGB1 Ab组TNF-α和IL-6的表达明显高于IL-33组(P<0.05)。见表3。
2.3 心肌组织Caspase-3和Bcl-2/Bax的表达 与SO组相比,I/R组中活化Caspase-3水平明显升高(P<0.05);与I/R组比较,IL-33组总Caspase-3和活化Caspase-3的表达显著降低(P<0.05),HMGB1 Ab组活化Caspase-3表达显著降低(P<0.05);与IL-33组比较,HMGB1 Ab组总Caspase-3和活化Caspase-3表达差异均无统计学意义(P>0.05)。I/R组Bcl-2/Bax明显低于SO组(P<0.05);与I/R组相比,IL-33组Bcl-2/Bax显著升高(P<0.05);HMGB1 Ab组Bcl-2/Bax显著低于IL-33组(P<0.05)。见表3、图1。
2.4 IL-33抑制HMGB1的表达 与SO组相比,I/R组HMGB1表达显著升高(P<0.05);与I/R组比较,IL-33组HMGB1表达显著降低(P<0.05);HMGB1 mRNA与HMGB1蛋白表达趋势相同。见表3、图1。
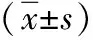
表3 4组大鼠相关指标检测结果
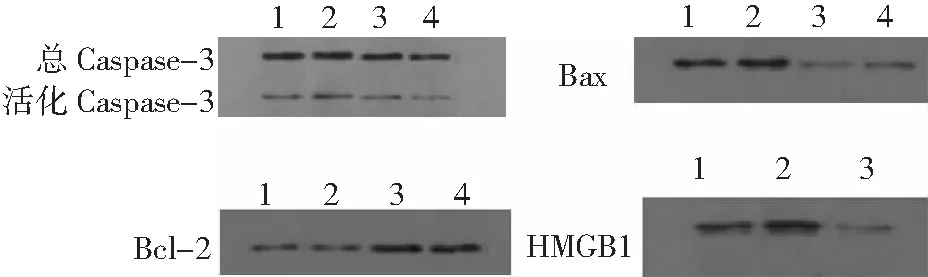
图1 4组大鼠心肌组织Caspase-3、Bcl-2、Bax、HMGB1检测结果
3 讨论
IL-33是IL-1家族的第11个成员,不同于其他的IL-1家族因子,IL-33具有双重作用,它既可以作为核因子调控细胞的增殖和转录,也可以被释放到细胞外,作为细胞因子参与炎症反应。目前已证实,IL-33作为炎症因子时既可在过敏性炎症中如过敏性皮炎、哮喘和风湿性疾病中表现为促炎作用加重损伤,也可在多种心血管疾病以及组织的I/R损伤中表现为抗炎因子发挥保护作用,包括心肌I/R损伤[4-6,12-14]。Seki等[4]证实,IL-33可抑制小鼠心肌中Th1因子如INF-γ的表达,增加Th2因子如IL-4、IL-13的表达。Yin等[12]发现IL-33在小鼠心脏移植时也发挥相同的作用。Li等[13]在肝脏I/R研究中也发现,IL-33可以明显减少肝脏中TNF-α、INF-γ的分泌,减轻肝脏炎症,保护肝脏。Yndestad等[15]证实,IL-33可以抑制心肌组织TNF-α和IL-6的表达,减弱心肌炎症反应。本研究结果与上述研究结论一致,同时发现,IL-33可减少HMGB1的表达。HMGB1是一种新型的促炎因子,在心肌I/R损伤中发挥了重要作用[2,16-17]。它不但可以作为炎症因子直接加重心肌I/R损伤,还可以作为促炎因子上调其他炎症因子如TNF-α、IL-6的表达,进而加重心肌损伤[2]。而抑制HMGB1的表达可以减弱I/R心肌炎症反应,保护心肌。本研究发现,加入HMGB1 Ab可明显减弱IL-33的抗炎和心肌保护作用,提示IL-33可通过下调HMGB1表达减弱心肌炎症反应保护I/R心肌。
凋亡是心肌I/R损伤中一个重要的病理生理过程,抑制凋亡的发生可明显减弱心肌I/R损伤[18]。本研究发现,IL-33可降低活化Caspase-3的水平,增加Bcl-2/Bax,即减弱心肌细胞的凋亡水平、保护心肌,这和既往的研究结果一致[4-5]。Hu等[16]证实,HMGB1可促进I/R中心肌细胞凋亡,且呈剂量依赖性。Ding等[19]和Zhu等[20]进一步证实HMGB1-TLR4-IL-23-IL-17A轴可以通过调节心肌细胞凋亡加重心肌I/R损伤。这些结果均提示,HMGB1可以促进心肌I/R心肌细胞凋亡的发生。同时本研究发现,HMGB1 Ab可减弱IL-33的抗凋亡作用,进一步印证了上述结论,提示IL-33可以通过下调HMGB1表达减弱I/R心肌凋亡,保护心肌。既往研究表明,核因子κB(NF-κB)通路是IL-33/ST2一条重要的下游通路[7],抑制NF-κB可降低HMGB1的表达[8],因此,笔者推断,IL-33可能是通过NF-κB通路调控HMGB1的表达,但其具体机制仍需进一步研究。
综上所述,本研究进一步印证了IL-33可以通过减弱心肌炎症和细胞凋亡而减轻心肌I/R损伤;同时首次证实了IL-33可通过下调HMGB1表达抑制心肌炎症反应和细胞凋亡,进而保护I/R心肌。
[1] Bell C W, Jiang W, Reich C F 3rd,etal. The extracellular release of HMGB1 during apoptotic cell death[J].Am J Physiol Cell Physiol, 2006,291(6):C1318-C1325.
[2] Andrassy M, Volz H C, Igwe J C,etal. High-mobility group box-1 in ischemia-reperfusion injury of the heart[J].Circulation, 2008,117(25):3216-3226.
[3] Schmitz J, Owyang A, Oldham E,etal. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J].Immunity, 2005,23(5):479-490.
[4] Seki K, Sanada S, Kudinova A Y,etal. Interleukin-33 prevents apoptosis and improves survival after experimental myocardial infarction through ST2 signaling[J].Circ Heart Failure, 2009,2(6):684-691.
[5] Rui T, Tang Q. IL-33 attenuates anoxia/reoxygenation-induced cardiomyocyte apoptosis by inhibition of PKCβ/JNK pathway[J].PloS One, 2013,8(2):e56089.
[6] Rui T, Zhang J, Xu X,etal. Reduction in IL-33 expression exaggerates ischaemia/ reperfusion-induced myocardial injury in mice with diabetes mellitus [J].Cardiovasc Res, 2012,94(2):370-378.
[7] Miller A M. Role of IL-33 in inflammation and disease[J].J Inflamm (Lond), 2011,8(1):22.
[8] Tan Y, Wang Q, She Y,etal. Ketamine reduces LPS-induced HMGB1 via activation of the Nrf2/HO-1 pathway and NF-κB suppression[J].J Trauma Acute Care Surg, 2015,78(4):784-792.
[9] Hu X, Cui B, Zhou X,etal. Ethyl pyruvate reduces myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats[J].Mol Biol Rep, 2012,39(1):227-231.
[10]Xu H, Su Z, Wu J,etal. The alarmin cytokine, high mobility group box 1, is produced by viable cardiomyocytes and mediates the lipopolysaccharide-induced myocardial dysfunction via a TLR4/phosphatidylinositol 3-kinase gamma pathway [J].J Immunol, 2010,184(3):1492-1498.
[11]Kemp T J, Causton H C, Clerk A. Changes in gene expression induced by H2O2incardiac myocytes[J].Biochem Biophys Res Commun, 2003,307(2):416-421.
[12]Yin H, Li X Y, Jin X B,etal. IL-33 prolongs Murine Cardiac Allograft Sruvival Through Induction of TH2-Type Immune Deviation[J].Transplantation, 2010,89(10):1189-1197.
[13]Li S, Zhu F X, Zhang H B,etal. Pretreatment with interleuklin-33 reduces warm hepatic ischemia/reperfusion injury in mice[J].Chin Med J(Engl), 2013,126(10):1855-1859.
[14]Thierry A, Giraud S, Robin A,etal. The alarmin concept applied to human renal transplantation: evidence for a differential implication of HMGB1 and IL-33[J].PloS One, 2014,9(2):e88742.
[15]Yndestad A, Marshall A K, Hodgkinson J D,etal. Modulation of interleukin signaling and gene expression in cardiac myocytes by endothelin-1[J].Int J Biochem Cell Biol, 2010,42(2):263-272.
[16]Hu X, Cui B, Zhou X,etal. Ethyl pyruvate reduces myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats[J].Mol Biol Rep, 2012, 39(1):227-231.
[17]Hu X, Zhou X, He B,etal. Minocycline protects against myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats[J].Eur J Pharmacol, 2010,638(1-3):84-89.
[18]Xie L, Pi X, Wang Z,etal. Depletion of PHD3 Protects Heart from Ischemia-Reperfusion Injury by Inhibiting Cardiomyocyte Apoptosis[J].J Mol Cell Cardiol, 2015,80:156-165.
[19]Ding H S, Yang J, Chen P,etal. The HMGB1-TLR4 axis contributes to myocardial ischemia/reperfusion injury via regulation of cardiomyocyte apoptosis[J].Gene, 2013,527(1):389-393.
[20]Zhu H, Li J, Wang S,etal. Hmgb1-TLR4-IL-23-IL-17A axis promote ischemia-reperfusion injury in a cardiac transplantation model[J].Transplantation, 2013,95(12):1448-1454.
Interleukin 33 in Protecting Myocardial Ischemia and Reperfusion Injury by Down Regulation of HMGB1 Expression in Rats
MA Rui-song1, JIANG Hong1, LI Yuan-hong2, HU Xiao-rong1, LI Xue-fei1
(1. Department of Cardiology, Renmin Hospital of Wuhan University, Wuhan 430060, China; 2. Department of Cardiology, Central Hospital of Enshi Tujia and Miao Autonomous Prefecture, Enshi, Hubei 445000, China)
Objective To investigate the protective effect of interleukin-33 (IL-33) on myocardial ischemia and reperfusion injury (I/R) by down regulation of high mobility group protein1 (HMGB1) expression in rats. Methods The 32 adult male SD rats were randomly divided into sham operation group (SO group,n=10), I/R group (n=10), IL-33 group (n=6) and HMGB1 antibodies group (HMGB1 Ab group,n=6). The rats in SO group underwent chest cutting operation, and a suture was passed through the myocardium beneath the left anterior descending (LAD) without ligation; while the I/R models were established in rats in the rats in other 3 groups, and the rats in IL-33 and HMGB1 Ab groups were treated with IL-33 10μg and IL-33 10μg + HMGB1 neutralizing antibody respectively by vena caudalis injection 30 min before the model establishment. The levels of serum lactate dehydrogenase (LDH) and creatine kinase (CK), and expressions of tumor necrosis factor-α (TNF-α), IL-6, HMGB1, total Caspase-3, cleaved Caspase-3, Bcl-2 and Bax in all groups were detected, and HMGB1 mRNA levels in SO, I/R and IL-33 groups were quantificationally detected. Results After reperfusion for 4 h, IL-33 could significantly decrease LDH and CK levels and the TNF-α, IL-6, HMGB1 and Bax expressions, and Caspase-3 activation (P<0.05), but increase the Bcl-2 expression (P<0.05); while HMGB1 could weaken protective effect of IL-33 (P<0.05). Conclusion IL-33 may inhibit myocardial inflammatory reaction and apoptosis by inhibiting HMGB1 expression in myocardial tissues so as to protect I/R myocardium.
Myocardial reperfusion injury; Interleukin-33; High mobility group protein 1; Rat, Sprague-Dawley
国家自然科学基金(81370308)
430060 武汉,武汉大学人民医院心内科(马瑞松、江洪、胡笑容、李雪飞);445000 湖北 恩施土家族苗族自治州,恩施土家族苗族自治州中心医院心内科(李元红)
李元红,Email:lyh0101@vip.163.com
R542.2;R-332
A
2095-140X(2015)08-0041-04
10.3969/j.issn.2095-140X.2015.08.011
2015-04-23 修回时间:2015-05-13)
