山羊痘疫苗荧光定量效检方法的建立及应用
2015-03-24张倩唐娜王金良苗立中胡琳琳孙翠萍沈志强
张倩,唐娜,2,王金良,2,苗立中,2,胡琳琳,孙翠萍,沈志强,2*
1.山东绿都生物科技有限公司,山东滨州256600
2.滨州畜牧兽医研究院,山东滨州256600
山羊痘疫苗荧光定量效检方法的建立及应用
张倩1,唐娜1,2,王金良1,2,苗立中1,2,胡琳琳1,孙翠萍1,沈志强1,2*
1.山东绿都生物科技有限公司,山东滨州256600
2.滨州畜牧兽医研究院,山东滨州256600
为建立灵敏度高,特异性强的山羊痘(GPV)荧光定量PCR(FQ-PCR)检测方法,并以稳定的标准品替代定量测定山羊痘疫苗半成品中的核酸。针对山羊痘病毒基因组P32基因设计一对特异性引物,构建稳定的标准品,进行敏感性、特异性和稳定性试验,并对本单位的部分批次山羊痘疫苗半成品进行定量检验,与TCID50效检结果相比较寻求相关性。结果表明建立的标准曲线相关系数为0.9995,扩增效率为98%,该方法只扩增山羊痘病毒,不扩增其他病原,能检测到每微升体积中100个DNA模板拷贝数,比山羊痘普通PCR(GPV-nPCR)高一个数量级。制备三批标准品进行重复性试验,结果变异系数在0.43~1.9%之间,稳定性良好。对4批的山羊痘疫苗半成品进行效力检验,TCID50≥104.5/mL时Ct值为14.51。建立的GPV-FQ-PCR方法能特异性的检测GPV核酸含量,与TCID50测定的结果具有良好的相关性,可用于山羊痘半成品中核酸的定量测定。
山羊痘;疫苗;荧光定量;效力检验
山羊痘病毒(Goat pox virus,GPV)、绵羊痘病毒(Sheep pox virus,SPV)和疙瘩皮肤病病毒(Lumpy skin disease virus,LSDV)同属于羊痘病毒属,山羊痘主要症状是皮肤和粘膜上出现痘疹和痘疱。该病的流行已有很长的历史,主要分布于非洲、中东及中亚地区,对养羊业危害严重。该病发病迅速,羔羊死亡率高。该病被世界动物卫生组织(OIE)列为A类传染病,我国将其列为一类动物疾病[1]。
荧光定量PCR(Fluorescent quantitation PCR,FQ-PCR)是在普通PCR的基础上发展起来,荧光定量PCR相比于普通PCR具有更高灵敏度,并可精确定量,因此被广泛的用于疾病的早期检测和临床组织样品的定量检测[2]。近年来因其可精确定量还被应用于替代疫苗半成品的效力检验,2006年蒋春燕等建立荧光定量PCR与猪瘟兔化弱毒苗的半成品的效力检验兔体定型热反应相比较,建立的荧光定量检测方法与兔体定型反应热之间具有很好的相关性[3],可用以猪瘟兔化弱毒苗的半成品的效力检验。2013年陈锴等针对猪瘟兔化弱毒的3’端非编码区设计了MGB探针荧光定量法,灵敏度更高,结果同样适用于猪瘟兔化弱毒苗的半成品中猪瘟兔化弱毒的定量检测[4]。
山羊痘目前的预防措施主要是免疫山羊痘弱毒疫苗进行保护,山羊痘AV41是目前国内主要的预防山羊痘的疫苗,在山羊痘的防控中发挥了重要的作用[5]。目前该疫苗的生产主要采用了原代绵羊羔睾丸细胞(Sheep testicular cells,STCs)[6]。同时也利用STCs进行效力检验。但是该原代细胞制备成本高,耗时长,并且受绵羊羔个体差异的影响而对检验结果造成一定的影响。
本研究研究针对山羊痘病毒P32基因建立了SYBGREENⅠ荧光实时定量检测方法,构建稳定的标准品,以利用其敏感性高,特异性好,检测成本低的特点,对疫苗半成品进行的效力检验。即可节约检测成本,缩短检测时间,提供快速准确的结果。同时该方法也可应用于山羊痘的早期诊断,为监测疫情的发展提供灵敏可靠的方法。
1 材料和方法
1.1 毒株,菌种和载体
山羊痘弱毒株病毒AV41由山东绿都生物可以有限公司提供;羊口疮,羊胸膜肺炎病料由山东绿都生物科技有限公司实验室保存。
1.2 主要仪器与试剂
SYBR Premix Ex TaqTM(PerfeCt Real Time)试剂盒、PrimeScript RT reagent试剂盒、Ex Taq聚合酶、10×PCR Buffer、dNTP Mixture(2.5 mmol·L-1)、6×Loading Buffer、PMD-18T克隆试剂盒购自宝生物工程(大连)有限公司;质粒小提试剂盒、多功能DNA纯化回收试剂盒、DH5a购自北京百泰克生物技术有限公司;病毒RNA/DNA抽提试剂盒购自AXYGEN。
荧光定量PCR仪LightCycler®480购自罗氏;微量紫外分光光度计Nanodrop 2000/2000C购自赛默飞世尔科技;普通PCR仪T100型梯度PCR仪购自伯乐。
1.3 引物的设计
根据Genbank登录的GPVHuB/2009/China株的膜蛋白p32基因(JN596275.1)序列,应用Primer Premier5.0设计一对特异性的引物,由生工生物工程(上海)有限公司合成。上游引物P1:5'-GCAA ATCGTATGCCGATGC-3';下游引物P2:5'-CCGTCAGGAAATCtATGAGCC-3',其PCR扩增产物为4 94 bp,用于构建标准质粒;荧光定量PCR引物R1:5'-CtCAAACtGGTAGAAATACCtTTAT-3';R2:5'-GGATATGATTTTACCtTATCtGC-3'。产物长度为110 bp。
1.4 样品处理与核酸提取
将冻干毒种样品用无菌的生理盐水稀释至原体积,12000 r/min离心5 min,取200µL上清液,利用病毒RNA/DNA抽提试剂盒提取病毒核酸。
1.5 目的基因的扩增与标准质粒的构建
以提取的山羊痘疫苗的DNA作为模板使用设计的引物P1、P2扩增目的基因片段。扩增体系:2×Premix Taq 10 μL、上下游引物(10 μM)各1 μL、DNA模板2 μL、灭菌双蒸水6 μL。反应条件为:94℃预变性5 min;94℃变性45 s,57℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。1%的琼脂糖凝胶电泳结果鉴定。胶回收目的片段用以构建标准质粒。挑取菌落筛选阳性克隆,用微量紫外分光光度计测定质粒的浓度与纯度,送生工生物工程(上海)有限公司测序,测序结果与GenBank序列进行比对,-20℃保存备用。
1.6 标准曲线的建立及敏感性检测
根据重组质粒的浓度,计算拷贝数浓度。计算公式为拷贝数=(6.02×1023)×(ng/μL×10-9)/(DNA length×660)。将上述制备的标准样品10倍倍比稀释后,取1.0×102~1.0×108拷贝/µL的标准质粒分别进行荧光定量PCR和普通PCR,比较两种方法的灵敏度。
1.7 特异性试验和稳定性试验
分别以山羊常见病山羊痘、羊口疮、羊传染性胸膜肺炎DNA为模板,进行荧光定量PCR反应以验证该方法的特异性。
根据敏感性试验的扩增动力曲线选取扩增效率高的六个稀释梯度,进行稳定性试验,制备三批标准品,将质粒的浓度稀释到同样浓度进行扩增试验,比较建立标准曲线的稳定性。
1.8 在疫苗半成品效力检验中的应用及在临床诊断上的应用
利用建立的山羊痘荧光定量方法,对四批已知病毒滴度的疫苗半成品进行提取病毒基因组后进行病毒含量检测,与TCID50方法结果比对,分析结果的相关性。
利用建立的荧光定量的方法,对本公司新引进的山羊进行山羊痘筛选,无明显病变特征的羊采集口鼻粘液作为组织样本,出现疑似皮肤痘肿的同时采集皮肤组织及口鼻粘液,利用试剂盒提取组织样本中提取病毒基因组,进行荧光定量PCR检测。
2 结果
2.1 PCR扩增及质粒的构建
经PCR扩增鉴定,与预期的目的条带相一致(如图1)。将目的片段与载体重组后,进行鉴定筛选阳性克隆,酶切后目的条带的大小与预期的一致。阳性质粒经测序后与Genbank中公布的GPV基因序列进行同源性比较,其核苷酸同源性在99%以上,表明重组质粒序列正确。经微量紫外分光光度计测定质粒浓度为175.36 ng/μL,依据基因拷贝数计算公式(基因拷贝数=DNA质量浓度/DNA分子量)测得质粒拷贝数为个5.3x1010拷贝/μL。

图1 GPV基因扩增M:DL2000DNA;1:阴性对照组;2目的基因Fig.1 PCR amplification of GPVM:DL2000DNA;1:Negative control;2:Target gene
2.3 标准曲线的建立及敏感性检测
用TE将标准阳性重组质粒首先进行530倍的稀释,稀释终浓度为108拷贝/μL,然后进行10倍的倍比稀释,取102~108拷贝/μL的7个稀释梯度作为模板进行荧光定量PCR扩增,生成动力学曲线(图2)和标准曲线(图3),Ct值和标准质粒浓度间呈现良好的线性关系,动力学曲线的扩增效率为98%,
标准曲线斜率为-3.3693,线性方程为y=-3.3693x+34.349,相关系数为0.9995(图3)。溶解曲线倒数图中(图4)有单一清晰的峰,引物扩增特异性好无引物二聚体等非特异性扩增片段。

图2 标准质粒倍比稀释扩增动力曲线Fig.2 Dynamic amplification curves of standard plasmid dilution1-7:依次为倍比稀释质粒浓度108~102拷贝/μL1-7:The curves 1 to 7 represent the plasmid concentration 108~102copy/μL diluted in double

图3 标准曲线线性回归分析Fig.3 Linear regression analysis of the standard curve

图4 溶解曲线Fig.4 Dissolution curve

图5 普通PCR凝胶电泳鉴定结果Fig.5 Agarose gel eletrophoresis result of common PCR1-7:依次为倍比稀释质粒浓度108~102/μL1-7:The curves 1 to 7 represent the plasmid concentration 108~102copy/μL diluted in double
将10倍系列稀释的标准质粒同时进行了普通PCR,1%琼脂糖凝胶电泳鉴定结果见图5。结果表明GPV-nPCR检测到标准质粒拷贝浓度为1000拷贝/μL为最低的检测度,而图2结果表明GPV-FQ-PCR的检测到的质粒拷贝浓度为100拷贝/μL。荧光定量的灵敏度优于普通PCR。
2.4 特异性试验与稳定性试验
山羊痘、羊口疮,羊传染性胸膜肺炎DNA作为模板,进行荧光定量PCR反应,结果发现除山羊痘能够扩增出S型动力曲线,其它病毒均不扩增。溶解曲线无非特异性产物和引物二聚体的峰值出现,表明所建立的方法具有很好的特异性(图6),与其它山羊常见病原核酸无交叉反应。

图6 特异性检测扩增曲线Fig.6 The specific experiment of FQ-PCR assay
选取扩增效率高的六个稀释梯度,进行稳定性试验,制备三批标准品BZ1、BZ2、BZ3,将三批标准质粒的浓度稀释到同样浓度进行扩增试验,比较建立标准曲线的稳定性。表1的结果表明三批标准质粒的变异系数在0.43~1.90%之间,表明我们建立的标准品重复性好,检测结果稳定(表1)。
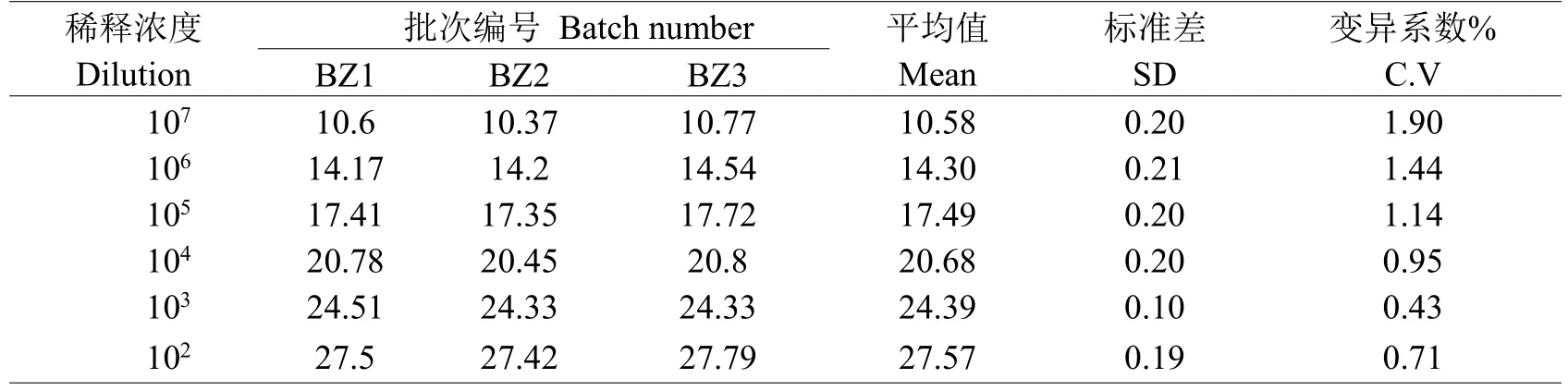
表1 标准品稳定试验结果Table 1 Test results of standard stability
2.5 在疫苗半成品中的效价监测上的应用及在临床诊断上的应用
利用建立的标准品对四批山羊痘半成品进行检测并与TCID50的结果相比较,TCID50≥104.5时判定为合格,检测结果表明GPV01为最低合格标准,其病毒含量为7.93×105(表2)。

表2 山羊痘半成品效力检测Table 2 Efficacy test of GPV semi-finished products
临床早期诊断,对新引入的羊群筛选,其中两只疑似皮肤痘肿的山羊均检测为山羊痘阳性,三份鼻腔粘液检测为阳性,痘肿皮肤与鼻腔粘液检测结果相符合,将皮肤无痘肿,鼻腔粘液检测为阳性的山羊隔离,该羊三天后皮肤出现痘肿,检测普通PCR检测为阳性。
3 讨论
荧光定量PCR是20世纪90年代美国AppLied Bisosystems公司率先推出的的一种新型的核酸定量技术,与普通PCR相比其直观性强,可以监督整个反应,又因其特异性强、敏感性好、精确性高被广泛的用于疾病的诊断、基因的监测、免疫分析等多个领域[7,8]。
山羊痘的疫苗的效力检测用细胞为绵羊羔睾丸原代细胞,该细胞获得难度大成本高,并且细胞活力受山羊的体重、月龄等因素影响致使效力检测结果不稳定,不能对病毒的毒价进行准确的定量。近年来荧光定量技术因其可精确定量的特点被用以疫苗半成品的效力检验,韩剑锋等建立H5亚型禽流感病毒灭活疫苗中病毒核酸的定量检测方法,分析其与HI抗体效价之间的相关性,探索禽流感灭活疫苗效力体外检验的方法[9]。陈锴等建立的荧光定量检测方法以替代猪瘟兔化弱毒苗的传统效力检验,快速准确的对疫苗半成品进行定量[4]。本研究将荧光定量的检测结果与细胞效力检测结果相比较,建立稳定的相关性,使其替代传统的检测方式,对疫苗半成品进行效力检测,可快速的淘汰不合格产品,降低检测成本。我们检测本次合格的检测Ct值为14.51,这与标准品稀释为106拷贝数/μL时的Ct值相近,为了避免因为标准品不同批次间产生的误差,我们定为每次检测的半成品的Ct值≥106拷贝数/μL标准品时,即判为合格,若是小于该值时,则需通过TCID50进行复核效检。
羊痘病毒属的成员之间的基因的同源性高达96%,血清学无明显的交叉反应,三种病毒的划分主要是依据易感宿主划分[10],本研究针对山羊痘病毒P32基因设计荧光定量PCR方法可同时用于该病毒属的临床诊断。程振涛等从利用探针法比临床诊断提早5 d从鼻腔分泌液中检测到了病毒粒子[11]。我们从新引入羊场的羊群中采集鼻腔粘液进行山羊痘筛选,同时对出现疑似皮肤痘肿的进行组织采集,两只疑似皮肤痘肿的山羊均检测为山羊痘阳性,鼻腔粘液检测均为阳性,该羊与羊群隔离后三天出现皮肤痘肿。结果表明本研究建立的荧光定量PCR作为羊痘的早期诊断,用于临床的疾病快速筛选。
4 结论
本研究成功建立了山羊痘荧光定量检测方法,即可用于疫苗半成品中病毒的精确定量用以替代半成品效力检验,同时也可用于临床山羊痘的早期诊断,及早确诊患病羊及时隔离建立健康羊群,为山羊痘疫病的控制提供重要的检测手段。
[1]阴正兴,许乐仁,周碧君,等.山羊痘的病理形态学观察[J].中国预防兽医学报,2005,927(5):402-407
[2]陈旭,齐凤坤,康立功,等.实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010,41(8):148-155
[3]蒋春燕.猪瘟病毒实时荧光定量PCR快速检测试剂盒的研制与应用[D].北京:中国兽医药品监察所,2006
[4]陈锴,姚伟华,王长江,等.荧光定量PCR作为猪瘟兔化弱毒疫苗效价检验替代方法的研究与应用[J].中国农业科学,2013,46(1):162-169
[5]王绍华,江焕贤,林曦,等.山羊痘弱毒细胞株培养冻干疫苗的研究[J].1988,19(4):279-284
[6]中国兽药典委员会.中华人民共和国兽药典[M].2010版.北京:中国农业出版社,2011
[7]尹航,杨焕良,陈艳,等.甲型H1N1流感病毒实时荧光定量PCR检测方法的建立[J].中国预防兽医学报,2013,1:36-39
[8]赵爱兰,孟琼,白向宁,等.双重实时荧光定量PCR检测产志贺毒素大肠埃希菌stx1和stx2基因[J].临床检验杂志,2013,31(4):241-244
[9]韩剑锋,宁宜宝,蒋桃珍,等.H5亚型禽流感灭活疫苗病毒基因的定量检测及其与HI抗体效价之间关系的分析[J].中华微生物学和免疫学杂志,2007,27(12):1139-1145
[10]殷震,刘景华,病毒学.动物病毒学[M].北京:科学出版社,1997
[11]程振涛,岳筠,李永明,等.山羊痘病毒TaqMan-MGB荧光定量PCR检测方法的建立与应用[J].生物工程学报,2009,25(3):464-472
Establishment and Application of Fluorescent Quantitation Efficacy Test for Vaccine of Goat Pox Virus
ZHANG Qian1,TANG Na1,2,WANG Jin-liang1,2,MIAO Li-zhong2,HU Lin-lin1, SUN Cui-ping1,SHEN Zhi-qiang1,2*
1.Shandong Lvdu Bio-Science&Technology Co.Ltd,Binzhou256600,China
2.Shandong Binzhou Animal Science&Veterinary Medicine Academy,Binzhou256600,China
To establish a sensitive and specific fluorescent quantitation PCR(FQ-PCR)determination method for goat pox virus(GPV)and to find a stable measurement standard sample as an alternative for efficacy test.A pair of primers was designed for GPV P32 gene to construct the standard plasma and test for sensitivity,specificity and stability.GPV-FQ-PCR was applied to detect semi-finished products of the vaccine and to compare with TCID50.The results showed that correlation coefficient of the standard curve was 0.9995,the amplification efficiency was 98%.The method only amplified goat pox viruses rather than other pathogens.The least copy number of high sensitivity detection in the template DNA was 100/μL. Three batches of standard samples were used in preparation.Variation coefficients were very stable between 0.43-1.9%.Ct value was 14.51 when TCID50≥104.5/mL in four batches of goat pox vaccine semi-finished products test.Established GPV-FQ-PCR method specifically detects nucleic acid of GPV,there is a correlation with the results of TCID50and could be used for semi-finished products efficacy test of GPV vaccine.
GPV;vaccine;fluorescent quantitation PCR(FQ-PCR);efficacy test
S8
:A
:1000-2324(2015)06-0865-05
2013-10-17
:2013-12-04
山东省现代农业产业技术体系羊创新团队(SDAIT09-011-07)
张倩(1984-),女,硕士,主要从事预防兽医学.E-mail:zqnew.shd@163.com
*通讯作者:Author for correspondence.E-mail:bzshenzq@163.com
