COPD营养状态模型对呼吸肌蛋白质分解代谢的影响
2015-03-24林志勇梁志科
林志勇 梁志科
广州市第一人民医院呼吸内科,广东广州 510180
慢性阻塞性肺疾病(COPD)是临床上常见的疾病,患者发病后临床症状较多,且多数患者伴有营养不良等症状。根据相关研究结果显示,营养不良是独立于气流阻塞程度的影响COPD患者治疗预后、死亡率等重要危险因素之一。目前,医学界普遍认为,COPD营养不良和炎症因子关系密切的是一种肿瘤坏死因子(TNF-α)[1]。为了探讨COPD营养状态模型对呼吸肌蛋白质分解代谢的影响,本研究对2013年4月~2014年4月在我院进行的80例大鼠相关研究结果进行分析,现报道如下。
1 资料与方法
1.1 一般资料
对我院培育的80例健康Wistar大鼠相关资料进行分析,将这些大鼠随机分为两组,实验中大鼠的平均体重为(210.52±10.34)g。研究中大鼠由湖南省人民医院实验动物中心提供;相关仪器如:TNF-αELISA检测试剂盒、猪胰弹性蛋白酶、邻苯二甲醛(OPA)、3-甲基组氨酸标准品、酪氨酸标准品、小动物肺功能仪等都由中南大学基础医学院机能学实验中心提供。实验人员拿到大鼠后将其放在有机玻璃箱内进行被动式吸烟,连续吸烟30d,并且在大鼠气管内注射20μL/100g猪胰弹性蛋白酶。然后,根据大鼠进食量等建立COPD营养不良大鼠模型。
1.2 方法
实验中将80只大鼠随机分为两组,对照组为营养正常大鼠,实验大鼠随机分为实验组。模型组反复熏香烟及气道内滴注胰蛋白酶方法建立COPD大鼠模型,采用气管内注入猪胰弹性蛋白酶、熏香烟和限制营养等相关方法建立COPD营养状态模型。对照组为营养正常大鼠,实验组静脉注射TNF-αMcAb进行干预。实验中对C2C12成肌细胞进行培养,鼠类C2C12成肌细胞系中含有10%V胎牛血清和100U/mL青霉素,100mg/mL链霉素,2mML-谷氨酸氨的DMEM培养基中在37℃和5% CO2条件下进行培养[2]。两组患者均渗生理盐水灌胃,实验组大鼠注入IND灌胃,连续干预14d后取尾静脉血测定干预前血清TNF-α水平。干预完成后继续饲养14d,测量各组大鼠干预后体重并处死全部动物,收取标本待测。
1.3 观察指标
实验中,观察两组大鼠PEF、FEV0.3、FEV0.3/FVC及其两组大鼠血浆葡萄糖糖、白蛋白、甘油三酯、呼吸肌TNF-α水平等指标。
1.4 统计学方法
2 结果
本次研究中,实验组大鼠PEF指标为(20.46±2.56)mL/S、FEV0.3指标为(3.69±0.37)mL、FEV0.3/FVC指标为(60.8±4.61)%,均低于对照组大鼠(P<0.05)。见表1。
表1 两组大鼠肺功能的比较(±s)
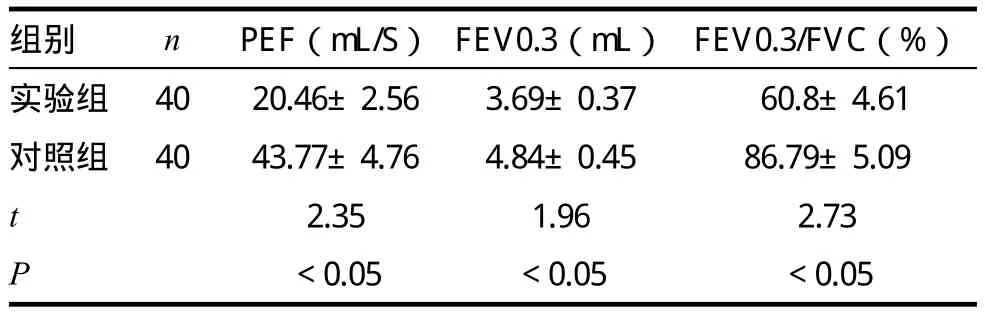
表1 两组大鼠肺功能的比较(±s)
组别 n PEF(mL/S) FEV0.3(mL) FEV0.3/FVC(%)实验组 40 20.46±2.56 3.69±0.37 60.8±4.61对照组 40 43.77±4.76 4.84±0.45 86.79±5.09 t 2.35 1.96 2.73 P<0.05 <0.05 <0.05
本次研究中,实验组大鼠血浆葡萄糖为(7.1±0.9)mmol/L、甘油三脂指标为(0.98±0.11)mmol/L,均高于对照组(P<0.05);白蛋白指标为(27.6±1.0)g/L,低于对照组大鼠(P<0.05)。见表2。
表2 两组血浆葡萄糖糖、白蛋白、甘油三酯测定结果比较(±s)
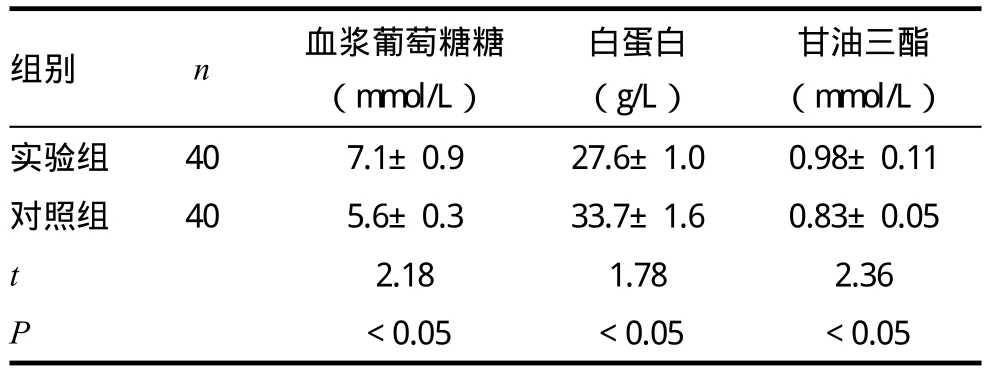
表2 两组血浆葡萄糖糖、白蛋白、甘油三酯测定结果比较(±s)
组别 n 血浆葡萄糖糖(mmol/L)甘油三酯(mmol/L)实验组 40 7.1±0.9 27.6±1.0 0.98±0.11对照组 40 5.6±0.3 33.7±1.6 0.83±0.05 t 2.18 1.78 2.36 P<0.05 <0.05 <0.05白蛋白(g/L)
本次研究中,实验组大鼠膈肌TNF-α浓度为(31.58±0.98)pg/mL、肋间内肌匀浆中TNF-α浓度为(29.88±1.30)pg/mL,均高于对照组(P<0.05)。见表3。
表3 两组呼吸肌TNF-α水平比较(±s,pg/mL)

表3 两组呼吸肌TNF-α水平比较(±s,pg/mL)
组别 n 膈肌TNF-α浓度 肋间内肌匀浆中TNF-α浓度实验组 40 31.58±0.98 29.88±1.30对照组 40 23.75±1.95 21.31±2.03 t 1.69 2.48 P<0.05 <0.05
3 讨论
慢性阻塞性肺疾病是临床上常见的疾病,这种疾病机制复杂,诱因也比较多,属于常见的呼吸内科疾病,目前,这种疾病已经成为了一种公共卫生性疾病。对于慢性阻塞性肺疾病如果不采取积极有效的方法治疗将会演变为肺心病,甚至威胁患者死亡。根据相关研究结果显示:目前,我国COPD患者发病率较高,并且年龄在40岁以上者占84%[3]。本次研究中,建立的COPD模型具备人类COPD的最重要的两个病理解剖学特征—气道非特异性炎症和肺气肿,并具有人类COPD的最重要的病理生理学特征一阻塞性通气障碍。
TNF-α是一种炎症因子,该因子能够有效的诱导肿瘤组织出血坏死,并且具有相当复杂的生物活性,能够在人体免疫和非免疫等状态下发挥作用。这种因子除了有效的抑制肿瘤发生外,还能够参与炎症、蛋白质的分解代谢等活动。TNF-α还可以引起机体负氮平衡,促进肌肉蛋白质分解。本次研究中,实验组大鼠膈肌TNF-a浓度为(31.58±0.98)pg/mL、肋间内肌匀浆中TNF-a浓度为(29.88±1.30)pg/mL,均高于对照组(P<0.05),这个结果和相关研究结果类似。
本次研究中,实验组大鼠血浆葡萄糖为(7.1±0.9)mmol/L、甘油三脂指标为(0.98±0.11)mmol/L,均高于对照组(P<0.05);白蛋白指标为(27.6±1.0)g/L,低于对照组大鼠(P<0.05),这个结果和相关研究结果类似。由此可以看出:TNF-α在COPD营养不良发生中发挥重要作用。但是,TNF-αMcAb不能够将COPD模型大鼠营养状态达到与对照组相同的水平,可以看出在COPD营养不良中还可能于其他因素关系密切[4]。但是,我们可以看出:静脉注射TNF-α能够增加人体骨骼肌蛋白分解代谢,能够有效的抑制蛋白质的何从,从而引起人体骨骼肌蛋白质质量下降。
综上所述,TNF-α是引起COPD大鼠发生营养不良以及呼吸肌蛋白质分解代谢率升高的原因之一,治疗时应该采取积极有效的方法提高临床治愈率。
[1] 徐卫国,罗勇,吴靖川,等.不同营养状态COPD肿瘤坏死因子-α测定及其临床意义[J].中国实用内科杂志,1999,22(11):854-855.
[2] 林桦,孙圣华,高健,等.吲哚美辛对慢性阻塞性肺疾病大鼠肿瘤坏死因子α和骨骼肌蛋白质分解代谢的影响[J].中华内科杂志,2010,49(9):776-780.
[3] 宋小莲,王昌惠,白冲.脂多糖结合熏烟法和单纯熏烟法建立慢性阻塞性肺病大鼠模型的比较[J].第二军医大学学报,2010,30(3):246-249.
[4] 贺英,朱明,曲海,等.咪达唑仑和吗啡联合治疗COPD有创通气患者的临床效果观察[J].昆明医学院学报,2011,11:115-117.
[5] 陈逶,余晓丹.慢性阻塞性肺疾病患者营养状况分析及对预后的影响[J].中国基层医药,2012,19(2):223-224.
[6] 李复红,杨德昌.慢性阻塞性肺疾病急性加重期伴甲功异常42例临床分析[J].实用医技杂志,2007,14 (21):2945-2946.
[7] 刘建明,廖前德,唐文祥,等.TNF-α对慢性阻塞性肺疾病模型鼠营养状态和呼吸肌蛋白质分解代谢的影响[J].南方医科大学学报,2012,32(4):116-120.
[8] 孙圣华,唐文祥,刘纯,等.肿瘤坏死因子α对慢性阻塞性肺疾病大鼠模型呼吸肌蛋白质分解代谢的影响[J].中华结核和呼吸杂志,2007,30(3):186-191.
[9] 单丽囡,刘小虹,钟亮环.培土生金法配合西药治疗慢性阻塞性肺疾病稳定期的临床观察[J].湖北中医杂志,2007,29(4):26-27.
[10] 张鸿,王秋月,侯刚,等.慢性阻塞性肺疾病患者血清瘦素水平与营养不良的关系[J].中国医科大学学报,2006,35(2):168-170.
[11] 郭韶梅,王爱平,蔡金莲.老年COPD急性加重期患者免疫及营养状况临床分析[J].实用临床医学,2006,12(7):75-76.
[12] 周新,白春学.慢性阻塞性肺疾病的预防与治疗[M].北京:人民卫生出版社,2009:4.
[13] 余晓丹,汪俊.COPD营养状况与炎症反应的关系研究[J].中国现代医生,2012,50(8):72-74.
