盐胁迫对白桦光合特性及叶绿素荧光参数的影响
2015-03-23徐焕文刘桂丰
徐焕文 刘 宇 姜 静 刘桂丰
(林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040)
盐胁迫对白桦光合特性及叶绿素荧光参数的影响
徐焕文 刘 宇 姜 静 刘桂丰
(林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040)
通过对白桦在盐胁迫下的光合特性及叶绿素荧光参数变化进行测定,研究其耐盐能力,为在白桦中筛选耐盐家系提供依据。以6个半同胞家系的桦树为试验材料,采用0.4% NaCl漫灌的方法,每3 d胁迫1次,研究盐胁迫下白桦叶片光合特性及叶绿素荧光参数的变化。结果表明:盐胁迫下叶绿素相对含量随胁迫时间延长呈现先升高后降低的趋势;净光合速率则为下降的趋势,其有气孔限制和非气孔限制2方面因素的影响;各家系的叶片荧光参数Fv/Fm随胁迫时间延长呈现先升高后降低的趋势,φPSⅡ和qP均为下降的趋势,qN保持不变或波动较大。根据盐胁迫试验得出结论,MP1和MP2家系的叶绿素相对含量高且变化幅度小,净光合速率、Fv/Fm、PSⅡ和qP降低幅度小,qN保持稳定,因此,MP1和MP2为耐盐性强的家系。
白桦;光合特性;叶绿素荧光参数;盐胁迫
目前,东北地区土壤盐渍化面积逐渐增大,盐碱土壤带有的高渗透压及离子毒性会对林木生长产生极大的负面影响,往往导致林木大面积死亡,所以,对耐盐性树种的选育及耐盐机理的研究变得尤为重要[1]。而植物光合、荧光生理指标的测定是在植株活体条件下进行的,对植株不造成破坏,能够迅速、便捷的反映出植物在盐胁迫条件下的生理反应,因而被国内外众多学者广泛应用于树种耐盐性的评价及耐盐机理的研究[2-10]。但对东北常见的桦木树种的耐盐性评价却较少,对于白桦耐盐机理的研究更是未见报道。因此,本研究从土壤盐渍化较高的新疆阿勒泰地区引入当地培育的桦树品种,以高盐溶液(NaCl)对其进行盐胁迫处理,进而对其光合指标、叶绿素荧光参数、叶绿素含量等进行测定,为耐盐家系的评价及耐盐机理的研究提供理论依据。
1 材料与方法
1.1 材料与处理
本试验在东北林业大学白桦强化种子园温室内进行,温室内最高温度32 ℃,日平均温度26 ℃,相对湿度60%。试验材料主要包括6个1年生桦树半同胞家系苗木:白桦(Betulaplatyphylla)×欧洲白桦(B.pendula)杂交子代半同胞家系(CK),5个从新疆阿勒泰地区引种的耐盐桦树:MP1、MP2,Y1、JD2和JD3(由新疆阿勒泰地区林科所王健研究员提供),其中MP1和MP2为吉尔吉斯桦(B.kirghisorum),Y1为疣枝桦,JD2和JD3为吉尔吉斯桦的杂交子代,每个家系选择生长一致的9株苗木进行测定分析。
盐处理采用0.4%的NaCl漫灌,每3 d胁迫1次,每次1 L,胁迫4次。
1.2 试验方法
1.2.1 叶绿素相对含量的测定 选取生长状态一致的功能叶,每株苗木测定3个叶片,分别在选定叶片的叶柄处、叶中心、叶尖处用SPAD-502叶绿素仪测定叶绿素相对含量(SPAD)。
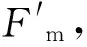

1.2.3 光合指标的测定 利用Li-6400光合测定系统分别于盐胁迫前及盐胁迫3、12 d后的9:00—11:00,对其进行光合指标的测定,每个家系测定9片叶片。测定时光照强度设定为 1 000 μmol/(m2·s),CO2浓度设定为380 μmol/mol,其他环境因子没有特别控制,测定叶片瞬时净光合速率(Pn,μmol/(m2·s))、气孔导度(Gs,mol/(m2·s))、胞间CO2浓度(Ci,μmol/mol)和蒸腾速率(Tr,mol/(m2·s)),同时利用公式WUE=Pn/Tr计算瞬时水分利用效率WUE(μmol/mol)。
1.3 数据处理
应用Excel和SPSS 16.0进行数据处理。
2 结果与分析
2.1 盐胁迫过程中白桦半同胞家系各指标的方差分析
白桦半同胞家系各指标的方差分析结果见表1。
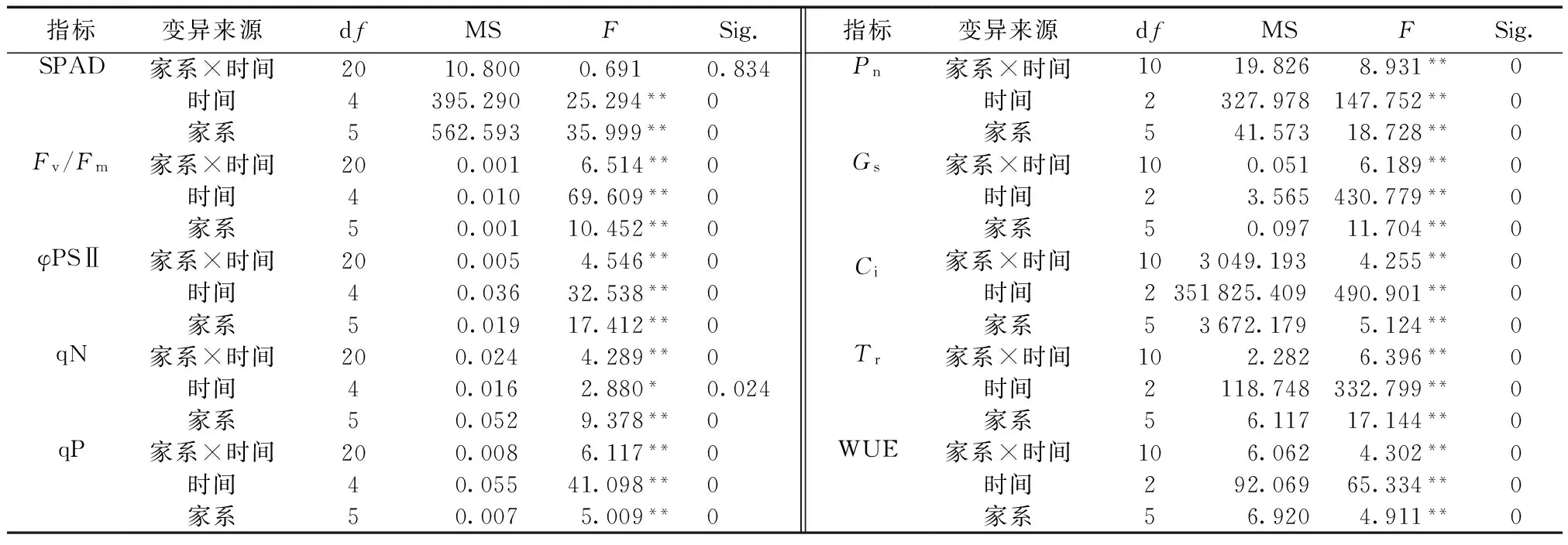
表1 白桦半同胞家系各指标方差分析Tab.1 Variance analysis of each index of Betula platyphylla half-sibling families
由表1可知,叶绿素的相对含量在家系间、时间间均达到差异极显著的水平;4个叶绿素荧光参数、5个光合指标在各家系间均达到差异极显著水平。
2.2 盐胁迫对白桦苗木叶绿素相对含量的影响
盐胁迫后白桦苗叶绿素相对含量值变化趋势见图1。
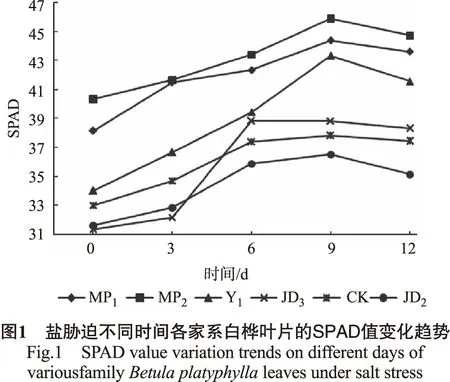
由图1可以看出:在胁迫后的前9 d内各家系的SPAD值均呈现上升趋势,9~12 d各家系的SPAD值均呈下降趋势,并且在盐胁迫过程中MP1、MP2、Y1等3个家系的SPAD值始终显著高于CK。
2.3 盐胁迫对白桦苗木叶绿素荧光参数的影响
最大光化学效率(Fv/Fm),指的是暗适应下PSⅡ反应中心完全开放时的最大光化学效率,其值反映植物的潜在最大光合能力[11]。盐胁迫过程中各家系荧光动力学参数变化趋势见图2。盐胁迫前各家系间的Fv/Fm值差异并未达到显著水平。在盐胁迫处理3 d后,JD2和JD3家系的Fv/Fm值高于CK,但未达到显著水平。6 d时Y1、MP2家系的Fv/Fm值分别显著高出CK 1.69%、1.43%。9 d时各家系的Fv/Fm值与CK无显著差异,但MP2和MP1的Fv/Fm值均大于CK。12 d时 MP2、MP1、Y1分别显著高出CK 3.17%、2.91%、2.91%。 CK、JD2、MP1、MP2家系均呈现上升—下降—上升—下降的波动趋势,其中MP1、MP2家系的Fv/Fm值始终高于CK;Y1、JD2呈现上升—下降的趋势(图2a)。

PSⅡ实际光化学效率(φPSⅡ),反映在光照下PSⅡ反应中心部分关闭情况下的实际光化学效率[11]。盐胁迫前MP2、MP1、JD3、JD2的φPSII值与CK差异显著,分别高出CK 5.15%、5.00%、4.09%、2.88%。盐胁迫3 d后,MP1、MP2、Y1的φPSII值分别显著高出CK 11.54%、11.22%、5.45%,JD2、JD3的值低于CK。在盐胁迫6 d和9 d后,CK与各家系的φPSⅡ值均无显著性差异。盐胁迫12 d后,各家系(JD2除外)的φPSII值均显著高于CK(0.568),其中MP2的值最大(0.667)。在盐胁迫过程中,JD3、JD2、CK的φPSII值表现为下降—上升—下降的趋势,但其中JD2的波动性明显强于CK;MP1和MP2的φPSII值持续较高后稳定下降,而Y1的表现则为稳定下降(图2 b)。
光化学淬灭系数(qP),指的是由光合作用引起荧光淬灭,反映植物光合活性的高低[11]。盐胁迫前CK的qP值最小,显著低于除Y1以外的各家系。在盐胁迫处理3 d后,MP1、MP2、Y1的qP值分别显著高出CK 13.22%、11.02%、6.73%。6、9 d后,各家系的qP值与CK差异均不显著。12 d后MP2显著高出CK 4.71%。随着盐胁迫时间加长JD2、JD3和CK均表现为下降—上升—下降的趋势,其中JD2、JD3家系的波动性强于CK;MP1、MP2和Y1均表现出持续下降的趋势(图2c)。
非光化学淬灭系数(qN),指的是由热耗散引起的荧光淬灭,反映植物耗散过剩光能为热的能力,即光保护能力[11]。在盐胁迫前,Y1的qN值最大,与CK差异不显著。但在盐胁迫处理3 d后,JD2的qN值显著高出CK 21.40%;6 d后,各家系间的qN值差异不显著;9 d后,JD3的qN值显著高出CK 47.84%。随盐胁迫时间延长,MP1和MP2的qN值稳定不变;JD3家系则表现为上升—下降—上升—下降的趋势,JD2、Y1和CK家系表现为上升的趋势(图2 d)。
2.4 盐胁迫对白桦叶片光合指标的影响
盐胁迫不同时间各家系的光合指标均值及多重比较结果见表2。

表2 盐胁迫不同时间各个家系的光合指标均值及多重比较Tab.2 Photosynthetic index mean and multiple comparisons of various families at different times in the process of salt stress
由表2可知,盐胁迫前MP2家系的净光合速率(Pn)、气孔导度(Gs)最大,显著高出CK 9.67%、8.20%;MP2和MP1家系的蒸腾速率(Tr)分别显著高出CK 17.50%、13.08%。盐胁迫3 d后MP2、Y1、MP1、JD2的Pn值分别显著高出CK 24.06%、15.80%、15.66%、14.06%;各家系(MP2除外)的Gs和Tr均显著高于CK;MP1、JD2、JD3家系的Ci值显著高于CK;MP2的WUE显著高出其他家系,高于CK 27.88%。盐胁迫12 d后 MP2、MP1和Y1家系的Pn值分别显著高出CK 42.09%、48.76%、39.25%;MP1的Gs值最大,为0.26 mol/(m2·s),是CK的2.6倍,其次是MP2、Y1,分别是CK的1.7、1.8倍;MP1的Ci最大(206.00 μmol/mol),显著高于CK(137.33 μmol/mol)的50.00%;MP2、MP1和Y1的Tr(3.47、3.79、2.95 mol/(m2·s))显著高于CK(1.60 mol/(m2·s))。各个家系瞬时净光合速率(Pn)在盐胁迫后12 d比胁迫前降低(其中MP1和MP2的降低幅度最小),气孔导度(Gs)降低,胞间CO2浓度(Ci)降低,蒸腾速率(Tr)下降,水分利用效率(WUE)升高。
3 结论与讨论
当植株处于盐胁迫条件下,其渗透压、叶绿素含量等指标均会发生改变[12-14]。对参与本试验的6个白桦家系在盐胁迫期间叶绿素含量变化的研究发现,叶绿素含量随胁迫时间延长呈先升高后降低的趋势,这与克热木·伊力等[13]、杨淑萍等[14]的试验结果相一致。在一定盐浓度内,盐胁迫引起植物叶片叶绿素含量增加的原因可能是盐胁迫下植物叶片叶绿素与叶绿体蛋白间的结合变得松弛, 使叶绿素容易被提取,叶绿素含量升高[13,15]。高盐溶液引起叶片叶绿素含量降低的原因:土壤盐胁迫可能破坏植物叶绿体超微结构,使体内叶绿素含量下降[16-18];盐胁迫提高了叶绿素酶的活性, 促进了叶绿素降解,从而引起叶绿素含量减少[19]。通过进一步分析发现,MP1、MP2、JD2、JD3和Y1等5个家系的变化幅度明显高于CK,说明这5个家系对于盐离子的敏感程度要强于CK,并且MP1、MP3、Y1这3个家系SPAD值均高于CK,说明这3个家系的耐盐能力强于CK。
在正常生理状态下,植物叶片叶绿素吸收的光能主要通过光合作用、叶绿素荧光和热耗散3种途径消化掉,这3种途径有着此消彼长的关系,叶绿素荧光参数可以反映光合作用和热耗散的情况[20]。叶绿素荧光参数Fv/Fm是反映光系统Ⅱ活性的可靠指标[21]。盐胁迫后各家系的Fv/Fm值先升高后降低,与叶片中叶绿素含量的变化趋势相一致,说明叶绿素含量的升高可使PSⅡ的最大光化学效率升高,当叶片中钠离子的浓度达到一定程度时,破坏叶绿体的结构,进而使植物的光能转换效率降低,其中MP1、MP2和Y1家系的Fv/Fm变化幅度小于CK,说明MP1、MP2和Y1家系的最大光化学效率受盐胁迫的影响小。盐胁迫降低各家系的φPSⅡ、qP,其中MP1和MP2家系的降低幅度最小,说明盐胁迫的伤害部位可能位于PSⅡ氧化传递链或PSⅡ反应中心或PSⅡ原初电子受体,其降低了φPSⅡ反应中心开放部分的比例,抑制叶片φPSⅡ光合电子传递能力, 从而限制了为光合碳同化提供更充足的ATP和NADPH,植物的光合活性降低[22],这一结果与盐胁迫下净光合速率下降相吻合。盐胁迫过程中JD3、JD2、Y1、CK的qN值均出现波动且升高的趋势,说明当受到盐胁迫时这些家系启动非辐射热能量耗散机制将过剩光能以热的形式耗散掉,保护光系统免受盐胁迫的破坏,防止净光合速率的过度下降,这可能是植物对生存环境适应的一种保护机制[14,23]。MP1和MP2家系的qN值波动小,说明在该盐胁迫浓度下,MP1和MP2家系的光合机构没有破坏,其抗盐能力较强。
叶片光合色素含量是反映植物光合能力的一个重要指标, 其含量的稳定有利于植株在胁迫下维持正常的光合作用, 从而增强植株对盐胁迫的耐受能力[18]。盐胁迫前及盐胁迫3、12 d后的瞬时净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、水分利用效率(WUE)等性状在家系间均达到差异极显著的水平,说明植物在逆境条件下,其自身光合作用会产生相应的变化。气孔是植物叶片与外界进行气体交换的通道,其开放程度能直接影响光合作用、呼吸作用和蒸腾作用[24]。气孔的开放程度与外界环境变化息息相关,高盐溶液会引起渗透胁迫导致气孔部分关闭[25-26],进而影响净光合速率(Pn)。盐胁迫前后Pn值的降低有气孔限制和非气孔限制2个原因,气孔导度(Gs)降低,进入气孔的CO2含量减少,胞间CO2浓度(Ci)降低引起的净光合速率(Pn)降低为气孔限制,气孔导度(Gs)降低但胞间CO2浓度(Ci)提高引起的净光合速率(Pn)降低则为非气孔限制[27-29]。盐胁迫3 d后所有家系净光合速率(Pn)下降的原因分为2类:CK、MP2的净光合速率(Pn)降低是气孔限制占主导因素;其余4个家系净光合速率(Pn)降低说明是非气孔限制占主导因素。在盐胁迫第12 d时,参试的6个家系气孔导度(Gs)、胞间CO2浓度(Ci)、净光合速率(Pn)均降低,说明气孔限制均占主导因素。本研究结果证明,随着盐胁迫试验的进行,气孔限制能够逐渐代替非气孔限制占主导因素,进而影响光合速率,这一结果与张志刚等[8]、克热木·伊力等[13]的结论相一致。在盐胁迫前、(12 d),MP1、MP2家系的净光和速率下降幅度比CK小, 说明这2个家系有较强的耐盐性。
盐胁迫降低植物的净光合速率,其中耐盐白桦(MP1、MP2)的变化幅度小。盐胁迫下耐盐白桦(MP1、MP2)的Fv/Fm、φPSⅡ、qP的下降幅度小,而NPQ保持稳定,说明盐胁迫对耐盐白桦PSⅡ原初光能转换效率、PSⅡ潜在活性影响小,对其光系统未产生破坏。根据以上研究MP1和MP2家系的耐盐性强。
[1] Alarcon J,Sanchez-Blanco M,Bolarin M,et al.Water relations and osmotic adjustment inLycopersiconesculentumandL.pennelliiduring short-term salt exposure and recovery[J]. Physiol Plant. 1993,89:441-447.
[2] 韩志平,张海霞,刘渊,等. NaCl胁迫对不同品种黄瓜种子萌发特性的影响[J].北方园艺,2014(1):1-5.
[3] 王清华,杨建平,张中华,等. 盐胁迫对不同品种辣椒种子萌发特性的影响[J].西北农业学报,2007,16(3):136-140.
[4] 杨敏生,李艳华,梁海永,等. 白杨派杂种无性系及其亲本光合和生长对盐胁迫的反应[J].林业科学,2006,42(4):19-26.
[5] Brugnoli E, Lauteri M. Effects of salinity on stomatal conductance,photosynthetic capacity, and carbon isotope discrimination of salt-tolerant(GossypiumhirsutumL.)and salt-sensitive(PhaseolusvulgarisL. )C3non-halophytes[J]. Plant Physiology, 1991,95:628-635.
[6] Brugnoli E,Bjorkman O.Growth of cotton under continuous salinity stress:influence on allocation pattern,stomatal and non-stomatal components of photosynthesis and dissipation of excess light energy[J].Planta,1992,187:335-347.
[7] 姜英,黄志玲,郝海坤,等.不同光照强度下红锥幼茴叶绿素荧光参数的季节变化[J].西南林业大学学报,2014,34(2):8-12.
[8] 张志刚,尚庆茂. 低温、弱光及盐胁迫下辣椒叶片的光合特性[J].中国农业科学,2010,43(1):123-131.
[9] Baker N R. A possible role for photo system Ⅱ in environmental perturbations of photosynthesis[J]. Physiologic Planetarium,1991,81(4):563-570.
[10] 张仁和,郑友军,马国胜,等,干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
[11] 韩志国. 20种湿地植物的叶绿素荧光特性[D].广州:暨南大学,2006.
[12] 刘金定,朱召勇,樊宝香,等. 棉花品种在不同浓度盐胁迫下的生理表现[J].中国棉花,1995,22(9):16-17.
[13] 克热木·伊力,侯江涛,买合木提,等. 盐胁迫对扁桃光合特性和叶绿体超微结构的影响[J].西北植物学报,2006,26(11):2220-2226.
[14] 杨淑萍,危常州,梁永超.盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J].中国农业科学,2010,43(8):1585-1593.
[15] Strogonov B P. Structure and function o f plant cell in saline habitats [M]. New York:Halsted Press,1973:78-83.
[16] 汪贵斌,曹福亮. 盐分和水分胁迫对落羽杉幼苗的生长量及营养元素含量的影响[J].林业科学,2004,40(6):56- 62.
[17] 吴永波,薛建辉. 盐胁迫对3种白蜡树幼苗生长与光合作用的影响[J].南京林业大学学报(自然科学版),2002,26(3):19-22.
[18] 姜超强,李杰,刘兆普,等,盐胁迫对转AtNHX1基因杨树光合特性与叶绿体超微结构的影响[J].西北植物学报,2010,30(2):301-308.
[19] 武俊英,刘景辉,李倩. 盐胁迫对燕麦幼苗生长,K+、Na+吸收和光合性能的影响[J].西北农业学报,2010,19(2):100-105.
[20] 于凤,高丽,闫志坚,等. 库布齐沙地6种植物叶绿素荧光参数比较[J].草业科学,2012,29(1):83-87.
[21] 赵曦阳,王军辉,张金凤,等.楸树无性系叶绿素荧光及生长特性变异研究[J].北京林业大学学报,2012,34 (3):41-47.
[22] 张会慧,张秀丽,胡彦波,等.高粱-苏丹草杂交种的生长特性和光合功能研究[J].草地学报,2012,20(5):881-887.
[23] 孙璐,周宇飞,李丰先,等,盐胁迫对高粱幼苗光合作用和荧光特性的影响[J].中国农业科学 2012,45(16):3265-3272.
[24] 李月灵,金则新,管铭,等. 铜胁迫条件下土壤微生物对海州香薷光合特性和叶绿素荧光参数的影响[J].植物研究,2013,33(6):684-689
[25] 张川红,尹伟伦,沈应柏. 盐胁迫对国槐与核桃气孔的影响[J].北京林业大学学报,2002,24(2):1-5.
[26] 朱广石. 牧草种子不同耐盐性与细胞组织关系初步研究[J].农业与技术,2004,24(1):34-39.
[27] 邢庆振,郁松林,牛雅萍,等.盐胁迫对葡萄幼苗光合及叶绿素荧光特性的影响[J].干旱地区农业研究,2011,29(3):96-100.
[28] 柯裕州,周金星,卢楠,等. 盐胁迫对桑树幼苗光合生理及叶绿素荧光特性的影响[J].林业科学研究,2009,22(2):200-206.
[29] Farquhar G D,Sharkey T D. Stomata conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
(责任编辑 赵粉侠)
Changes of Photosynthetic Characteristics and Chlorophyll Fluorescence Parameters ofBetulaplatyphyllaUnder Salt Stress
XU Huan-wen,LIU Yu,JIANG Jing,LIU Gui-feng
(State Key Laboratory of Tree Genetics and Breeding(Northeast Forestry University),Harbin Heilongjiang 150040,China)
Through measuring photosynthetic characteristics and chlorophyll fluorescence parameters ofBetulaplatyphyllaunder salt stress to study its salt tolerance,we would provide the basis for salt tolerance birch screened.Six half-sib families ofBetulaplatyphyllaas test material,with 0.4 percentage NaCl irrigation methods and applying stress once every 3 d,changes of photosynthetic characteristics and chlorophyll fluorescence parameters under salt stress were researched.The results showed that under salt stress, the relative content of chlorophyll increased first,and then decreased,yet net photosynthetic rate declined, which was resulted from stoma limitation and non-stoma limitation.Chlorophyll fluorescence parametersFv/Fmincreased at first and then reduced,φ PS Ⅱ and qP dropped, yet qN remained constant or fluctuated obviously.In conclusion,the relative content of chlorophyll of MP1and MP2family were high and had small change ranges, moreover,net photosynthetic rate,Fv/Fm,φPSⅡ and qP declined slightly,while qN remained stable,so MP1and MP2family showed more tolerant to salt than others.
Betulaplatyphylla;photosynthetic characteristics;chlorophyll fluorescence parameters;salt stress
2015-01-05
国家科技支撑计划项目(2012BAD21B02)资助。
刘桂丰(1960—),男,教授。研究方向:林木遗传育种。Email:liuguifeng@126.com。
10.11929/j.issn.2095-1914.2015.04.004
S718.43
A
2095-1914(2015)04-0021-06
第1作者:徐焕文(1989—),女,硕士生。研究方向:林木遗传育种。Email:1226945630@qq.com。
