双波长HPLC同时测定氮沉降处理下杜仲皮和叶中的5种成分
2015-03-23哀建国杜江丽周爱存金松恒宋新章
哀建国,杜江丽,周爱存,金松恒,宋新章
双波长HPLC同时测定氮沉降处理下杜仲皮和叶中的5种成分
哀建国1,杜江丽2,周爱存2,金松恒2,宋新章2
(1.浙江农林大学 信息工程学院,浙江 临安 311300;2.浙江农林大学 林业与生物技术学院,浙江 临安311300)
建立双波长高效液相色谱法(HPLC)同时测定模拟氮沉降处理下杜仲Eucommia uimoides皮和叶中松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷等5种活性成分含量的方法。采用Agilent ZORBAX SB-C18柱(250.0 mm×4.6 mm,5 μm),以乙腈(A)-2.0 g·kg-1磷酸水溶液(B)进行梯度洗脱(0~12 min,10%A;12~25 min,13%A;25~50 min,30%A;50~65 min,60%A);流速为0.8 mL·min-1;检测波长203 nm,240 nm;柱温30℃。结果表明:松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸、京尼平苷等在各自的线性范围内与其峰面积积分值呈良好的线性关系。整个实验期间,杜仲皮和叶中5种成分含量对施氮处理产生了不同的响应,且随季节在变动。该方法能准确、快速地对杜仲皮和叶中多种有效成分同时进行测定,可较好反映浙江高氮沉降区特色名贵药材杜仲皮和叶中多种有效成分的变化。图3表6参13
经济林学;杜仲;模拟氮沉降;药用成分;双波长高效液相色谱法
杜仲Eucommia ulmoides又名思仙、思仲、木棉等,是中国特有的贵重中药材和工业提胶原料树种。杜仲自古便被列为中药上品。近代医学进一步研究表明,它的一些重要次生代谢物如松脂醇二葡萄糖苷、绿原酸、桃叶珊瑚苷和黄酮等具有利胆、降压、调节血脂、抗菌、抗氧化、增强免疫力及兴奋中枢神经系统等多种药理作用[1]。杜仲在国内栽培区域大致位于华东、华中和西南暖温带气候区内[2],其分布区大体上和长江流域相吻合,而此区域亦是中国氮沉降分布最集中地区。目前,氮沉降对植物光合生理[3-4]、生产力[5-7]、营养元素含量[8-9]等的影响研究较多,但大多是以农作物、经济作物和部分森林树种或整个森林生态系统为对象,对药用植物特别是木本药用植物研究较少,对其药用成分含量影响的研究更是凤毛麟角。此外,在杜仲活性成分检测分析方面亦有很多报道,主要是测定杜仲叶中绿原酸或杜仲皮中松脂醇二葡萄糖苷的含量[10-13],而同时检测杜仲皮和叶中多种活性成分的研究相对较少。为提高浙江高氮沉降区特色名贵药材杜仲的药性品质,本研究建立双波长高效液相色谱法(HPLC)同时测定模拟氮沉降处理下的杜仲幼苗皮和叶中5种活性成分的质量分数,这对于增强浙江省道地药材杜仲的国内外市场竞争力具有十分迫切的必要性和现实意义。
1 仪器与试药
1.1 仪器
Waters2695高效液相色谱仪(Waters 2996 DAD检测器);AP-01P真空泵(杭州赛析科技有限公司);4504MP电子天平(万分之一);SK8200HP-超声波清洗器(上海科导);数显恒温水浴锅(HH-4,江苏环宇科学仪器厂);DZF-0真空干燥箱(上海跃进医疗器械厂)。
1.2 试药
流动相用乙腈、甲醇为色谱纯,其他试剂为分析纯,均购于临安卡尔生物技术有限公司。水为娃哈哈纯净水。松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸、京尼平苷等对照品购于上海金穗生物科技有限公司 (批号:20130919,20130903,20130913,20120828,20130902,质量分数均≥98%);杜仲叶和皮采自浙江省临安市浙江农林大学杜仲幼苗试验大棚。采集前,结合目前杭州地区的氮沉降量(30.9 kg·hm-2·a-1),将受试杜仲苗分为对照(ck:0 kg·hm-2·a-1),低氮(LN:30 kg·hm-2·a-1),中氮(MN:60 kg·hm-2·a-1)等3个处理组,于2013年5-10月期间,每月1次定期喷洒配制的不同强度的NH4NO3溶液。模拟氮沉降处理后隔25 d取叶片和树皮(含对照)带回实验室,清洗干净,80℃烘干,粉碎,并用索氏提取法进行预处理,以除去杜仲胶、叶绿素等脂溶性成分,常温避光储藏备用。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent ZORBAX SB-C18柱(250.0 mm×4.6 mm,5 μm);柱温30℃;进样量30 μL;流动相为乙腈(A)-2.0 g·kg-1磷酸水溶液(B),梯度洗脱,洗脱程序(0~12 min,10%A;12~25 min,13%A;25~50 min,30%A;50~65 min,60%A);流速0.8 mL·min-1;检测波长203 nm(检测松脂醇二葡萄糖苷和桃叶珊瑚苷)和240 nm(检测绿原酸、京尼平苷酸和京尼平苷),以保留时间定性,峰面积定量。此色谱条件下对照品与供试品分析图谱见图1。
2.2 混合对照品溶液的制备
分别精密称取松脂醇二葡萄糖苷(PDG),桃叶珊瑚苷(AU),绿原酸(CA),京尼平苷酸(GPA)和京尼平苷(GP)对照品各4.23,2.66,5.86,3.29和6.4 mg,置同一容量瓶中,加体积分数为50%甲醇溶解并稀释至刻度,得到松脂醇二葡萄糖苷0.006 768 g·L-1,桃叶珊瑚苷0.042 56 g·L-1,绿原酸0.028 g·L-1,京尼平苷酸0.052 g·L-1,京尼平苷0.005 12 g·L-1混合对照品溶液,过0.45 μm微孔滤膜,备用。
2.3 供试品溶液的制备
准确称取已除杂的杜仲叶、皮粉末各0.5 g(精确到0.001 g),分别置于50 mL具塞锥形瓶中,各加入25 mL体积分数为70%甲醇,密塞,称量。超声提取40 min(功率为180 W,频率为40 kHz),放冷,再称量,用体积分数为70%甲醇补足减失的质量,滤过。滤渣同法再提取1遍,合并2次提取液于50 mL容量瓶中,冷却定容至刻度,摇匀过0.45 μm微孔滤膜,取续滤液,即得。
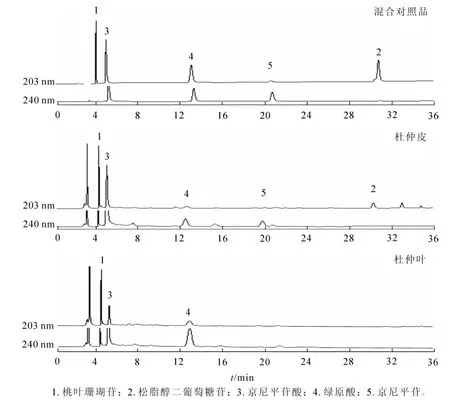
图1 杜仲皮和叶的高效液相色谱图Figure 1 HPLC chromatograms of the bark and leaves of Eucommia uimoides
2.4 线性关系的考察
分别精密吸取混合对照品溶液1,5,10,20,40,70,100 μL进样,按照 “2.1”项色谱条件测定峰面积。以混合对照品的进样量(x,μg)为横坐标,峰面积积分值(y)为纵坐标,进行线性回归,得回归方程。结果表明:松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷进样量与各自色谱峰面积线性关系良好(表1)。
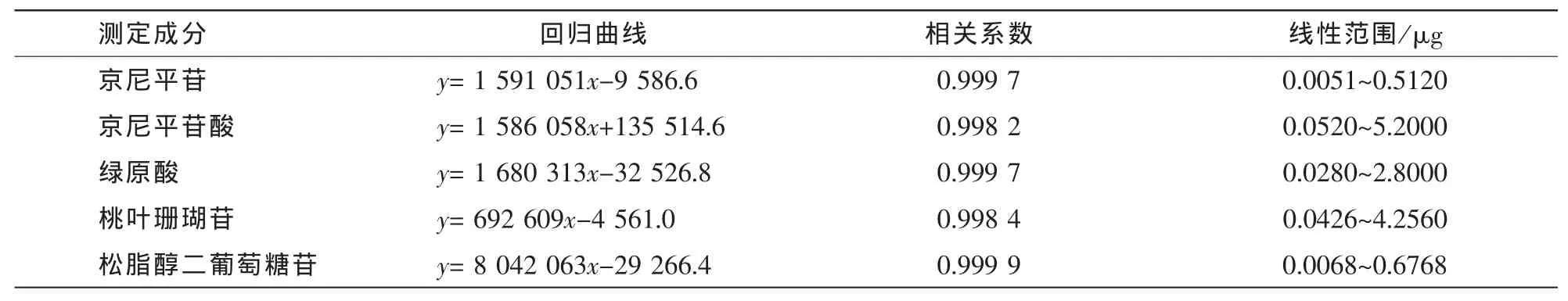
表1 杜仲中5种成分的标准曲线Table 1 Standard curve of five compounds in Eucommia uimoides
2.5 精密度试验
精密吸取混合对照品溶液10 μL,按照 “2.1”项色谱条件连续进样6次,记录松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷峰面积,相对标准误差分别为1.11%,0.96%,1.08%,1.18%和1.05%。
2.6 稳定性试验
分别称取杜仲皮、叶粗粉各5份,0.5 g·份-1,制备供试品溶液。分别精密吸取制备好的供试品溶液20 μL,在0,3,6,9,12,15,24 h各进样1次,测定各成分峰面积。计算得杜仲皮中松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷的相对标准误差分别为1.18%,1.23%,1.27%,1.39%和1.75%;杜仲叶中桃叶珊瑚苷、绿原酸、京尼平苷酸的相对标准误差分别为1.65%,1.32%,1.77%。结果表明:供试品溶液中各成分在24 h内稳定。
2.7 重复性试验
分别称取杜仲皮、叶粗粉各5份, 0.25 g·份-1,制备供试品溶液,进样测定。计算得杜仲皮中松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷质量分数的相对标准误差分别为:1.76%,1.69%,1.88%,1.92%,1.67%;杜仲叶中桃叶珊瑚苷、绿原酸、京尼平苷酸质量分数的相对标准误差分别为:2.02%,1.98%,1.87%。结果表明:该方法重复性较好(n=6)。
2.8 加样回收率试
精密称取0.25 g已测定的杜仲皮样品粉末6份,每份分别加入混合对照品溶液适量,制备供试品溶液,进样测定,计算回收率。对于超过线性范围的样品,先稀释一定倍数后再测定。结果见表2~6。
2.9 样品测定
取6批2013年5-10月对照(ck),低氮(LN)和中氮(MN)处理水平下的杜仲叶、皮样品,依 “2.3”项制备供试品溶液,利用 “2.1”项得到的双波长-梯度洗脱模式HPLC法对松脂醇二葡萄糖苷(PDG),桃叶珊瑚苷(AU),绿原酸(CA),京尼平苷酸(GPA)和京尼平苷(GP)的质量分数进行测定分析,结果见图2和图3。结果显示:氮沉降处理对杜仲皮和叶中松脂醇二葡萄糖苷、绿原酸、京尼平苷酸、京尼平苷和桃叶珊瑚苷质量分数的影响不尽相同,且不同月份呈现出不同的变化规律。
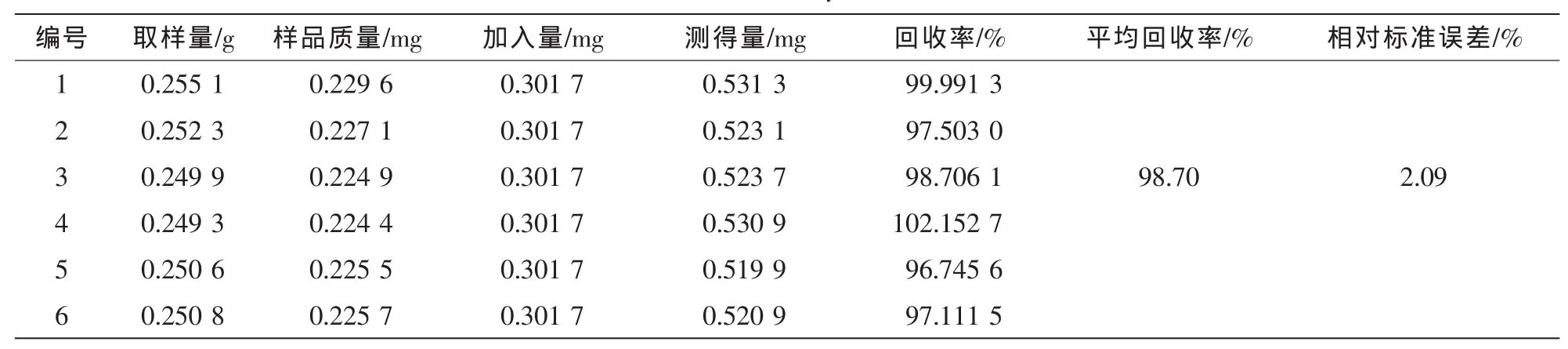
表2 松脂醇二葡萄糖苷的加样回收率试验结果(n=6)Table 2 Results of recovery tests of PDG(n=6)
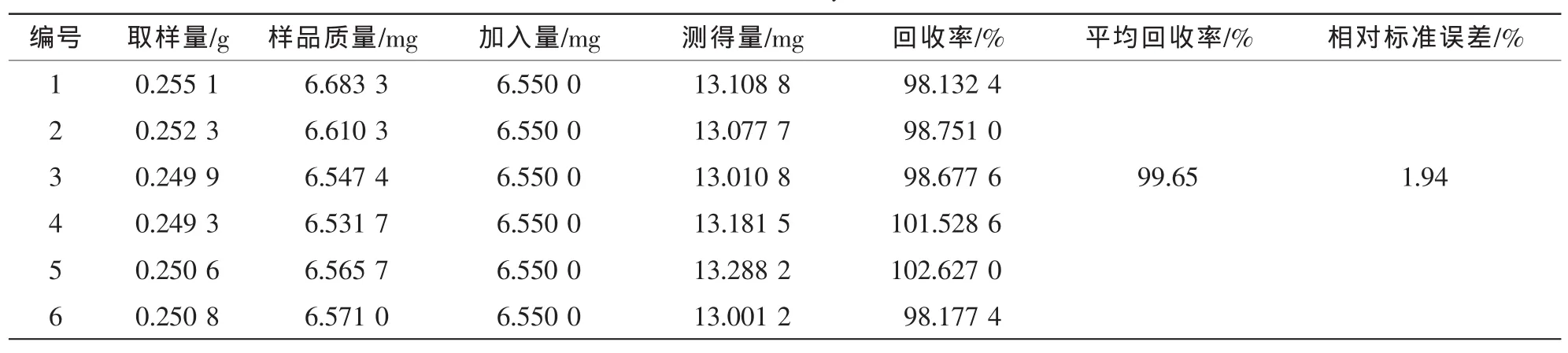
表3 桃叶珊瑚苷的加样回收率试验结果(n=6)Table 3 Results of recovery tests of AU(n=6)
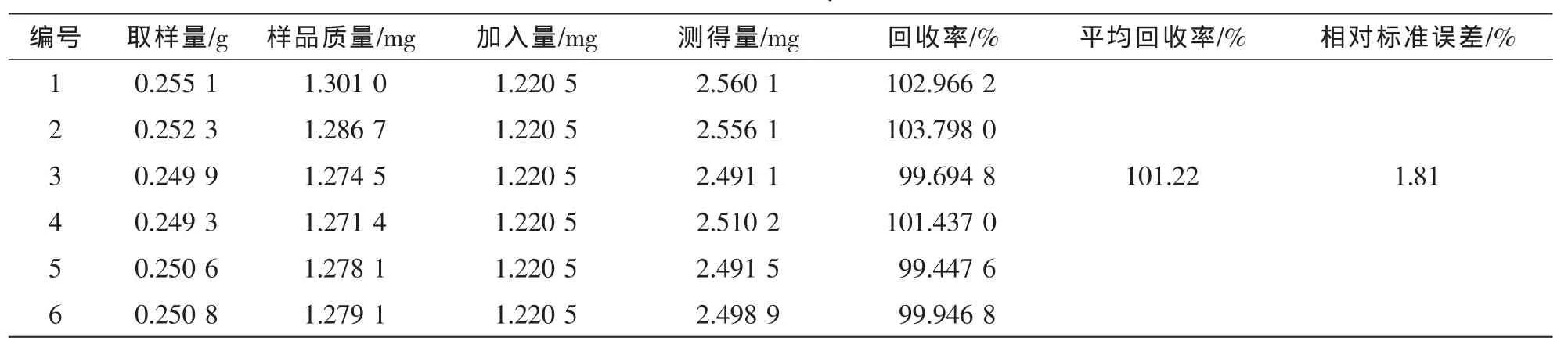
表4 绿原酸的加样回收率试验结果(n=6)Table 4 Results of recovery tests of CA(n=6)
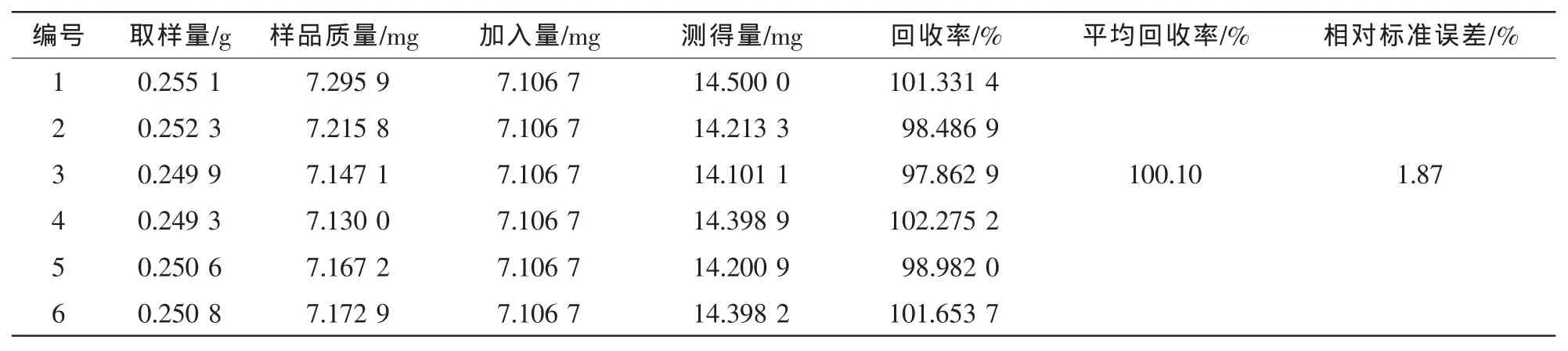
表5 京尼平苷酸的加样回收率试验结果(n=6)Table 5 Results of recovery tests of GPA(n=6)
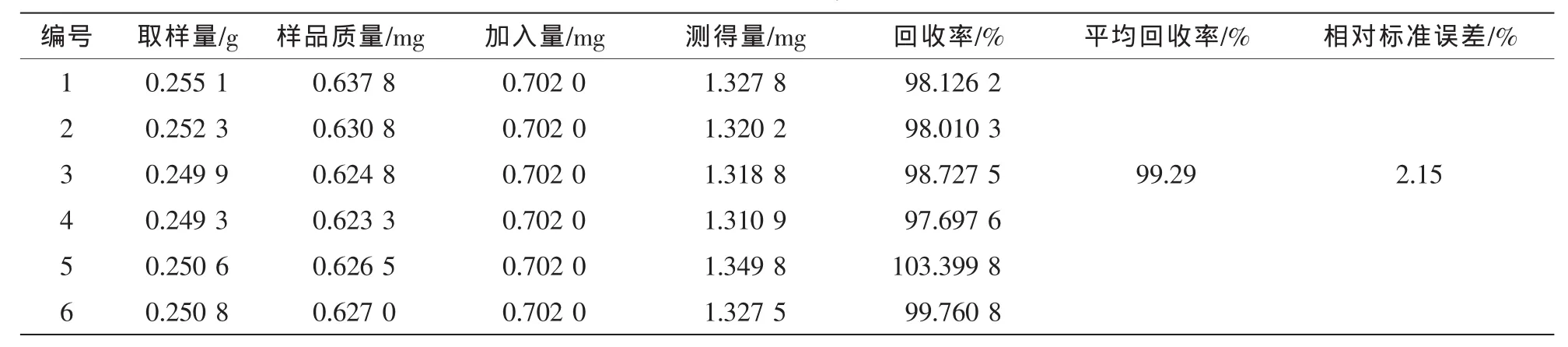
表6 京尼平苷的加样回收率试验结果(n=6)Table 6 Results of recovery tests of GP(n=6)
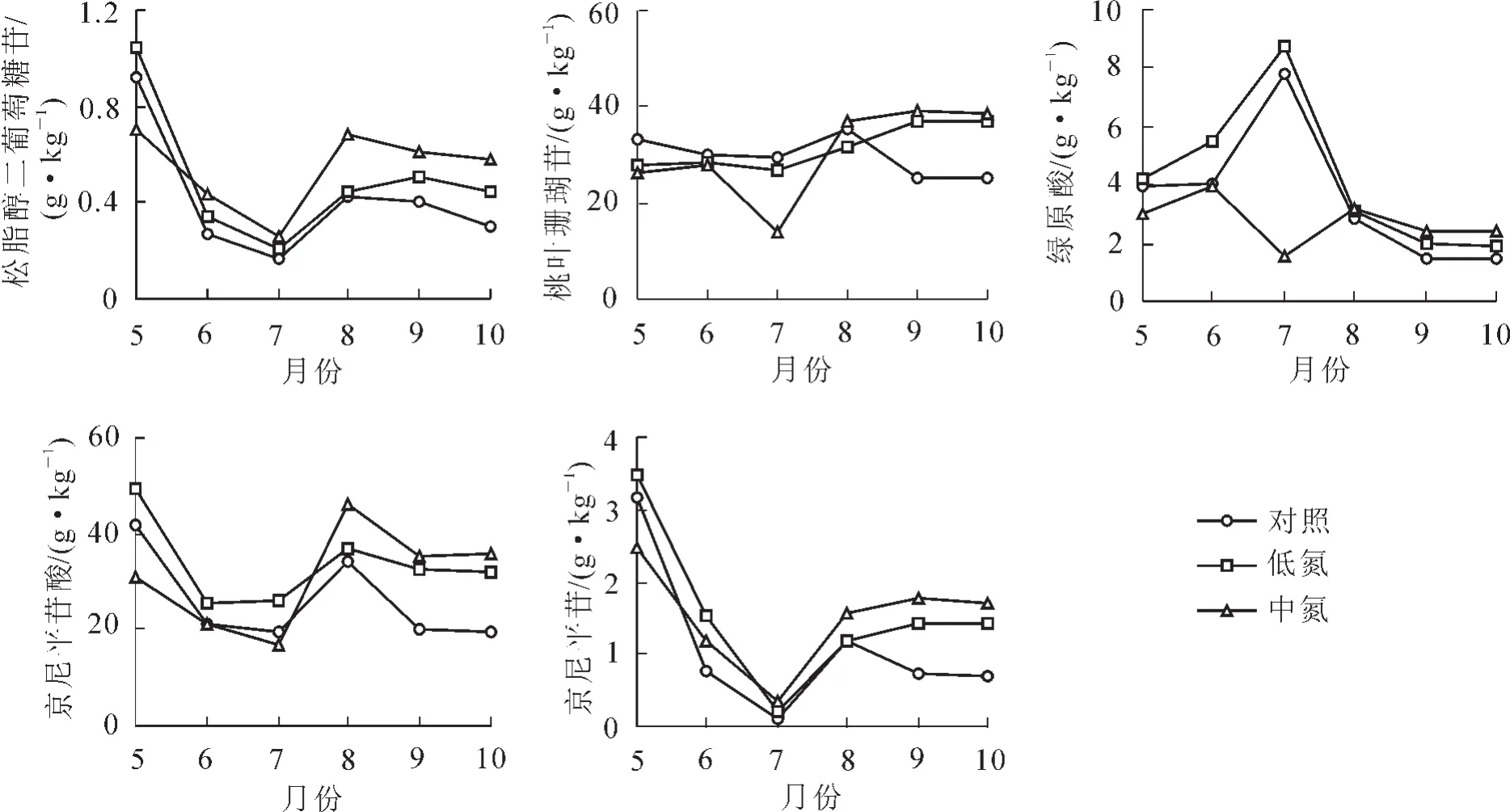
图2 不同模拟氮沉降对杜仲皮中5种成分质量分数的影响比较Figure 2 Content comparisons of the 5 compounds in the bark of Eucommia uimoides under simulated experiment of nitrogen deposition
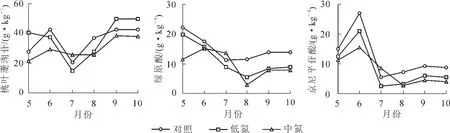
图3 不同模拟氮沉降对杜仲叶中3种成分质量分数的影响比较Figure 3 Content comparisons of the 3 compounds in the leaves of Eucommia uimoides under simulated experiment of nitrogen deposition
3 讨论
3.1 检测波长的选择
实验前对对照品溶液作紫外-可见全波段(200~400 nm)扫描。松脂醇二葡萄糖苷和桃叶珊瑚苷在203 nm附近有最大吸收,该波长下2种成分具有较高的响应值和较好的分离效果;绿原酸在240 nm和324 nm,京尼平苷酸和京尼平苷在240 nm处有较强的紫外吸收,低于240 nm波长时,3种成分吸收峰小,分析准确性较差,但松脂醇二葡萄糖苷和桃叶珊瑚苷在波长大于240 nm后基本无吸收峰。因此,本研究采用DAD检测器,设定203 nm和240 nm双波长进行检测,使5种成分都能在所测波长处有较大吸收,这比单波长测定法更为准确,且稳定快,干扰小。
3.2 流动相梯度的选择
等度洗脱时,桃叶珊瑚苷和京尼平苷酸完全重叠,无法分开,且出峰时间太早,不利于样品中各成分的分离,故采用梯度洗脱。通过对几种洗脱梯度的比较,最终确定 “2.1”节中的洗脱程序,结果可以实现混合标样中5种成分的较好分离。此外,从峰形上考虑,该梯度下检测获得的色谱峰没有前伸和拖尾现象,且峰形尖锐,可提高杜仲有效成分的保留,改善色谱分离效果。最终测得松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷的保留时间分别为30.50,4.35,12.80,5.30和20.00 min。
3.3 模拟氮沉降对杜仲主要药用成分的影响
对不同月份不同模拟氮沉降处理过的受试杜仲苗进行分析,发现皮和叶中各有效成分在不同月份各施氮处理间差异较大。整个研究期间,皮中松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷等的质量分数在低氮组中相对较高,中氮组中则表现出初期抑制,中后期促进的变化规律。推测可能因为低浓度的氮沉降促进了杜仲生长,起到了一定的 “施肥效应”;而中浓度的氮沉降早期对杜仲具有抑制作用,但随着时间的推移,杜仲对逆境胁迫表现出了一定的适应性和承受力。施氮处理对皮中桃叶珊瑚苷影响很大,低氮组在初期就已经表现出抑制作用,后期施氮处理有助于其含量的积累。杜仲叶中桃叶珊瑚苷、绿原酸、京尼平苷酸等质量分数对施氮处理较皮敏感。在植物叶片生长的整个时期,低氮和中氮实验组中3种成分基本都受到不同程度的胁迫,且随着氮沉降浓度增大而加强。但在中期,中氮处理对叶中桃叶珊瑚苷、绿原酸、京尼平苷酸质量分数的积累有促进作用,中氮组中3种成分质量分数最高。
本研究首次采用双波长高效液相色谱法对模拟氮沉降处理下的1年生杜仲苗皮和叶中松脂醇二葡萄糖苷、桃叶珊瑚苷、绿原酸、京尼平苷酸和京尼平苷等的质量分数进行测定,并进一步对其不同月份不同处理间的变化规律做了分析比较,发现在不同程度模拟氮沉降处理下,皮和叶中5种成分质量分数对施氮处理产生了不同的响应,且随季节在变动。研究全球环境变化背景下氮沉降对浙江省特色名贵药材杜仲药性品质的影响是本研究的一大特色,这对于提高浙江高氮沉降区道地药材杜仲的药性品质及市场竞争力具有十分迫切的必要性和现实意义。本方法的建立也可作为杜仲药材质量控制标准的有效补充。
[1] 王亚琴,张康健.杜仲次生代谢物的研究进展[J].中草药,2004,35(7):836-839. WANG Yaqin,ZHANG Kangjian.Advances in research on secondary metabolites of Eucommia ulmoides[J].Chin Trad Herb Drug,2004,35(7):836-836.
[2] 汤诗杰,李和平,贺善安.杜仲研究的现状与展望[J].林业科技开发,2007,21(2):8-12. TANG Shijie,LI Heping,HE Shan’an.Recent situation and prospects of the study of Eucornmia ulmoides[J].China For Sci Technol,2007,21(2):8-12.
[3] NAKAJI T,TAKENAGA S,KUROHA M,et al.Photosynthetic response of Pinus densiflora seedlings to high nitrogen load[J].Environ Sci,2002,9(4):269-282.
[4] CLEMENT J,BOER M,VENEMA J H,et al.There is no direct relationship between N-status and frost hardiness in needles of NH3-exposed Scots pine seedlings[J].Phyton,2000,40(3):21-33.
[5] MAGILL A H,ABER J D,BERNTSON G M,et al.Long-term nitrogen additions and nitrogen saturation in two tem-perate forests[J].Ecosystems,2000,3(3):238-253.
[6] ZAK D R,PREGITZER K S,CÜRTIS P S,et al.Atmospheric CO2,soil-N availability,and allocation of biomass and nitrogen by Populus tremuloides[J].Ecol Appl,2000,10(1):34-46.
[7] SONNLEITNER M A,GÜNTHARDT-GOERG M S,BUCHER-WALLIN I K,et al.Influence of soil type on the effects of elevated atmospheric CO2and N deposition on the water balance and growth of a young spruce and beech forest [J].Water Air Soil Poll,2001,126(3/4):271-290.
[8] 李德军,莫江明,方运霆,等.模拟氮沉降对3种南亚热带树苗生长和光合作用的影响[J].生态学报,2004,24(5):876-882. LI Dejun,MO Jiangming,FANG Yunting,et al.Effects of simulated nitrogen deposition on growth and photosynthesis of Schima superba,Castanopsis chinensis and Cryptocarya concinna seedlings[J].Acta Ecol Sin,2003,24(5):876-882.
[9] BAUER G A,BAZZAZ F A,MINOCHA R,et al.Effects of chronic N additions on tissue chemistry,photosynthetic capacity,and carbon sequestration potential of a red pine(Pinus resinosa Ait.)stand in the NE United States[J].For Ecol Manage,2004,196(1):173-186.
[10] WANG Jialong,LIU Erwei,WU Shuai,et al.Development of HPLC method to evaluate drug-processing technique of Eucommia cortex[J].Chin Herb Med,2011,3(3):221-225.
[11] 孙彦超,李钦,杜红岩,等.RP-HPLC测定杜仲叶中京尼平苷酸、绿原酸、京尼平苷的含量[J].中成药,2009,31(10):1608-1609. SUN Yanchao,LI Qin,DU Hongyan,et al.The determination of geniposidic acid,chlorogenic acid and geniposide in folium cortex Eucommia by RP-HPLC[J].Chin Trad Pat Med,2009,31(10):1608-1609.
[12] 伍庆,张明时,王兴宁,等.高效液相色谱法同时测定杜仲药材中绿原酸和松脂醇二葡萄糖苷的含量[J].时珍国医国药,2008,19(2):308-309. WU Qing,ZHANG Minshi,WANG Xingning,et al.HPLC method for determination of CGA and PDG in Eucommia ulmoides Oliv.[J].Lishizhen Med Mat Med Res,2008,19(2):308-309.
[13] 王丽楠,杨美华.HPLC法测定不同生长年限杜仲皮中松脂醇二葡萄糖苷[J].中草药,2009,40(4):651-653. WANG Linan,YANG Meihua.The determination of pinoresinol diglucoside in Eucommia ulmoides of the different growth duration by RP-HPLC[J].Chin Trad Herb Drug,2009,40(4):651-653.
Determination of five active components in Eucommia uimoides under simulated experiment of nitrogen deposition by dual-wavelength HPLC
AI Jianguo1,DU Jiangli2,ZHOU Aicun2,JIN Songheng2,SONG Xinzhang2
(1.School of Information Engineering,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.School of Forestry and Biotechnology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
A method for determination of pinoresinol diglucoside,aucubin,chlorogenic acid,geniposidic acid and geniposide in Eucommia uimoides under simulated experiment of nitrogen deposition by dual wavelength HPLC was established.Dual-wavelength HPLC was adopted performing on Agilent ZORBAX SB-C18column (250 mm×4.6 mm,5 μm)with a mobile phase of acetonitrile (A)-0.2%phosphoric acid (B)at flow rate of 0.8 mL·min-1.The gradient elution program was as follows:0-12 min,10%A;12-25 min,13%A;25-50 min, 30%A;50-65 min,60%A.The detection wavelength was set at 203 nm for pinoresinol diglucoside and aucubin,and at 240 nm for chlorogenic acid,geniposidic acid and geniposide.The column temperature was 30 ℃.Results showed that pinoresinol diglucoside,aucubin,chlorogenic acid,geniposidic acid and geniposide all had a good linear relationship with their peak area values respectively.The five ingredients from bark and leaves of Eucommia uimoides had different response to the nitrogen treatments,and changing in the seasons. The method can be used for simultaneous determination of ingredients in Eucommia uimoides,and can be successfully applied to reflect the content changing of the compounds.[Ch,3 fig.6 tab.13 ref.]
cash forestry;Eucornmia ulmoides;simulated nitrogen deposition;medicinal ingredients;dualwavelength HPLC
S759.3
A
2095-0756(2015)01-0060-07
浙 江 农 林 大 学 学 报,2015,32(1):60-66
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.01.009
2014-04-16;
2014-06-24
浙江省自然科学基金资助项目(Y3110393)
哀建国,副教授,博士,从事植被生态学与植物资源开发利用研究。E-mail:aijg1968@zafu.edu.cn
