老龄牦牛睾丸组织结构研究
2015-03-22袁莉刚朱峻峰谷来凤闫振龙
袁莉刚,朱峻峰,谷来凤,闫振龙
(甘肃农业大学动物医学院,兰州 730070)
老龄牦牛睾丸组织结构研究
袁莉刚*,朱峻峰,谷来凤,闫振龙
(甘肃农业大学动物医学院,兰州 730070)
探讨高原老龄牦牛睾丸组织结构特点与其生殖机能的关系。采集9~13岁健康老龄牦牛睾丸组织,应用组织化学染色和透射电镜技术,观察其细胞化学特点及结构特征。结果显示,老龄牦牛睾丸体积及重量左侧略大于右侧,光镜下睾丸被膜、间质组织胶原纤维及网状纤维丰富,小叶不明显,Leydig 细胞散在于结缔组织之间,生精小管不同程度退化,生精上皮层数为2~5层,细胞间隙变大,部分脱落,Sertoli 细胞低矮,细胞质较少。电镜观察Sertoli 细胞核外形不规则,内质网呈疏松的泡状,次级溶酶体增加,体积增大。相邻Sertoli 细胞间没有观察到并行的内质网层和细丝束这一血-睾屏障所特有外质特化区形态结构,部分生精小管固有膜胶原纤维增生,上皮皱缩;Leydig 细胞内脂滴异常丰富,毛细血管内皮细胞间存在紧密连接。间质组织偶有肥大细胞,间质血管及生精小管固有膜中PAS及AB-PAS阳性反应明显。老龄牦牛Sertoli 细胞细胞器结构异常,血-睾屏障中Sertoli 细胞间的连接处缺陷,且Sertoli 细胞与基膜连接的改变可能影响了Sertoli 细胞和生精细胞之间的相互作用,进而抑制了生精细胞的功能。
牦牛;老龄;睾丸;组织化学;超微结构
人或动物进入老龄后器官氧化应激性增加,炎症反应敏感,细胞衰老加速以及细胞损伤反应改变,由此会导致内环境稳态失衡,器官功能障碍等[1]。哺乳动物睾丸是一个耗氧量大、不耐缺血的器官,主要功能是合成类固醇激素和精子的生成。目前关于老龄化睾丸的研究资料主要集中于人或实验动物(如大鼠、小鼠等),对于高海拔地区老龄化人或动物的研究资料很少。研究表明,在人或动物随着年龄增加睾丸功能退化与其形态改变密切相关,包括生精功能的退化、管周组织及间质组织的纤维化以及睾丸Leydig 细胞数量的下降等[2-3]。研究表明,缺氧对雄性生育能力的抑制不可忽视,睾丸局部血液循环中氧含量较低,可导致各种酶及蛋白质降解能力降低,精子生成数量减少[4]。V.Verratti等[5]对不同年龄大鼠睾丸蔓状静脉丛的细胞氧化应激研究表明,高原环境中老龄大鼠蔓状静脉丛对缺氧敏感性反应降低,认为在长期缺氧环境生活的老年大鼠可能存在特殊的适应性机制,对氧化应激反应降低也许是老化后对低氧环境的适应。高原地区,公牦牛在3岁进入繁殖群配种期,配种年龄为4~8 岁,此时生殖能力较强,8、9岁以后逐渐老龄化,繁殖能力迅速减退[6],近年来,关于成年牦牛睾丸形态及生物学方面的研究较多,但是长期生活在高海拔地区的老龄牦牛睾丸组织结构特征尚未见报道。本研究应用组织化学染色和透射电镜技术,观察9~13岁健康老龄化高原牦牛睾丸组织细胞化学特点及结构特征,分析其与生殖生理特性的关系,为进一步探究高原地区人或动物的衰老机制提供形态学参考。
1 材料与方法
1.1 试验材料
组织样采集自青海省大通牦牛养殖户,9~13岁健康老龄牦牛9只,通过外科去势手术采集睾丸,根据不同研究方法取样固定。
1.2 组织化学样本制备和观察
组织样品切成1 cm×1 cm×0.6 cm大小,4%多聚甲醛磷酸盐缓冲液固定,常规石蜡包埋,切片厚5 μm,Masson三色染色(亮绿),胶原纤维呈现蓝绿色,细胞核呈现灰黑或灰蓝色,红细胞呈红色;Gomori银染显示网状纤维为灰色;苏木素-伊红复染后呈棕红色。甲苯胺蓝染色,肥大细胞呈紫蓝色;PAS染色显示糖原,红色为阳性分布;AB-PAS染色显示酸性黏蛋白呈蓝色,中性黏蛋白呈红色。
1.3 电镜样本制备和观察
样品切成0.1 cm×0.1 cm×0.1 cm组织块,2%多聚甲醛-2.5%戊二醛溶液固定24 h,1%锇酸后固定,丙酮乙醇梯度脱水,Epon812包埋,LKB8800型超薄切片机切片,醋酸铀、硝酸铅双重染色,日本JEM-100CX透射电子显微镜观察照相。
1.4 数据统计
测量每一年龄牦牛睾丸大体解剖特征指数,进行数据整理。切片在NIKON ECLIPSE 80i显微摄像系统进行照相。每组随机选取5张切片,每张切片随机选取6个不重复视野(×400),用Image Pro Plus 6.0软件统计每个视野下Sertoli细胞、Leydig细胞数、生精小管外管径、生精小管横截面积及平均间质组织面积。
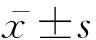
2 结 果
2.1 老龄牦牛睾丸解剖结构特点
老龄牦牛睾丸结缔组织发达,去掉阴囊后眼观颜色泛白或略黄,解剖学特征统计数据表明,睾丸大小为5.31 cm×3.60 cm×3.34 cm,左侧单体睾丸长(纵)径、短(横)径、厚径及重量均略大于右侧(表1)。
2.2 老龄牦牛睾丸光镜结构特点
光镜下睾丸表面有一层富含胶原纤维的结缔组织白膜,膜内血管管壁胶原纤维明显,实质内结缔组织发达,无明显睾丸小隔及睾丸纵隔,间质内血管管壁胶原纤维丰富(图1A~1C);Leydig胞核呈圆形、椭圆形,核膜清晰明显,散在于丰富的胶原纤维及网状纤维之间(图1C~1F)。
表1 老龄牦牛睾丸解剖特征指数(x-±s,n=9)

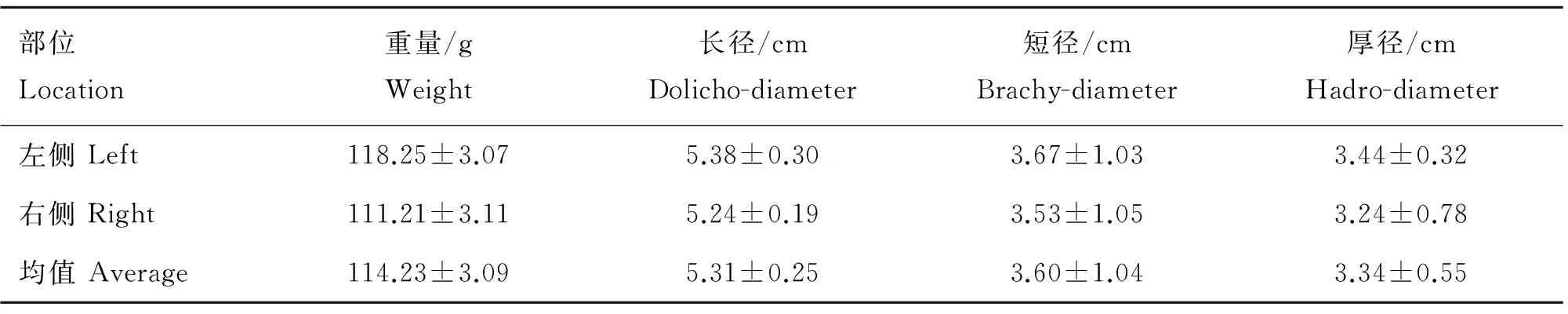
部位Location重量/gWeight长径/cmDolicho-diameter短径/cmBrachy-diameter厚径/cmHadro-diameter左侧Left118.25±3.075.38±0.303.67±1.033.44±0.32右侧Right111.21±3.115.24±0.193.53±1.053.24±0.78均值Average114.23±3.095.31±0.253.60±1.043.34±0.55
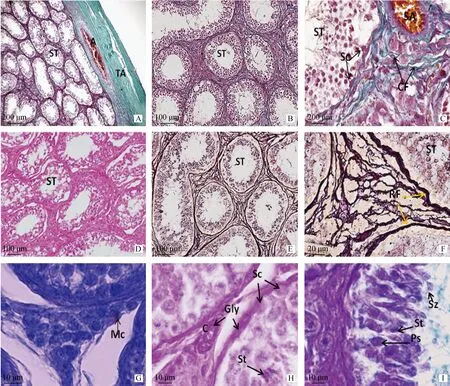
图A~C示老龄牦牛睾丸结缔组织(Masson染色);图D示生精上皮(HE染色);图E、F为生精小管外周网状纤维(Gomori染色);图G示睾丸间质肥大细胞(甲苯胺蓝染色);图H示生精小管及间质糖原(PAS染色);图I示生精小管内糖蛋白(AB-PAS染色)。A.被膜下动脉血管;C.毛细血管;CF.胶原纤维;Mc.肥大细胞;Gly.糖原;RF.网状纤维;SA.小动脉;Sc.Sertoli细胞;St.精子细胞;Ps.初级精母细胞;Sz.精子;ST.生精小管;TA.睾丸被膜Fig.A-C.Aging yak teitis stained by Masson;Fig.D.Seminiferous tubule of aging yak stained by H&E;Fig.E,F.Seminiferous tubule of aging yak stained by Gomori;Fig.G.Mast cell in the interstitium stained by toluidine blue;Fig.H.Aging yak teitis stained by PAS;Fig.I.Aging yak teitis stained by AB-PAS.A.Artery;C.Capillaries;CF.Collagen fiber;Mc.Mast cell;Gly.Glycogen;RF.Reticular fiber;SA.Small artery vein;Sc.Sertoli cells;St.Spermatidis;Ps.Primary spermatocyte;Sz.Spermatozoa;ST.Seminiferious tubule;TA.Tunica albuginea图1 老龄牦牛睾丸组织的光镜结构Fig.1 Light micrograph of the aging yak testis
老龄睾丸组织生精小管部分或完全退化。部分退化的生精小管中一些生精细胞脱落入管腔,部分精子也脱离上皮。退化程度大的生精小管管腔变大,基膜增厚,上皮细胞不完整,生精细胞数量减少的同时上皮细胞之间出现了细胞间隙,其在上皮中的位置和大小不定,较大的间隙出现在靠近生精小管内腔的部位。Sertoli 细胞和前细线期精母细胞存在于基膜处(图1C~1D)。
甲苯胺蓝染色显示间质内偶有肥大细胞呈紫蓝色(图1G);PAS染色显示在血管壁及生精小管固有膜有红色阳性条带分布,Sertoli 细胞及各级生精细胞无明显阳性分布(图1H);AB-PAS染色显示睾丸生精上皮Sertoli 细胞着色淡,为弱阳性;初级精母细胞及精子细胞呈紫红色,精子头部呈蓝色(图1I)。9~13岁牦牛睾丸间质血管及生精小管固有膜中PAS及AB-PAS阳性反应随年龄逐渐增强(表2)。
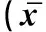

年龄/年Age(year)生精小管横截面积/μm2Seminiferoustubulearea生精小管外管径/μmTheouterdiameteroftheseminiferoustubulesSertoli细胞数/个NumbersofSertolicellsLeydig细胞数/个NumbersofLeydigcells平均间质组织面积/μm2Meaningareaofinterstitialtissue968946.71±275.46a233.45±20.68a16.18±4.35a13.27±7.68a15013.76±144.32a1072696.36±164.58a239.78±35.22a14.91±3.48a15.57±6.79a16288.82±167.56a1182384.55±262.89a242.11±45.17a13.94±3.46a12.31±10.22a16829.61±201.58a1370846.62±196.74a232.37±50.32a12.17±5.27a11.59±9.47a19324.36±174.49b
同列所标字母不同表示差异性显著(P<0.05)
Different letter in the same row means significant difference between the relative expressions(P<0.05)
老龄牦牛睾丸生精小管统计结果显示(表2),从9岁到13岁牦牛睾丸中,生精小管管径及其横截面积无明显变化,间质结缔组织丰富,在13岁时平均间质组织面积增加较其他年龄差异明显,Sertoli 细胞随年龄增加有减少的趋势,Leydig细胞数量因为间质形成有三角形或四角形局域变化较大,从2个左右到20个左右。
2.3 老龄牦牛睾丸超微结构特点
电镜下,老龄牦牛睾丸Sertoli 细胞及生精细胞内质网为典型不规则、松散的泡状结构,Sertoli细胞靠近基膜排列,核呈多边形,核仁不明显,细胞质内分布滑面内质网以及脂质体,近腔面有较多体积较大的次级溶酶体,形状不规则,内含有异质性成分和类脂褐素等,高尔基体以小的堆叠小囊形式存在,发育不完全(图2A)。相邻Sertoli细胞胞膜下线粒体丰富,不规则囊泡散在,但没有观察到Sertoli细胞之间的连接,血睾屏障的形态学结构特点不明显;虽然相邻的Sertoli 细胞质膜中偶尔能够看到内质网池,但是缺乏并行的内质网层和细丝束这一血睾屏障所特有外质特化区形态结构(图2B、2C)。睾丸间质组织可见少量纤维细胞,细胞质较少,间质毛细血管管壁内皮细胞核不规则,血管外周可见大量成束胶原原纤维(图2D)间质毛细血管内皮细胞连接处仍可见紧密连接(图2E);Leydig 细胞形态不规则,内质网囊泡零散存在,脂褐素沉积,线粒体无明显肿胀,常见脂滴异常丰富(图2F)。
生精上皮下的固有膜层由基膜及I型胶原(collagen,Col Ⅰ)构成一个非细胞区和管周肌样细胞以及淋巴内皮组成的细胞区组成,退化程度较大的生精上皮基膜增生明显,凹凸不平,其上半桥粒结构不明显,外围I型胶原纤维较少,胶原原纤维异常丰富(图2A);基本无退化的生精小管Sertoli细胞基部仍存在典型的粗面内质网构成的同心圆状的结构,基膜与Sertoli细胞间可见少量半桥粒结构,固有膜包绕着一层较厚的I型胶原纤维,在肌样细胞内表面,形成一层不连续的基膜(图2C)。
3 讨 论
睾丸的发育与物种及个体年龄有关,不同动物的左、右单侧睾丸存在差异性。日本猴、藏绵羊等动物左侧睾丸均重于右侧[7,8],而公麝睾丸右侧重于左侧[9];研究发现人及不同动物的睾丸体积和质量随着年龄的增长发育而逐渐增加[7-10]。本研究中老龄牦牛睾丸左侧略重于右侧,去掉阴囊后重量为114 g左右,与资料中成年牦牛睾丸重量统计数字相近[11],表明在成年至老龄牦牛睾丸重量没有明显的变化。高原低氧环境下睾丸的重量及组织形态学发生改变其生精功能也会受到影响,睾丸重量的增加与生精小管上皮的发育有直接关系[12],9岁到13岁牦牛睾丸生精小管管径大小及生精小管横截面积与朱俊峰[13]对青年牦牛睾丸的统计结果一致,因此,生精小管管径及横截面积大小随牦牛年龄变化不明显,其可能主要在于生精上皮发育形态的变化。
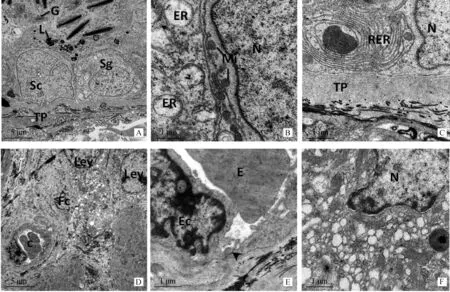
图A.生精小管超微结构;图B.Sertoli 间连接处超微结构;图C.Sertoli 基部超微结构;图D.间质组织超微结构;图E.间质毛细血管超微结构;图F.Leydig细胞超微结构。C.毛细血管;E.红细胞;Ec.毛细血管内皮细胞;ER.内质网;Fc.纤维细胞;G.高尔基器;L.溶酶体;Ley.Leydig细胞;Mi.线粒体;N.细胞核;Sc.Sertoli细胞;Sg.精原细胞;TP.固有膜Fig.A.The seminiferous tubule;Fig.B.The Sertoli cells;Fig.C.The base of Sertoli cell;Fig.D.Testis interstitial tissue;Fig.E.The capillaries in interstitium;Fig.F.Leydig cells in the interstitium.C.Capillarie;E.Erythrocyte;Ec.Endothelium cell;ER.Endoplasmic reticulum;Fc.Fiber cells;G.Golgi apparatus;L.Lysosome;Ley.Leydig cells;Mi.Mitochondrion;N.Necleus;Sc.Sertoli cells;Sg.Spermatogonia;TP.Tunica propria图2 老龄牦牛睾丸组织的超微结构Fig.2 Ultrastructure of the aging yak testis
近年来,肥大细胞与性腺生殖生理的关系引起人们的注意。研究表明,肥大细胞在多个器官的纤维化过程中发挥作用,其在男性不育患者的睾丸中数量明显增加[14]。M.Nistal等[15]研究表明,人睾丸在不同发育年龄段中,婴儿期及青春期睾丸及附睾结缔组织发育时期,肥大细胞数才增加,说明肥大细胞数量的变化与结缔组织发育相关。本研究显示9岁到13岁牦牛睾丸中,结缔组织丰富,13岁时间质组织面积、胶原纤维及网状纤维增加明显,但光镜下肥大细胞在间质组织中偶见,数量无明显增加,纤维细胞较少,说明9岁以后并不是牦牛睾丸间质结缔组织发育时期,是否在这个年龄以前结缔组织就已经开始增加有待于进一步研究。
睾丸Sertoli 细胞是生精小管中唯一的体细胞,为精子生成提供形态、营养及激素支持。研究表明老年人及老龄大鼠睾丸曲细精管发生了局部乃至全部的退化,包括局部生精小管的萎缩、精原细胞或初级精母细胞发育受阻以及Sertoli 细胞形态改变[2-4]。老龄动物睾丸Sertoli 细胞细胞器结构的改变可致使细胞功能发生改变。成年期大鼠睾丸生精上皮Sertoli 细胞中内质网和高尔基复合体的含量通常很丰富,其合成和分泌一些生精细胞所必需的蛋白。老龄后Sertoli 细胞缺乏丰富的滑面内质网,核仁轮廓不规则[16]。本研究中老龄牦牛睾丸Sertoli 细胞及生精细胞内质网为典型的不规则、松散的泡状结构,表明其合成及分泌功能发生了改变。老龄挪威灰鼠Sertoli 细胞内次级溶酶体数量增加引起其细胞器功能的相对减退,溶酶体体积的增大会导致对代谢产物分解力的降低,如脂褐素聚集[17]。研究表明老龄动物睾丸组织中观察到脂褐素的沉积可能是其降解通路的降低或氧化应激引起[18]。本研究中老龄牦牛睾丸组织中溶酶体体积变大,呈异质性,散在于Sertoli 细胞胞质中,这也可能是其分解能力降低,周围类脂褐素颗粒较多的原因。据报道,成年人睾丸Sertoli 细胞的特征是核仁大居中及细胞质中大量的脂滴,季节性发情动物在非发情季节,即生精小管处于退化的时期,Sertoli 细胞中脂滴的数量明显增加[16,18]。缺乏维生素E会导致精子发育不完整、生精细胞退化以及Sertoli 细胞中脂滴数量的增加[19]。然而,本研究中发生退化的生精小管中Sertoli 细胞并没有脂滴积聚的现象,这与H .Jiang等[16]在老年人睾丸的观察相一致。同样,组织化学观察虽然在血管壁及生精小管固有膜阳性条带分布,但是Sertoli 细胞糖原及糖蛋白阳性反应较弱,表明其组织糖蛋白酶含量减少或合成能力较低,这与观察到的内质网和高尔基复合体含量的较少相一致。
血睾屏障位于间质毛细血管腔和曲细精管腔之间,哺乳动物成熟睾丸血睾屏障由Sertoli细胞之间膜性囊泡,肌动蛋白丝及紧密连接共同形成;Sertoli 细胞质膜下微丝束和内质网池构成的细胞外质特化(Ectoplasmic specialization,ES)结构,其与紧密连接等共同构成连接复合体,是哺乳动物血睾屏障建立和完善的重要标志[20]。更多研究表明,老年人睾丸Sertoli 细胞形态异常影响血睾屏障功能[21]。本研究中相邻Sertoli细胞血睾屏障的结构特点不明显;虽然间质毛细血管壁内皮细胞间紧密连接完整,相邻的Sertoli 细胞质膜中偶尔能够看到内质网池,但是缺乏并行的内质网层和细丝束这一血睾屏障所特有外质特化区形态结构。研究表明,外质特化是精子与Sertoli 细胞粘连的部位[20]。老龄动物中,血睾屏障改变会引起管腔环境的异常,进一步导致生精细胞发育障碍[22]。因此,老龄牦牛睾丸Sertoli 细胞外质特化区形态结构的不完整可能是细胞机能老化的组织结构特征之一。
哺乳动物生精上皮随着年龄的增长会逐步发生变化。报道认为老年人和老龄化挪威灰鼠睾丸生精上皮的基膜增厚,增厚的基膜与血睾屏障体系中生精小管的一些变化相辅存在,进一步引起生精细胞的减少[16-17]。C.Paul等[22]认为由于老龄血-睾屏障的改变,睾丸免疫微环境受到影响,处于退化过程的输精管内精子抗原的含量会上升。通过光学和电镜观察发现老龄挪威灰鼠睾丸生精上皮形态的改变是导致类固醇生成和精子发生下降的根本原因[17]。本研究中退化程度大的生精小管管腔变大,基膜增厚,上皮细胞不完整,生精细胞数量减少的同时上皮细胞之间出现了细胞间隙,较大的间隙出现在靠近生精小管内腔的部位。电镜下增生明显的生精小管,外围I型胶原纤维较少,胶原原纤维异常丰富,大多数发生退化的生精小管中生精细胞的数量减少。这与老年人生精小管形态变化一致,认为是生精小管渐进性退化逐渐萎缩的结构特点[16]。O.T.Pop等[23]认为随着年龄的变化基膜增厚,透过生精上皮的物质减少,这可能导致生精细胞减少。因此,老龄牦牛血-睾屏障中Sertoli 细胞间的连接处缺陷,且Sertoli 细胞与基膜连接的改变可能影响了Sertoli 细胞和生精细胞之间的相互作用,阻碍了生精细胞的自我更新能力,这种变化是否引起睾丸免疫微环境的改变有待于进一步研究探索。
Leydig细胞是睾丸间质组织中最重要的内分泌细胞,其形态和数量在动物不同发育阶段差异较大。J.B.Kerr等[24]报道成年大鼠睾丸的Leydig细胞脂滴减少且没有外层纤维细胞包围。研究表明,小鼠睾丸细胞内Leydig脂滴量逐渐增多,雄激素的合成能力则开始下降,直至呈静息状态[25]。本研究中老龄牦牛睾丸间质纤维细胞很少,Leydig细胞脂滴异常丰富,脂褐素沉积,与R.Paniagua等[21]的研究相一致,Leydig细胞内脂滴量的明显降低可能与合成雄激素能力降低有关。线粒体肿胀与细胞的氧化应激有关[26],本研究中老龄牦牛Leydig细胞并没有明显体现线粒体肿胀,也可能与长期生活在低氧环境中的老龄牦牛对缺氧应激的敏感性下降有关。
研究表明,短吻鳄在出生后1周至5月龄,PAS阳性主要位于睾丸间质结缔组织、Leydig 细胞以及生精小管基膜,生精细胞的成熟伴随着间质组织增加,Leydig 细胞群的建立,PAS和AB-PAS阳性反应区也会增加[27];而在24~27月龄的小鼠,PAS在睾丸 Leydig 细胞以及基质中会再次出现强阳性反应性[28]。AB、PAS阳性反应的糖原、糖蛋白以及蛋白多糖很典型存在于结缔组织、黏液以及基膜中,睾丸生精小管基膜的基本成份如层黏连蛋白是PAS特殊反应阳性糖蛋白[27]。本研究中老龄牦牛睾丸间质血管及生精小管固有膜中PAS及AB-PAS阳性反应随年龄逐渐增强,可能与间质组织中结缔组织合成增加相关。睾丸间质结缔组织含量的增加会引起睾丸组织纤维化,影响睾丸 Leydig 细胞分泌产物的输送,进而影响其对睾丸生精功能的调控作用[23]。因此,牦牛老龄化引起的生精功能下降与间质结缔组织、间质面积及Leydig细胞数量、肥大细胞数量及其分泌能力之间的关系,尚需进行内分泌、繁殖生理等方面进一步的研究。
[1] POULOSE N,RAJU R.Aging and injury:alterations in cellular energetics and organ function[J].AgingDis,2014,5(2):101-108.
[2] 李维仁,韩勃萱,刘 涛,等.老年人睾丸间质细胞结构及StAR和P450scc蛋白表达的变化[J].北京大学学报(医学版),2011,43(4):505-508. LI W R,HAN B X,LIU T,et al.Changes in morphology and steroidogenic function of aged human Leydig cells[J].JournalofPekingUniversity(HealthSciences),2011,43(4):505-508.(in Chinese)
[3] NISTAL M,GARCA-CABEZAS M A,CASTELLO M C,et al.Age-related epididymis-like intratesticular structures:benign lesions of Wolffian origin that can be misdiagnosed as testicular tumors[J].JAndrol,2006,27(1):79-85.
[4] LIAO W,CAI M,CHEN J,et al.Hypobaric hypoxia causes deleterious effects on spermatogenesis in rats[J].Reproduction,2010,139(6):1031-1038.
[5] VERRATTI V,DI GIULIO C,BERARDINELLI F,et al.Pampiniform plexus and oxidative stress during chronic hypoxia and hyperoxia[J]IntJImmunopatholPharmacol,2008,21(2):353-357.
[6] 阎 萍,潘和平.环境因素对牦牛繁殖性能的影响[J].畜牧与兽医,2004,36(5):15-16. YAN P,PAN H P.Environmental effects on yak reproductive performance[J].AnimalHusbandryandVeterinaryMedicine,2004,36(5):15-16.(in Chinese)
[7] 白 海,徐 志,李丰银,等.2岁日本猴睾丸的形态及组织学结构研究[J].野生动物杂志,2009,30(2):70-71. BAI H,XU Z,LI F Y,et al.Morphological and histological study of the testicle of 2 year old Japanese macaques[J].ChineseJournalofWildlife,2009,30(2):70-71.(in Chinese)
[8] 孙 英.高原藏羊睾丸及附睾血管构筑的初步研究[D].兰州:甘肃农业大学,2010. SUN Y.The preliminary study of angioarchitecture of testis and epididymis in Tibetan Plateau sheep[D].Lanzhou:Gansu Agricultural University,2010.(in Chinese)
[9] 李绪刚,姜怀志,孙泽威.公麝的生殖系统观察[J].经济动物学报,2000,4(1):47-49. LI X G,JIANG H Z,SUN Z W.Reproductive system of male muskrat[J].JournalofEconomicAnimal,2000,4(1):47-49.(in Chinese)
[10] 邹祥沛,黎家发,邹宜林,等.胎儿睾丸及输精管解剖[J].解剖学杂志,1999,22(1):85-88. ZOU X P,LI J F,ZOU Y L,et al.Anatomical study on testes and sperm atic ducts of fetuses[J].ChineseJournalofAnatomy,1999,22(1):85-88.(in Chinese)
[11] 董 伟.家畜繁殖学[M].北京:农业出版社,1987. DONG W.Animal breeding science[M].Beijing:Agriculture Press,1987.(in Chinese)
[12] MADRID E,REYES J G,HERNNDEZ B,et al.Effect of normobaric hypoxia on the testis in a murine model[J].Andrologia,2013,45(5):332-338.
[13] 朱俊峰.牦牛生精小管形态发育特征及细胞外基质相关蛋白分布[D].兰州:甘肃农业大学,2013. ZHU J F.Morphological changes of testicular seminiferous tubules and leydig cells of yak in different ages[D].Lanzhou:Gansu Agricultural University,2013.(in Chinese)
[14] MECHLIN C W,LEVESQUE J,FEUSTEL P,et al.Mast cell numbers negatively correlate with fibrosis in cryptorchid testes[J].JPediatrUrol,2014,10(3):527-531.
[15] NISTAL M,SANTAMARA L,PANIAGUA R.Mast cells in the human testis and epididymis from birth to adulthood[J].ActaAnat(Basel),1984,119(3):155-160.
[16] JIANG H,ZHU W J,LI J,et al.Quantitative histological analysis and ultrastructure of the aging human testis[J].IntUrolNephrol,2014,46(5):879-885.
[17] LEVY S,SERRE V,HERMO L,et al.The effects of aging on the seminiferous epithelium and the blood-testis barrier of the Brown Norway rat[J].JAndrol,1999,20(3):356-365.
[18] HAYRABEDYAN S,TODOROVA K,PASHOVA S,et al.Sertoli cell quiescence- new insights[J].AmJReprodImmunol,2012,68(6):451-455.
[19] MOHAMMADI S,JALALI M,NIKRAVESH M R,et al.Effects of Vitamin-E treatment on CatSper genes expression and sperm quality in the testis of the aging mouse[J].IranJReprodMed,2013,11(12):989-998.
[20] CHENG C Y,MRUK D D.Actin binding proteins and spermiogenesis:Some unexpected findings[J].Spermatogenesis,2011,1(2):99-104.
[21] PANIAGUA R,NISTAL M,SEZ F J,et al.Ultrastructure of the aging human testis[J].JElectronMicroscTech,1991,19(2):241-260.
[22] PAUL C,ROBAIRE B.Impaired function of the blood-testis barrier during aging is preceded by a decline in cell adhesion proteins and GTPases[J].PLoSOne,2013,8(12):e84354.
[23] POP O T,COTOI C G,PLEEA I E,et al.Histological and ultrastructural analysis of the seminiferous tubule wall in ageing testis[J].RomJMorpholEmbryol,2011,52(1Suppl):241-248.
[24] KERR J B,KNELL C M,ABBOTT M,et al.Ultrastructural analysis of the effect of ethane dimethanesulphonate on the testis of the rat,guinea pig,hamster and mouse[J].CellTissueRes,1987,249(2):451-457.
[25] WANG F F,WANG Q,CHEN Y,et al.Chronic stress induces ageing-associated degeneration in rat Leydig cells[J].AsianJAndrol,2012,14(4):643-648.
[26] 左清清,姚 娜,董坤哲,等.低氧适应的线粒体调控机制研究进展[J].畜牧兽医学报,2013,44(7):993-999. ZUO Q Q,YAO N,DONG K Z,et al.How mitochondria play a role in hypoxic adaptation[J].ActaVeterinariaetZootechnicaSinica, 2013,44(7):993-999.(in Chinese)
[27] MOORE B C,HAMLIN H J,BOTTERI N L,et al.Posthatching development ofAlligatormississippiensisovary and testis[J].JMorphol,2010,271(5):580-595.
[28] TANEMURA K,KUROHMARU M,KURAMOTO K,et al.Age-related morphological changes in the testis of the BDF1 mouse[J].JVetMedSci,1993,55(5):703-710.
(编辑 白永平)
The Histologic Characters of Testis in Aging Yak
YUAN Li-gang*,ZHU Jun-feng,GU Lai-feng,YAN Zhen-long
(CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
This study was conducted to characterize the histologic structure of aging yak testis.The testis of aging yak in age from 9 to 13 years old were prepared for light and electron microscopy by histochemistry and transmission electron methods.The volume and weight of aging yak left testis were slightly larger than the right,and the observations made with the light microscope were obvious morphological changes of aging,the Leydig cells were scattered in the interstitial connective tissue which were abundant with collagen and reticular fiber between the seminiferous tubules,there were partly progressive regressed in the seminiferous epithelium and the epithelium were constructed 2-5 layers with contained large intercellular,the spermatogenic cells partially desquamated and Sertoli cells were low with less cytoplasm.The electron microscopic studies show that the Sertoli cells were irregularly shaped nuclei and the endoplasmic reticulum were represented as a loose,vesiculated network,and the lysosomes were large in shape and few in number.The typical morphological configuration of the blood-testis barrier as microfilaments constructed by the typical ectoplasmic specialization and actin filament between the adjacent Sertoli cells were not seen in aged yak.Partial lamina propria of seminiferous epithelium was shrinkage and hyperplasia of collagen fiber.The lipid droplets in Leydig cells were very rich,occasionally,the mast cell can be seen in the interstitial tissue.Moreover,there are closely connection between the adjacent interstitial capillary endothelial cells and the positive reaction of PAS and AB-PAS were obviously present throughout the basement membranes and the wall of interstitial blood vessels.Taken together,the structural abnormalities in Sertoli cells,the connection defects in blood-testis barrier and the basement membrane may affect the interaction between Sertoli cells and spermatogenic cells,thereby the functions of aging yak testis were inhibited.
yak;aging;testis;histochemistry;ultrastructure
10.11843/j.issn.0366-6964.2015.05.024
2014-09-01
国家自然科学基金项目(31160488);甘肃省自然科学研究基金(1010RJZA210);甘肃省教育厅科技项目(0902B-03)
袁莉刚(1974-),女,甘肃陇南人,教授,博士,硕士生导师,主要从事动物发育生物学研究,E-mail:yuan2918@126.com
S852.162
A
0366-6964(2015)05-0855-08
*通信作者:袁莉刚,Tel:0931-7631229
