抗性选育协同疫苗免疫对鸡羽囊马立克病毒载量的影响
2015-03-22金元昌李玉峰袁志栋
金元昌,陈 壮,李玉峰,袁志栋
(1.湖南科技大学 生命科学学院,湘潭 411201; 2.广西大学 养禽与禽病研究所,南宁 530004)
抗性选育协同疫苗免疫对鸡羽囊马立克病毒载量的影响
金元昌1,2*,陈 壮1,李玉峰1,袁志栋1
(1.湖南科技大学 生命科学学院,湘潭 411201; 2.广西大学 养禽与禽病研究所,南宁 530004)
为了研究马立克病(MD)火鸡疱疹病毒(HVT)疫苗接种和抗性选育对鸡马立克病毒(MDV-1)攻毒后羽囊中病毒载量的影响,选择普通霞烟鸡及其MD抗性品系,利用MDV-1攻毒后第7、14、21、28和35 天(DPI)五次采集并分离的全部试验鸡的羽囊为材料,采用Real-time FQ-PCR技术对这些材料中meq基因进行绝对定量分析以确定其病毒载量,用来分析比较MDV-1在MD抗性/普通鸡及HVT疫苗免疫/HVT疫苗未免疫鸡体内的增殖情况。结果显示:1)从MD抗性对病毒载量的影响看,一方面,普通非免疫攻毒组(F组)的MDV-1含量于14、21DPI时显著(P<0.05)高于MD抗性非免疫攻毒组(T组);另一方面,MD抗性免疫攻毒组(R组)的MDV-1含量总体上却和普通免疫攻毒组(G组)相当。2)从HVT疫苗免疫对病毒载量的影响看,一方面,MD抗性非免疫攻毒组(T组)的MDV-1含量于28 DPI时显著(P<0.05)高于MD抗性免疫攻毒组(R组);另一方面,普通非免疫攻毒组(F组) 的MDV-1含量于14、21 DPI时显著(P<0.05)高于普通免疫攻毒组(G组)。3)从MD抗性协同HVT疫苗免疫对病毒载量的影响看,普通非免疫攻毒组(F组)的MDV-1含量于14(P<0.05)、28(P<0.01)、35(P<0.05)DPI时显著高于MD抗性免疫攻毒组(R组)。结果表明,鸡MD抗性选育协同HVT疫苗接种可显著降低鸡羽囊的病毒载量,这将会降低MDV-1传播风险,并提高鸡的存活机会。
马立克病毒;羽囊;实时定量PCR;抗性选育;绝对定量
马立克病(Mark’s disease,MD)是由马立克病病毒(Mark’s disease virus,MDV)引起的一种恶性T淋巴细胞肿瘤,病毒经空气传播,传染力强,被感染鸡表现为神经系统紊乱、肿瘤和死亡,是危害世界养禽业的三种主要疾病之一。
在被MDV感染的鸡的所有组织中,只有鸡羽毛囊上皮细胞可产生大量有囊膜的、完全具有感染性的病毒粒子,因而羽囊在MDV传播中起重要作用。鸡羽毛囊上皮细胞中的病毒粒子有囊膜,随角化细胞脱落,成为传染性很强的无细胞病毒。能够对羽囊中MDV进行检测是非常有用的,因为羽囊能够在不要求杀死鸡的情况下,在一定的时间段内简便地作为样本以便对MDV的定性[1-2]及定量检测。对潜入鸡个体羽囊中MDV含量的测定能有助于判定疫苗对鸡是否有效,也能用于协助确定疫苗使用的最佳路线、接种疫苗的最佳时间等。对于被MDV感染的鸡,羽囊中的病毒负载量可能也是发病情况以及传染能力的一个有用的预测器。
在对MDV基因组DNA 70~80个特异区域或基因进行的生物学功能研究中,共计46个MDV特异性多肽得到鉴定,将它们分成三类:糖蛋白基因(gB等),致瘤相关基因(132-bpr序列、meq和pp38)及其他基因。1992年,meq基因首次由D.Jones等[3]鉴定,更重要的是发现它在MDV导致的T淋巴细胞瘤中高度表达。J.L.Liu等[4]通过meq基因的结构以及制备单克隆抗体对meq基因进行了较全面的研究,根据试验结果推断,meq是一个多功能的转录因子,可能对MDV和宿主细胞的基因表达有调控作用。
作者利用Real-time FQ-PCR绝对定量法,通过对MDV-1攻毒后MD抗性与普通霞烟鸡meq基因拷贝数的绝对定量,从而对羽囊中MDV-1含量进行检测,以分析比较MDV-1在MD抗性鸡组/普通鸡组,及HVT疫苗免疫鸡组/HVT疫苗未免疫鸡组体内的增殖情况。
1 材料与方法
1.1 病毒和实验动物
MDV-1强毒株YL040920/C6株为广西大学养禽与禽病研究所分离[5-6]并保存。7日龄健康霞烟鸡来自广西容县科技局实验鸡场保种的霞烟鸡MD抗性品系核心群[7-10]的后代。
1.2 主要试剂和仪器
SYBR®Premix Ex TaqTMⅡ(Perfect Real-Time)购自TaKaRa公司;Light Cycle2.0 型PCR 仪为德国 ROCHE 公司产品。
1.3 鸡攻毒试验
利用YL040920/C6攻毒的DEF细胞培养物,按每羽0.3 mL对实验鸡进行腹腔注射,1个月后翼下采集抗凝血,并分离鸡的外周血淋巴细胞,经禽肿瘤病三重PCR诊断技术[11]检测呈单一MDV-1攻毒后,采集鸡翅静脉抗凝血(经病毒蚀斑计数每0.4 mL血液含2 500 PFU的MDV-1)作为攻毒材料。试验分组:74羽普通霞烟鸡分为E组(未攻毒、未免疫的空白对照组,20羽)、F组(未免疫、MDV-1攻毒组,24羽)和G组(HVT免疫、MDV-1攻毒组,30羽)三组;77羽MD抗性霞烟鸡分为S组(未攻毒、未免疫的空白对照组,20羽)、T组(未免疫、MDV-1攻毒组,30羽)和R组(HVT免疫、MDV-1攻毒组,27羽)三组。7 d龄时取准备好的攻毒材料腹腔(0.4 mL·羽-1)注射F、G、T、R组鸡,于第7、14、21、28、35天(DPI)采集所有试验鸡有髓质的羽囊,按常规方法将试验鸡隔离饲养,期间要记录攻毒后死亡鸡及存活鸡的肿瘤发生及其检测结果。
1.4 羽囊总DNA的提取
采集有髓质的试验鸡的羽囊,挤压出羽髓并剪下羽毛根,研磨后按1∶5(W/V)加入PBS,反复冻融3 次,4 ℃ 12 000 r·min-1离心10 min;取300 μL 上清,加入等体积的组织裂解液及5 μL蛋白酶K(20 mg·mL-1),50 ℃消化2 h,4 ℃ 12 000 r·min-1离心10 min;吸取上清,加入等体积的Tris 饱和酚,充分振荡混匀,4 ℃ 12 000 r·min-1离心 10 min;取上层的水相加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)混匀后,4 ℃ 12 000 r·min-1离心10 min;取上层的水相加入2 倍体积预冷的无水乙醇和1/10 体积的3 mol·L-1乙酸钠,在-20 ℃放置2 h;4 ℃ 12 000 r·min-1离心15 min;小心倾弃上清,沉淀用70%乙醇1 mL 于4 ℃ 8 500 r·min-1离心 5 min 漂洗后,倾弃上清,室温风干15 min,用40 μL 含RNase A(终浓度为20 μg·mL-1)的TE 缓冲液溶解,放置-20 ℃备用。
1.5 羽囊中meq基因Real-time FQ-PCR
以上述提取的试验鸡羽囊(分别于7、14、21、28 和 35 DPI)的DNA为模板,每个样本的模板重复2孔,利用已建立的检测meq基因的Real-time FQ-PCR方法[12]扩增并检测荧光,得到模板起始拷贝数所对应的Ct值。
1.6 数据表示和统计分析
Real-time FQ-PCR反应后,将得到的各样品模板的起始拷贝数所对应的Ct值代到meq基因标准曲线公式[12](Ct值即y值):y=-3.32x+34.94中,计算每个样品中所含meq基因的拷贝数,再计算出MDV-1基因组的拷贝数(每个MDV基因组含两个meq基因)。采用t检验对每组MDV-1基因组含量进行差异显著性分析。
2 结 果
未攻毒的两个对照组(S、E组)羽囊中均无MDV-1检出。试验鸡的各攻毒组羽囊中 MDV-1在攻毒后第7天就开始被检测到,但是第7天只能检测到极少的量,在第14天达到最高峰,然后在第21、28、35天逐渐减少(表1)。
2.1 MD抗性品系羽囊中病毒载量的动态变化比较
在MDV-1攻毒后不同时间,测定MD抗性鸡的免疫攻毒组(R组)和非免疫攻毒组(T组)羽囊中MDV-1含量,结果见表1,T组的MDV-1含量于14、35 DPI时高于(P>0.05)R组,于28 DPI时显著高于(P<0.05)R组,于21 DPI时稍低于(P>0.05)R组。结果表明,对于MD抗性鸡,T组的MDV-1含量部分高于R组。

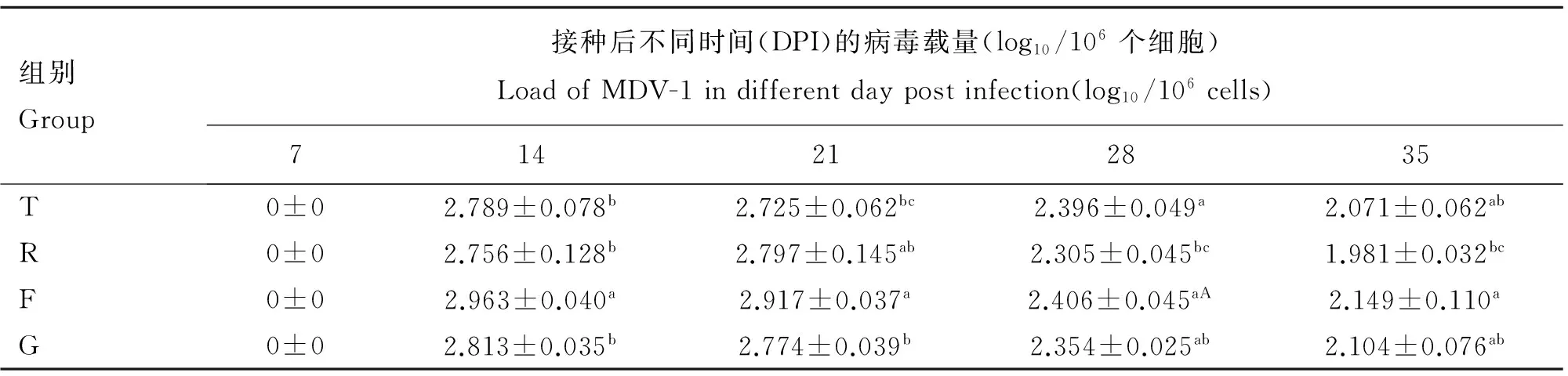
组别Group接种后不同时间(DPI)的病毒载量(log10/106个细胞)LoadofMDV-1indifferentdaypostinfection(log10/106cells)714212835T0±02.789±0.078b2.725±0.062bc2.396±0.049a2.071±0.062abR0±02.756±0.128b2.797±0.145ab2.305±0.045bc1.981±0.032bcF0±02.963±0.040a2.917±0.037a2.406±0.045aA2.149±0.110aG0±02.813±0.035b2.774±0.039b2.354±0.025ab2.104±0.076ab
同列中含相同字母肩注表示差异不显著(P>0.05);肩注小写字母不同表示差异显著(P<0.05);肩注大小写字母不同表示差异极显著(P<0.01)
In the same column,the same letter means no significant difference between treatments (P>0.05);different small letters mean significant difference (P<0.05);the different capital and small letters mean extremely significant difference (P<0.01)
2.2 普通品系鸡(F/G)组内羽囊中病毒载量的动态变化比较
在MDV-1攻毒后不同时间,测定普通鸡的免疫攻毒组(G组) 和非免疫攻毒组(F组)羽囊中MDV-1含量,结果见表1,F组的MDV-1含量于14、21 DPI时显著高于(P<0.05)G组,于28、35 DPI时高于(P>0.05)G组。结果表明,对于普通鸡,F组的MDV-1含量部分高于G组。
2.3 普通鸡(F/G)和MD抗性鸡(T/R)组间羽囊中病毒载量的动态变化比较
在MDV-1攻毒后不同时间,MD抗性非免疫攻毒组(T组)和普通非免疫攻毒组(F组)羽囊中MDV-1含量结果见表1,F组的MDV-1含量于14、21DPI时显著高于(P<0.05)T组,于28、35 DPI时高于(P>0.05)T组。结果表明,F组的MDV-1含量部分高于T组。
在MDV-1攻毒后不同时间,MD抗性免疫攻毒组(R组)和普通免疫攻毒组(G组)羽囊中MDV-1含量见表1,G组的MDV-1含量于14、28、35 DPI时高于(P>0.05) R组,于21 DPI时稍低于(P>0.05) R组。结果表明,G组的MDV-1含量总体上和R组相当。
在MDV-1攻毒后不同时间,测定MD抗性非免疫攻毒组(T组)和普通免疫攻毒组(G组)羽囊中MDV-1含量,结果见表1,G组的MDV-1含量于14、21、35 DPI时高于(P>0.05) T组,于28 DPI时稍低于(P>0.05) T组。结果表明,G组的MDV-1含量总体上和T组相当。
在MDV-1攻毒后不同时间,测定MD抗性免疫攻毒组(R组)和普通非免疫攻毒组(F组)羽囊中MDV-1含量,结果见表1,F组的MDV-1含量于14(P<0.05)、35(P<0.05) DPI时显著高于R组,于28 DPI时极显著高于(P<0.01)R组,于21 DPI时高于(P>0.05) R组。结果表明,F组的MDV-1含量总体上高于R组。
3 讨 论
MDV按其致病性和血清学反应不同分为三个血清型:血清Ⅰ型(MDV-1),包括所有致瘤致病的强毒株及其弱化株以及天然弱毒株;血清Ⅱ型(MDV-2),为自然的非致瘤株;血清Ⅲ型(MDV-3),为火鸡疱疹病毒(hepresviurs of turkeys,HVT),对鸡没有致病性。三个血清型之间具有一定的交叉免疫保护。因此,自从20世纪70年代以来,MD的预防很大程度上依靠使用血清Ⅰ、Ⅱ、Ⅲ型病毒的单价、二价或多价疫苗接种。
疫苗免疫、抗病育种和生物安全是控制MD的三大主要措施。由于多方面的原因:强毒株和野外变异株的不断出现、雏鸡的早期感染、MDV的广泛存在以及疫苗使用不当,导致免疫鸡群甚至于免疫过CVI988/Rispens株疫苗(目前最好的MD疫苗)的鸡群仍有MD的暴发。目前,鸡的基因组序列已完成,加之更为高效疫苗的研究变得越来越难的情形下,促使人们更重视抗病育种,采用遗传学方法从遗传本质上提高家禽的抗病能力就成为有效控制MD的重要策略。研究者们注意到不同遗传品系的鸡对MD的易感性不同,并研究培育出抗MD的鸡品系。本研究中所用实验鸡就是李康然等在20世纪90年代初期用表型遗传标记选育的方法选育的广西抗MD霞烟鸡[7]。
本研究就MD抗性选育和疫苗免疫对鸡羽囊MDV-1载量的影响进行了初步的分析比较,从MD抗性对病毒载量的影响看,普通非免疫鸡MDV-1的含量在两个时间点上显著高于MD抗性非免疫鸡间,然而,MD抗性免疫攻毒组MDV-1含量和普通免疫攻毒组总体上相当,这说明非免疫情况下MD抗性鸡相对于普通鸡保持了较好的MD抗性水平,不过,免疫因素使情况变得复杂了。从HVT疫苗免疫对病毒载量的影响看,MD抗性非免疫攻毒组MDV-1的含量在一个时间点上显著高于MD抗性免疫攻毒组,普通非免疫攻毒组MDV-1含量在两个时间点上显著高于普通免疫攻毒组,这说明HVT疫苗对MD感染鸡群具有极大的保护作用。尤其引人注意的结果是,普通非免疫攻毒组MDV-1含量在三个时间点上显著高于MD抗性免疫攻毒组,说明MD抗性选育协同HTV疫苗对鸡MD具有更强的抵抗作用。与之相反,MD抗性非免疫攻毒组MDV-1含量和普通免疫攻毒组近似,说明MD抗性育种对病毒载量的影响也许和HVT疫苗免疫对病毒载量的影响相互抵消了。总之,鸡MD抗性选育协同HTV疫苗接种可显著降低鸡羽囊的病毒载量。理论上,该结果为较深入地探究鸡抗MD的遗传基础及其分子机制提供了实验依据;同时也为MD的预防等实践工作提供了思路。
[1] DAVIDSON I,BORENSHTAIN R.The feather tips of commercial chickens are a favorable source of DNA for the amplification of Marek’s disease virus and avian leukosis virus,subgroup J[J].AvianPathol,2002,31(3):237-240.
[2] DAVIDSON I,BORENSHTAIN R.Novel applications of feather tip extracts from MDV-infected chickens;diagnosis of commercial broilers,whole genome separation by PFGE and synchronic mucosal infection[J].FEMSImmunolMedMicrobiol,2003,38(3):199-203.
[3] JONES D,LEE L F,LIU J L,et al.Marek disease virus encodes a basic-leucine zipper gene resembling the fos/jun oncogenes that is highly expressed in lymphoblastoid tumors[J].ProcNatlAcadSciUSA,1992,89(9):4042-4046.
[4] LIU J L,LEE L F,YE Y,et al.Nucleolar and nuclear localization properties of a herpesvirus bZIP oncoprotein,MEQ[J].JVirol,1997,71(4):3188-3196.
[5] 左天荣,赵子轶,韦 平,等.一株具有急性致瘤特性的马立克氏病病毒的分离与鉴定[J].病毒学报,2007,23(3):218-223. ZUO T R,ZHAO Z Y,WEI P,et al.Isolation and identification of a field isolate of Marek′s disease virus with acute oncogenicity[J].ChineseJournalofVirology,2007,23(3):218-223.(in Chinese)
[6] RENZ K G,COOKE J,CLARKE N,et al.Pathotyping of Australian isolates of Marek's disease virus and association of pathogenicity withmeqgene polymorphism[J].AvianPathol,2012,41(2):161-176.
[7] LI K R,WEI P,LIANG M F,et al.A study on selective breeding of Xiayan chicken for Marek’s disease resistance[C]//SILVA R F,CHENG H H,COUSSENS P M,et al.Current research on Marek’s disease.Kennett:American Association of Avian Pathologists,1996:75-79.
[8] JIN Y C,WEI P,NIU B X,et al.Studies on the association of BF1/BF2 gene expression patterns with traits of genetic resistance to Marek’s disease in chickens[J].FoodAgrImmunol,2014,25(2):220-228.
[9] JIN Y C,WEI P,WEI X X,et al.Marek’s disease resistant/susceptible MHC haplotypes in Xiayan chickens identified on the basis of BLB2 PCR-RFLP and BLB2/BF2 sequence analyses[J].BrPoultSci,2010,51(4):530-539.
[10] JIN Y C,WEI P,WEI X X,et al.Rapid detection of BF haplotypes by a semi-nested polymerase chain reaction,which causes resistance/susceptibility to Marek’s disease in chicken[J].ScandJImmunol,2010,72(2):94-97.
[11] 韦 平,何秀苗,王桂军,等.鸡肿瘤病快速鉴别诊断技术的建立[J].扬州大学学报(农业与生命科学版),2002,23(2):1-5. WEI P,HE X M,WANG G J,et al.The development of rapid differential diagnosis technique for avian tumors[J].JournalofYangzhouUniversity(AgriculturalandLifeSciencesEdition),2002,23(2):1-5.(in Chinese)
[12] 金元昌,韦 平,袁志栋,等.利用SYBR Green real-time PCR方法监控鸡外周血淋巴细胞中马立克病毒的载量[J].中国兽医学报,2013,33(8):1170-1173. JIN Y C,WEI P,YUAN Z D,et al.Monitoring Marek’s disease virus load in peripheral blood leukocytes of chicken using SYBR Green real-time PCR[J].ChineseJournalofVeterinaryScience,2013,33(8):1170-1173.(in Chinese)
(编辑 白永平)
Effects of Resistance Selection in Coordination with Vaccination on MDV-1 Loads in Feather Follicle of Chickens
JIN Yuan-chang1,2*,CHEN Zhuang1,LI Yu-feng1,YUAN Zhi-dong1
(1.CollegeofLifeScience,HunanUniversityofScienceandTechnology,Xiangtan411201,China;
2.PoultryScienceandHealth,GuangxiUniversity,Nanning530004,China)
The aim of the present study was to study the effects of HVT-vaccinated and MD resistant selection on virus loads in feather follicle of chickens after the challenge with MDV-1.Real-time FQ-PCR was used for absolute quantification of the DNA levels ofmeqof feather follicle sampled in 5 different times(7,14,21,28,35 DPI) from all chickens after the challenge for quantification of MDV-1.The load of MDV-1 was detected in feather follicle to analyzed and compared proliferation of MDV-1 in resistant/common or/and HVT-vaccinated/HVT-unvaccinated chickens.The results showed that 1) from the impact of MD-resistant on the MDV-1 loads,the load of MDV-1 were significantly higher in chickens of F group(common line,HVT-unvaccinated and MDV-challenged) whereas significantly lower(P<0.05) in chickens of T group(MD-resistant line,HVT-unvaccinated and MDV-challenged) in 14,21 DPI;On the one hand,R group(MD-resistant line,HVT-vaccinated and MDV-challenged) and G group(common line,HVT-vaccinated and MDV-challenged) give about the same load of MDV-1;2) From the impact of HVT-vaccinated on the MDV-1 loads,the load of MDV-1 were significantly higher in chickens of T group(MD-resistant line,HVT-unvaccinated and MDV-challenged) whereas significantly lower(P<0.05) in chickens of R group(MD-resistant line,HVT-vaccinated and MDV-challenged) in 28 DPI;On the one hand,the load of MDV-1 were significantly higher in chickens of F group(common line,HVT-unvaccinated and MDV-challenged) whereas significantly lower(P<0.05)in chickens of G group(common line,HVT-vaccinated and MDV-challenged) in 14,21 DPI:3) From the impact of MD-resistant and HVT-vaccinated on the MDV-1 loads,the load of MDV-1 were significantly higher in chickens of F group(common line,HVT-unvaccinated and MDV-challenged) whereas significantly lower in chickens of R group(MD-resistant line,HVT-vaccinated and MDV-challenged) in 14(P<0.05),28(P<0.01) and 35(P<0.05)DPI.These results indicated that the virus loads in feather follicle of chickens can be reduced significantly by resistance selection in coordination with vaccination,which will reduce the risk of MDV-1 transmission and improve the chicken’s chance of survival.
Marek’s disease virus(MDV);feather follicl;Real-time FQ-PCR;resistance selection;absolute quantization
10.11843/j.issn.0366-6964.2015.05.021
2014-09-17
湖南省自然科学基金项目(13JJ6055);湖南省普通高校化学与生物科学类专业大学生创新训练中心(G21323);湖南科技大学化学与生物学省级大学生创新训练中心项目
金元昌(1969-),男,山东日照人,副教授,博士,主要从事分子病毒学与基因工程方面的研究
*通信作者:金元昌,E-mail:404340774@qq.com
S852.659.1
A
0366-6964(2015)05-0836-05
