绵羊肺腺瘤病毒囊膜蛋白单克隆抗体的制备及双抗体夹心ELISA方法的初步建立
2015-03-22张宇飞孙晓林刘淑英
刘 月,张宇飞,孙晓林,刘淑英,2*
(1内蒙古农业大学兽医学院,呼和浩特 010018;2农业部动物临床诊疗技术重点实验室,呼和浩特 010018)
绵羊肺腺瘤病毒囊膜蛋白单克隆抗体的制备及双抗体夹心ELISA方法的初步建立
刘 月1,张宇飞1,孙晓林1,刘淑英1,2*
(1内蒙古农业大学兽医学院,呼和浩特 010018;2农业部动物临床诊疗技术重点实验室,呼和浩特 010018)
为制备抗绵羊肺腺瘤病毒(JSRV)囊膜蛋白(ENV)胞质尾区(CT)的单克隆抗体,利用生物信息学分析JSRV囊膜蛋白氨基酸序列,根据分析结果合成多肽,将此多肽分别连接钥孔血蓝蛋白(CT-KLH)和牛血清白蛋白(CT-BSA),用CT-KLH作为抗原免疫BALB/c小鼠,取免疫小鼠的脾细胞与骨髓瘤细胞融合。建立间接ELISA方法筛选分泌抗CT蛋白单克隆抗体的杂交瘤细胞,获得1株能稳定分泌抗CT蛋白单克隆抗体的杂交瘤细胞株,命名为8E5,亚类为 IgG2a/κ。间接ELISA检测培养上清效价为6.4×103,腹水效价为1×105。Western blot及免疫组化结果显示,这株杂交瘤细胞分泌的单克隆抗体能识别JSRV抗原,与其发生特异性反应。试验结果证明,单抗8E5是绵羊肺腺瘤的重要诊断试剂。应用8E5细胞株分泌的单克隆抗体建立JSRV-ENV的双抗体夹心ELISA检测方法,该ELISA检测方法特异性、重复性和敏感性良好,为快速检测诊断绵羊肺腺瘤和研究囊膜蛋白功能奠定了基础。
绵羊肺腺瘤病毒;囊膜蛋白;B细胞表位;单克隆抗体;ELISA
绵羊肺腺瘤病毒(Jaagsiekte sheep retrovirus,JSRV)是绵羊肺腺瘤(ovine pulmonary adenocarcinoma,OPA)的病原,该病毒主要侵害绵羊肺[1-3]。JSRV 属于β-反转录病毒属,基因组为线性单股正链RNA,JSRV全长7 462~7 580 bp,编码4个相互重叠的基因5′-gag-pro-pol-env-3′,其中env基因编码位于病毒外层的囊膜蛋白,包括表面蛋白(SU)和跨膜蛋白(TM),这些病毒蛋白质首先是以大的前体蛋白的形式被表达出来,之后经过裂解形成成熟的病毒蛋白质[4-6]。
绵羊肺腺瘤病毒在20 ℃时存活6周,80 ℃ 20 min以上才能使病毒灭活,潜伏期2~4年,病死率为100%[7],JSRV的环境耐受性和较长的潜伏期使得OPA的控制较为困难,所以早期的诊断有利于绵羊肺腺瘤的控制。在绵羊的基因组中存在与外源性绵羊肺腺瘤病毒(ex-JSRV)高同源性(90%以上)的内源性绵羊肺腺瘤病毒(en-JSRV)[8-9],导致绵羊肺腺瘤病羊体内未曾检测到JSRV的循环抗体,ex-JSRV可诱导机体的细胞免疫,但不能诱导B细胞分泌对应的抗体进行体液免疫[10],不能用常规的血清学方法进行诊断,因此特异性抗原的检测是诊断OPA的有效方法。en-JSRV与ex-JSRV主要的两个高变区分别位于囊膜蛋白(ENV)的跨膜蛋白(TM)亚基的胞质尾区(CT,即ENV编码区的第570—615位氨基酸)和长末端重复序列(LTR)的U3区[11-12],而LTR的U3 区是非编码区,不编码蛋白质,所以制备特异性的抗胞质尾区的单克隆抗体用于检测exJSRV抗原十分重要。由于en-JSRV与ex-JSRV 之间具有很高的同源性,采用常规的单抗制备方法很难制取特异性强的单克隆抗体,为了制备抗ex-JSRV蛋白的特异性单克隆抗体,作者从NCBI 数据库中搜索ex-JSRV 囊膜蛋白氨基酸序列,以本实验室登录到GenBank中的JSRV-NM株env基因序列(登录号:JQ837489)为模板翻译ex-JSRV囊膜蛋白氨基酸序列,根据SOPMA、Bcepred和ABCpred分别对ex-JSRV 囊膜蛋白的二级结构、亲水性、表面可及性、柔韧性、暴露表面、极性和抗原性分析的结果选定ex-JSTV特异性肽段进行人工合成,制备特异性抗ex-JSRV的单克隆抗体,并应用单克隆抗体建立了JSRV-ENV的双抗体夹心ELISA检测方法,为快速检测诊断绵羊肺腺瘤和研究囊膜蛋白功能积累资料。
1 材料与方法
1.1 动物与细胞
纯系6~8周龄雌性BALB/c小鼠购自北京维通利华公司。小鼠骨髓瘤细胞系(Sp2/0)购自昆明细胞中心。
1.2 主要试剂
跨膜蛋白亚基胞质尾区特异性多肽由杭州中肽生物有限公司合成。DMEM培养基和胎牛血清购自GIBCO公司。HAT培养基、HT培养基、聚乙二醇(PEG1450)、谷氨酰胺、完全福氏佐剂、不完全福氏佐剂均购自Sigma公司。检测小鼠单克隆抗体免疫球蛋白亚类的试剂盒购自Thermo公司。HRP-羊抗鼠IgG购自艾美杰公司。免疫组化二抗及显色试剂购自福建迈新公司,全蛋白提取试剂盒购自上海生工。其他常规用试剂为国产或进口分析纯。
1.3 单克隆抗体的制备
1.3.1 绵羊肺腺瘤病毒囊膜蛋白胞质尾区的生物信息分析与合成 通过生物信息学分析JSRV-NM囊膜蛋白的氨基酸序列(来自GenBank,序列登录号为JQ837489)。SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)软件分析该区域的二级结构,Bcepred(http://www.imtech.res.in/raghava/bcepred/bcepred_submission.html)软件分析亲水性、表面可及性、柔韧性、暴露表面、极性和抗原倾向性。ABCpred(http://www.imtech.res.in/raghava/abcpred/)预测抗原性。根据预测结果合成多肽,并分别与钥孔血蓝蛋白和牛血清白蛋白连接。
1.3.3 动物免疫及杂交瘤细胞株的筛选克隆 以合成的CT-KLH多肽按常规方法免疫BALB/c小鼠,脾淋巴细胞与SP2/0细胞以1∶10比例混合后用PEG1450融合。用间接ELISA检测阳性克隆,经有限稀释法亚克隆获得稳定分泌单克隆抗体的杂交瘤细胞。
1.3.4 单克隆抗体腹水制备与效价测定 选取8~10周龄的BABL/c雌鼠按常规方法制备腹水。采用间接 ELISA 法测定单克隆抗体的效价,以SP2/0细胞培养上清作为阴性对照,以阳性反应样品的最高稀释倍数作为其效价。
1.3.5 单克隆抗体亚类鉴定及抗体分泌稳定性鉴定 按说明书稀释羊抗鼠各类免疫球蛋白(IgG、IgM、IgA) 和亚类( IgG1、IgG2a、IgG2b、IgG3)包被酶标板,以HRP标记的羊抗鼠各类免疫球蛋白(IgG、IgM、IgA)和亚类(IgG1、IgG2a、IgG2b、IgG3) 抗体分别为二抗,取阳性细胞上清液检测,鉴定McAb 的类和亚类。将杂交瘤细胞系持续培养30代,测定F5、F10、F15、F20、F30代细胞上清OD450 nm值。
1.3.6 单克隆抗体Western blot和免疫组织化学鉴定 提取由本实验室保存的JSRV感染羊病肺组织的蛋白质样品,蛋白质样品经SDS-PAGE电泳后,转移到醋酸纤维素膜上,以杂交瘤细胞上清为一抗,用HRP标记羊抗鼠IgG抗体作为二抗,进行免疫印迹检测[13]。用本实验室保存的自然感染JSRV的羊肺组织制备石蜡切片进行免疫组化检测。
1.4 夹心ELISA检测方法的建立及评价
1.4.1 包被用多克隆抗体和检测用单克隆抗体稀释度的确定 将纯化的多克隆抗体(本实验室制备)分别1∶200、1∶300、1∶600和1∶1 200连续稀释6个稀释度,每个稀释度重复2孔,4 ℃包被酶标板反应过夜。将自制HRP标记的鼠单克隆抗体分别1∶200、1∶300、1∶600和1∶1 200倍比稀释,每个稀释度2重复孔,组成方阵确定多克隆抗体的最佳包被浓度和单克隆抗体的最佳检测稀释度。
1.4.2 最佳反应条件与阴阳性临界值的确定 用多抗和单抗的最佳稀释度,在不同反应条件下,对包被条件(37 ℃包被2 h加4 ℃过夜、37 ℃包被2 h和 4 ℃过夜)、封闭液种类(10%和5%胎牛血清,10%和5%BSA,10%和5%脱脂乳)、封闭时间(30、60、90、120 min)、检测样品孵育时间(30、60、90、120 min)、底物(TMB)孵育时间(10、15、20、30 min)进行筛选,以JSRV病肺组织提取蛋白质和正常肺组织提取蛋白质为检测样品进行ELISA试验,测定OD450 nm值,计算出P/N值,以确定最佳反应条件。
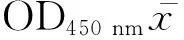
1.4.3 特异性试验 按照已经确立的双抗体夹心ELISA操作程序,分别检测羊的主要常见疫病(羊布病、口蹄疫、小反刍兽疫、羊痘、羊快疫、羊猝狙、羊黑疫和羊肠毒血病)的疫苗与制备的抗体有无交叉反应。羊布病疫苗(S2株)购自齐鲁制药,羊口蹄疫三联苗(包括亚Ⅰ型-JSL/ZK/06株、O型-O/MYA98/BY/2010株、A型-WH109株)购自金宇制药,小反刍兽疫疫苗(Nigeria75/1株) 购自天康生物,羊痘疫苗(弱毒株)和羊梭菌三联四防疫苗(腐败型梭菌,B、D型产气荚膜梭菌)购自中牧集团。
1.4.4 敏感性试验 将JSRV病肺组织提取蛋白质以1∶10、1∶50、1∶100、1∶200倍比稀释,按上述最佳反应条件进行双抗体夹心ELISA试验。确定该方法的最低检出浓度。
1.4.5 重复性 取4块不同批次包被的酶标板(20140826、20140827、20140828、20140829),计算批间变异系数CV=(s/OD450nm平均值)×100%;在同一块酶标板上进行批内重复,计算批内变异系数。
2 结 果
作者从生物信息学(图1)、组织学(图2)和免疫学等方面进行了研究。
2.1 生物信息分析结果
利用生物信息学分析绵羊肺腺瘤病毒囊膜蛋白氨基酸,分析胞质尾区特性,结果显示SOPMA 软件分析该区域的二级结构以β折叠、无规则卷曲和α螺旋构成(图1),Bcepred软件分析结果:亲水性(604—615 KNKERGDAGDDP);表面可及性(576—582 RDFLKMR,568—597 LHMKYRNMLQHQ,600—613 MELLKNKERGDAGD);柔韧性(600—609 MELLKNKERG);极性(604—607 KNKE);暴露面(576—593 RDFLKMRVEMLHMKYRNM,595—614 QHQHLMELLKNKERGDAGDD)抗原倾向性(550—575 LLGLGILVFIIIVVILIFPCLVRGMV)。ABCpred 预测抗原表位评分结果:第600—615、572—587、581—596位氨基酸评分分别是0.95、0.83、0.74。说明JSRV囊膜蛋白的胞质尾区存在抗原优势区。根据分析结果合成囊膜蛋白氨基酸序列第572—615位氨基酸(RGMVRDFLKMRVEMLHMKYRNMLQHQHLMELLKN-KERGDAGDDP),图1中矩形框内区域。
不同的颜色代表不同的二级结构:蓝色,α螺旋;绿色,β转角;红色,β折叠;黄色,无规则卷曲Lines in different colors represent different secondary structures:Blue,α helix;green,β turn;red,extended strand;and yellow,random coil图1 JSRV囊膜蛋白二级结构分析Fig.1 Secondary structure prediction results for the JSRV-ENV

A.肿瘤肺组织免疫组化,100×;B.肿瘤肺组织免疫组化,200×;C.肿瘤肺组织免疫组化400×;D.HE染色,200×A.Neoplastic lung tissue of sheep immunostaining,100×;B.Neoplastic lung tissue of sheep immunostaining,200×;C.Neoplastic lung tissue of sheep immunostaining,400×;D.HE staining,200×图2 免疫组织化学检测结果Fig.2 Result of ovine pulmonary adenocarcinoma
2.2 间接ELISA检测方法的建立
抗原的稀释质量浓度为20 μg·mL-1,血清稀释度为1∶200时,阴性与阳性血清的OD450 nm的比值相差最大(P/N=6.442)。建立筛选CT蛋白单克隆抗体的间接ELISA方法。阳性判断标准为待检血清OD450 nm>0.143,阴性判断标准为待检血清OD450 nm<0.128,之间为可疑。
2.3 杂交瘤细胞株的筛选与腹水效价测定
间接ELISA筛选融合后的细胞,获得1株高效分泌抗CT蛋白抗体的杂交瘤细胞株,命名为8E5。间接ELISA检测培养上清效价为6.4×103,腹水效价为1×105。
2.4 单克隆抗体的亚类和稳定性鉴定
按照试剂盒说明书进行试验,结果表明8E5属IgG2a/κ。将8E5连续培养30代,检测第F5、F10、F15、F20、F30代细胞培养上清的OD450 nm值稳定在0.9、1.0、1.2、1.2、1.2,结果表明此细胞株在连续传代中抗体分泌量变化不大,稳定性较好。
2.5 单克隆抗体免疫组织化学和Western blot分析
8E5单抗与绵羊肺腺瘤病羊肺组织进行免疫组织化学检测,主要在病变的腺瘤灶(箭头处)处可见棕色阳性信号(图2),结果证明8E5单克隆抗体可与绵羊肺腺瘤病毒自然感染病例的病变肺组织发生阳性反应,阳性信号主要在癌变的肺泡上皮细胞中的细胞质内,进一步证明8E5单克隆抗体可识别天然的绵羊肺腺瘤病毒的病毒粒子。
Western blot分析显示在70~100 ku与35~40 ku之间分别各有一条棕色条带,与绵羊肺腺瘤病毒囊膜蛋白的前体蛋白和跨膜蛋白(TM)大小相符[14],证明8E5单克隆抗体可识别变性的绵羊肺腺瘤病原(图3)。

1.蛋白质相对分子质量标准;2.阴性对照;3.JSRV病肺蛋白质样品1.Molecular weight marker;2.Negative control;3.Lung tissue proteins of JSRV infection图3 图 Western blot 检测结果Fig.3 Result of Western blot
2.6 双抗体夹心ELISA检测方法的建立
最佳多抗包被稀释度为1∶600(质量浓度0.039 mg·mL-1),最佳单抗检测稀释度为1∶300(质量浓度0.012 mg·mL-1);最佳包被条件为4 ℃过夜;最佳包被液为10%脱脂乳;最佳封闭时间为37 ℃ 60 min;最佳样品检测反应时间为37 ℃ 60 min;最佳底物反应时间为30 min。阴阳性临界值的判定,大于0.143判定为阳性,小于0.128判定为阴性,两者之间为可疑。
2.7 双抗体夹心ELISA检测方法的特异性试验
按照已经确立的双抗体夹心ELISA操作程序,对羊的常见主要疫病病原进行检测,结果表明各疫病的疫苗ELISA检测结果为阴性,证明建立的夹心ELISA方法特异性良好。
2.8 双抗体夹心ELISA检测方法的敏感性和重复性试验
该方法的最低检出稀释比例为1∶100,质量浓度为0.034 mg·mL-1。本试验建立的双抗体夹心ELISA检测方法的批间与批内重复性均小于10%,证明试验建立的双抗体夹心ELISA检测方法重复性良好。
3 讨 论
Bcepred 是基于氨基酸的理化特性进行抗原性预测,ABCpred是基于人工神经网络的方法进行预测,两种方法的分析结果都表明绵羊肺腺瘤病毒囊膜蛋白的胞质尾区存在优势的抗原表位。第605—615位氨基酸的二级结构为β折叠和无规则卷曲结构,这种相对疏松的二级结构有利于蛋白质与蛋白质的结合,抗原表位多出现在这种二级结构分布的区域。
通常相对分子质量小于10 ku的蛋白质不能免疫动物使其产生相应的抗体,即没有免疫原性,称为半抗原。研究表明,有些短肽如果不进行交联,往往无法单独引发抗体的产生[15]。为了提高CT多肽的免疫原性,本研究中使用KLH和BSA交联多肽。KLH由于其质量大,复杂性高,与其他载体蛋白相比KLH会引出更强的免疫应答,此蛋白质来源于软体动物,它在系统发展上远离哺乳动物物种,在测定过程中产生会与非典型靶点样品发生交叉反应的抗体的可能性较小。BSA具有很好的可溶性,适合做包被抗原。作为大分子BSA同样也有免疫原性,但ELISA试验所使用的封闭液多是来源于牛的脱脂乳和BSA,用连接BSA的多肽制备的抗体会影响试验结果。
J.E.Henzy等[14]用抗跨膜蛋白(TM)的单克隆抗体做Western blot检测结果与本试验结果相符,可识别绵羊肺腺瘤病毒囊膜蛋白的前体蛋白和跨膜蛋白。用8E5单克隆抗体与自然感染绵羊肺腺瘤病毒的病羊肺组织进行免疫组织化学检测的阳性信号主要分布在癌变的肺泡上皮细胞,与E.Beytut等[16]使用抗绵羊肺腺瘤病毒衣壳蛋白(JSRV-CA)多克隆抗体和C.Murgia等[17]使用抗绵羊肺腺瘤病毒囊膜蛋白(JSRV-ENV)单克隆抗体做的免疫组织化学检测结果相符,证明8E5单抗可以识别变性的和天然的绵羊肺腺瘤病毒的病毒粒子。
C.Summers等[10]用重组蛋白JSRV-CA和纯化的病羊肺流出液分别免疫羊只能诱导T细胞产生免疫应答,引起细胞免疫,而不能诱导B细胞分泌特异性抗体进行体液免疫,这可能是因为胚胎期就表达的与外源性绵羊肺腺瘤病毒(ex-JSRV)高度同源性的内源性绵羊肺腺瘤病毒(en-JSRV)影响所致[8]。跨膜蛋白(TM)的胞质尾区(CT)是en-JSRV与ex-JSRV主要的高可变区,本试验所用的缺失第570位的氨基酸的CT多肽连接钥孔血蓝蛋白(CT-KLH),免疫BALB/c小鼠后,可诱导体液免疫,经过4次免疫后血清效价达6.4×103,提示该肽段作为绵羊肺腺瘤病毒疫苗肽的潜力,可用于绵羊肺瘤的预防。将本试验所用CT-KLH多肽作为疫苗肽,预防绵羊肺腺瘤,除了需要检测绵羊是否会产生特异性抗体外,还需要验证该多肽的安全性。研究证明绵羊肺腺瘤病毒的囊膜基因是致瘤基因[18-19],编码的囊膜蛋白可诱导鸟成纤维细胞[20]、鼠成纤维细胞[21-23]、狗肾上皮细胞发生恶性转化[24-25],将绵羊肺腺瘤病毒的囊膜基因与腺相关病毒(adeno-associated virus,AAV)连接构建表达载体,以劳斯肉瘤病毒(Rous sarcoma virus,RSV)的启动子启动表达JSRV的囊膜蛋白,在免疫缺陷小鼠体内5个月后可诱发肺瘤并致死[26]。当将启动子改为JSRV自身的强启动子LTR后,在具有免疫力的小鼠体内2.5个月后可发生癌变[27]。M.Palmarini等[28]通过替换JSRV跨膜蛋白的胞质尾区的酰肌醇3磷酸激酶结合位点,发现JSRV囊膜蛋白对鼠成纤维细胞的转化率降低,证明JSRV的胞质尾区蛋白对细胞的转化作用必不可少。但是JSRV跨膜蛋白亚基胞质尾区蛋白在细胞内和动物体内单独表达是否会引起细胞转化和致瘤并未确定,所以本试验所用CT-KLH多肽为制备绵羊肺腺瘤的候选疫苗肽提供新思路,但临床应用需要进一步验证。
由于JSRV缺乏体外培养体系,不能检测本试验制备的单克隆抗体对绵羊肺腺瘤病毒的中和活性,但Western blot和免疫组织化学试验证明,CT单克隆抗体与变性和天然的OPA病原发生免疫反应,说明CT单抗识别的是一个线性表位。
目前,国内尚无绵羊肺腺瘤病毒跨膜蛋白单克隆抗体制备的报道;本研究通过分析目的蛋白的跨膜区,合成多肽制备跨膜蛋白抗胞质尾区的CT单克隆抗体,并初步建立了双抗体夹心ELISA方法。本试验建立的双抗体夹心ELISA,检测绵羊肺腺瘤病毒囊膜蛋白方法的重复性与稳定性好,最低检出质量浓度为0.034 mg·mL-1,通过用本试验建立的方法检测羊常见疫病的疫苗,证明羊的常见疫病不会影响本试验建立的检测方法。使用HRP标记的CT单抗,用提前包被多抗并封闭好的的酶标板检测只需150 min即可得出结果,有利于高通量快速检测绵羊肺腺瘤。
4 结 论
通过生物信息学分析绵羊肺腺瘤病毒囊膜蛋白,预测到一段抗原性好并位于内源性绵羊肺腺瘤病毒与外源性绵羊肺腺瘤病毒主要高可变区的抗原表位,合成该表位多肽后免疫小鼠,成功地筛选出1株稳定分泌抗JSRV-CT的单克隆抗体的细胞株,该抗体可识别变性和天然的绵羊肺腺瘤病毒粒子,用单抗建立的绵羊肺腺瘤双抗体夹心ELISA检测方法特异、稳定且灵敏快速,有利于高通量的检测。
[1] SUMMERS C,BENITO A,ORTIN A,et al.The distribution of immune cells in the lungs of classical and atypical ovine pulmonary adenocarcinoma[J].VetImmunolImmunopathol,2012,146(1):1-7.
[2] SOZMEN M,BEYTUT E.An investigation of growth factors and lactoferrin in naturally occurring ovine pulmonary adenomatosis[J].JCompPathol,2012,147(4):441-451.
[4] GRIFFITHS D J,MARTINEAU H M,COUSENS C.Pathology and pathogenesis of ovine pulmonary adenocarcinoma[J].JCompPathol,2010,142(4):260-283.
[5] BERKOWITZ R,FISHER J,GOFF S P.RNA packaging[J].CurrTopMicrobiolImmunol,1996,214:177-218.
[6] BAI J,BISHOP J V,CARLSON J O,et al.Sequence comparison of JSRV with endogenous proviruses:envelope genotypes and a novel ORF with similarity to a G-protein-coupled receptor[J].Virology,1999,258(2):333-343.
[7] COUSENS C,THONUR L,IMLACH S,et al.Jaagsiekte sheep retrovirus is present at high concentration in lung fluid produced by ovine pulmonary adenocarcinoma-affected sheep and can survive for several weeks at ambient temperatures[J].ResVetSci,2009,87(1):154-156.
[8] QI J W,WU X L,LIU S Y,et al.Expression of endogenous beta retroviruses and Hyal-2 mRNA in immune organs of fetuses and lambs[J].VirolSin,2012,27(2):83-92.
[9] SPENCER T E,PALMARINI M.Endogenous retroviruses of sheep:a model system for understanding physiological adaptation to an evolving ruminant genome[J].JReprodDev,2012,58(1):33-37.
[10] SUMMERS C,DEWAR P,VAN DER MOLEN R,et al.Jaagsiekte sheep retrovirus-specific immune responses induced by vaccination:a comparison of immunisation strategies[J].Vaccine,2006,24(11):1821-1829.
[11] PALMARINI M,HALLWIRTH C,YORK D,et al.Molecular cloning and functional analysis of three type D endogenous retroviruses of sheep reveal a different cell tropism from that of the highly related exogenous jaagsiekte sheep retrovirus[J].JVirol,2000,74(17):8065-8076.
[12] ARNAUD F,CAPORALE M,VARELA M,et al.A paradigm for virus-host coevolution:sequential counter-adaptations between endogenous and exogenous retroviruses[J].PLoSPathog,2007,3(11):e170.
[13] COLIGAN J E,KRUISBRRK A M,MARGULIESD H,et al.Current Protocols in Immunology[M].John Wiley & Sons Inc,2003.
[14] HENZY J E,COFFIN J M.Betaretroviral envelope subunits are noncovalently associated and restricted to the mammalian class[J].JVirol,2013,87(4):1937-1946.
[15] BERGERON R J,WEIMAR W R,MÜLLER R,et al.Synthesis of reagents for the construction of hypusine and deoxyhypusine peptides and their application as peptidic antigens[J].JMedChem,1998,41(20):3888-3900.
[16] BEYTUT E,SÖZMEN M,ERGNSOY S.Immunohistochemical detection of pulmonary surfactant proteins and retroviral antigens in the lungs of sheep with pulmonary adenomatosis[J].JCompPathol,2009,140(1):43-53.
[17] MURGIA C,CAPORALE M,CEESAY O,et al.Lung adenocarcinoma originates from retrovirus infection of proliferating type 2 pneumocytes during pulmonary post-natal development or tissue repair[J].PLoSPathog,2011,7(3):e1002014.
[18] LIU S L,MILLER A D.Oncogenic transformation by the jaagsiekte sheep retrovirus envelope protein[J].Oncogene,2007,26(6):789-801.
[19] CAPORALE M,COUSENS C,CENTORAME P,et al.Expression of the jaagsiekte sheep retrovirus envelope glycoprotein is sufficient to induce lung tumors in sheep[J].JVirol, 2006,80(16):8030-8037.
[20] ALLEN T E,SHERRILL K J,CRISPELL S M,et al.The jaagsiekte sheep retrovirus envelope gene induces transformation of the avian fibroblast cell line DF-1 but does not require a conserved SH2 binding domain[J].JGenVirol,2002,83(Pt 11):2733-2742.
[21] MAEDA N,INOSHIMA Y,FRUMAN D A,et al.Transformation of mouse fibroblasts by Jaagsiekte sheep retrovirus envelope does not require phosphatidylinositol 3-kinase[J].JVirol, 2003,77(18):9951-9959.
[22] MAEDA N,PALMARINI M,MURGIA C,et al.Direct transformation of rodent fibroblasts by jaagsiekte sheep retrovirus DNA[J].ProcNatlAcadSciUSA,2001,98(8):4449-4454.
[23] CHOW Y H,ALBERTI A,MURA M,et al.Transformation of rodent fibroblasts by the jaagsiekte sheep retrovirus envelope is receptor independent and does not require the surface domain[J].JVirol,2003,77(11):6341-6350.
[24] LIU S L,MILLER A D.Transformation of madin-darby canine kidney epithelial cells by sheep retrovirus envelope proteins[J].JVirol,2005,79(2):927-933.
[25] JOHNSON C,SANDERS K,FAN H.Jaagsiekte sheep retrovirus transformation in Madin-Darby canine kidney epithelial cell three-dimensional culture[J].JVirol, 2010,84(10):5379-5390.
[26] WOOTTON S K,HALBERT C L,MILLER A D.Sheep retrovirus structural protein induces lung tumours[J].Nature,2005,434(7035):904-907.
[27] LINNERTH-PETRIK N M,SANTRY L A,YU D L,et al.Adeno-associated virus vector mediated expression of an oncogenic retroviral envelope protein induces lung adenocarcinomas in immunocompetent mice[J].PLoSOne, 2012,7(12):e51400.
[28] PALMARINI M,MAEDA N,MURGIA C,et al.A phosphatidylinositol 3-kinase docking site in the cytoplasmic tail of the Jaagsiekte sheep retrovirus transmembrane protein is essential for envelope-induced transformation of NIH 3T3 cells[J].JVirol, 2001,75(22):11002-11009.
(编辑 白永平)
Preparation of the Monoclonal Antibody against Envelope Protein of JSRV and Development of Double Antibody Sandwich ELISA for JSRV
LIU Yue1,ZHANG Yu-fei1,SUN Xiao-lin1,LIU Shu-ying1,2*
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Huhhot010018,China; 2.KeyLaboratoriesofAgricultureforAnimalClinicalDiagnosisTechnology,Huhhot010018,China)
In order to prepare monoclonal antibody against the cytoplasmic tail of the envelope protein of Jaagsiekte sheep retrovirus(JSRV),the amino acid sequence of the JSRV envelope protein was analyzed by bioinformatics to synthetize polypeptide.Then the polypeptide was connected with Keyhole Limpet hemocyanin(CT-KLH) or bovine serum albumin(CT-BSA),respectively.Polypeptide CT-KLH was immunized to the BALB/c mice as antigen,and the spleen cells of immunized mice were fused with SP2/0 myeloma cells.An indirect ELISA was developed to screen positive antibody producing cells using the CT protein.A hybridoma stably secreting MAb designated as 8E5 was obtained against CT protein.The monoclonal antibody belonged to IgG2a/κ.The titers of supernatant and ascites were 6.4×103and 1×105as detected by ELISA,respectively.The results of western blot and immunohistochemistry showed that this hybridoma secreted MAb could react specifically with the JSRV.The results suggested that the MAb-8E5 is important diagnostic reagents for detection of ovine pulmonary adenocarcinoma (OPA).A sandwich ELISA was established by using 8E5 secreted monoclonal antibody.The results indicated that the ELISA possessed good specificity and repeatability,and higher sensitivity.The monoclonal antibody could be used in diagnosis for OPA and further research of envelope protein function.
Jaagsiekte sheep retrovirus;envelope protein;B cell epitopes;monoclonal antibody;ELISA
10.11843/j.issn.0366-6964.2015.05.016
2014-05-28
国家自然科学基金(31160493;31360597);内蒙古科技创新引导基金项目(20130224);教育部博士点基金博导类项目(20111515110008)
刘 月(1986-),女,辽宁康平人,博士生,主要从事动物生理学和病理学研究,E-mail:liuyue105219@163.com
*通信作者:刘淑英,博士生导师,E-mail:liushuying-imau@126.com
S852.659.3
A
0366-6964(2015)05-0800-08
