转内切葡聚糖酶基因罗伊乳酸杆菌的构建及其肉鸡饲喂效果验证
2015-03-22曹平华杨雨鑫杨明明陈玉林
王 磊,曹平华,蔡 蓓,高 印,高 康,杨雨鑫,杨明明,袁 超,陈玉林*
(1.西北农林科技大学动物科技学院,杨凌 712100; 2.青海大学青海省畜牧兽医科学院,西宁 810016;3.河南科技大学动物科技学院,洛阳471003; 4.中国农业科学院兰州畜牧与兽药研究所,兰州 730050)
转内切葡聚糖酶基因罗伊乳酸杆菌的构建及其肉鸡饲喂效果验证
王 磊1,2,曹平华1,3,蔡 蓓1,高 印1,高 康1,杨雨鑫1,杨明明1,袁 超4,陈玉林1*
(1.西北农林科技大学动物科技学院,杨凌 712100; 2.青海大学青海省畜牧兽医科学院,西宁 810016;3.河南科技大学动物科技学院,洛阳471003; 4.中国农业科学院兰州畜牧与兽药研究所,兰州 730050)
本研究旨在构建可胞外分泌内切葡聚糖酶,且具有降解β-葡聚糖能力的转内切葡聚糖酶基因罗伊乳酸杆菌,并对其进行肉鸡饲喂效果验证,为后续转基因乳酸杆菌在动物生产中的应用奠定基础。采用PCR和酶切连接方法构建pLEM4157(cel) 载体,转化Lactobacillus.reuteriXC1感受态细胞,进行聚丙烯胺凝胶电泳表达谱分析和内切葡聚糖酶活性测定,同时测定其肉鸡饲喂效果。结果表明,克隆的内切葡聚糖酶基因大小为1 500 bp,经测序比对,与已报道基因序列相似性为99%,氨基酸序列相似性为100%;Native-PAGE 和SDS-PAGE分析结果表明,内切葡聚糖酶基因celW成熟肽在罗伊乳酸杆菌的蛋白分子量均为52 ku左右,与理论计算值相符;L.reuteripLEM4157(cel) 培养上清和胞内上清内切葡聚糖酶活性分别为(0.96±0.08)和(0.37±0.09) U·mL-1;L.reuteripLEM4157(cel) 对肉仔鸡生长性能无显著影响,但可显著降低21日龄肉仔鸡十二指肠、空肠pH,促进21日龄肉仔鸡肾、法氏囊、胸腺和胰腺的生长发育,增加42 日龄肉仔鸡的胸腺和胰腺指数,提高肉仔鸡21日龄血清白球比、钙、磷含量和42 日龄血清葡萄糖含量。L.reuteripLEM4157(cel) 成功分泌表达了内切葡聚糖酶,具有降解羧甲基纤维素的能力和一定的肉鸡饲喂效果。
转基因;内切葡聚糖酶基因;罗伊乳酸杆菌;饲喂效果;肉鸡
目前,畜牧业养殖严重依赖抗生素,其被广泛地用于治疗疾病或作为生长促进剂,从而造成抗生素的滥用和误用,同时使畜禽和人类自身产生极强的耐药性,严重威胁到人类的健康[1]。乳酸杆菌是动物胃肠道的优势细菌之一[2-3],其可以产生大量的乳酸和乙酸降低肠道pH[4]或与致病菌竞争肠上皮细胞黏附位点,来抑制致病菌的生长[5],同时肠道来源的乳酸杆菌具有极强的黏附和定植能力以及耐酸、耐胆盐特性[6]。因此乳酸杆菌作为抗生素替代品或饲料添加剂被广泛应用于畜禽养殖,或作为载体(宿主)来表达外源基因和抗原[7-8]。
β-葡聚糖是谷物细胞壁的主要成分,具有极强的吸附和螯合能力,严重阻碍动物对各种营养素的消化和吸收,是单胃动物日粮中主要的抗营养因子之一[9-10],同时由于单胃动物(如猪和家禽)缺少或很少分泌 β-葡聚糖酶,大量营养素被排泄到体外,造成了对环境的污染。在实际生产中,人们往往通过在饲料中添加相应的外源酶制剂来消除这种抗营养因子的不良影响。许多研究已经表明,添加 β-葡聚糖酶,可以有效地提高养分消化吸收效率,减少内源损失,改善动物的生产性能[11-12]。但外源酶制剂的添加,只能获得短期效应,无形之中也增加了饲料成本[13],而且其在饲料制作过程中,易因高温而失活[14]。因此,运用基因工程技术,构建能够表达和分泌水解酶类的乳酸杆菌重组菌,将是一种可替代的和廉价的策略[15]。
在本研究中,我们通过克隆枯草芽孢杆菌内切葡聚糖酶基因,构建了既能降解β-葡聚糖又具有益生特性的转基因乳酸杆菌,并对其异源酶的生产和肉鸡饲喂效果进行了测定和验证,以此来改善肉仔鸡养分消化利用率、提高其生产性能、减少肠道疾病,降低生产成本。
1 材料与方法
1.1 菌种、质粒及培养条件
大肠杆菌 DH5α购自全式金生物科技(北京)有限公司;B.subtilisWL001(GenBank No.:KJ528401)和L.reuteriXC1(GenBank No.:KJ528405) 由本实验室筛选鉴定并保存;pMD19-T载体购自大连宝生物工程有限公司(TaKaRa)。大肠杆菌—乳酸菌穿梭质粒 pLEM415 由法国 Mr.Michel Fons 惠赠。枯草芽孢杆菌和大肠杆菌接种LB液体或固体培养基,37 °C 220 r·min-1振荡或静置培养。乳酸杆菌接种MRS液体或固体培养基,37 °C 厌氧静置培养。抗生素浓度:氨苄青霉素(Sigma)100 μg·mL-1,红霉素(Sigma) 5 μg·mL-1。
1.2 工具酶和主要试剂
T4 DNA 连接酶和限制性内切酶购自美国 Promega 公司,DNA marker(Cat:N3232S)均购自美国 NEB 公司,DNA marker(Cat:D501A)和rTaqDNA 聚合酶购自宝生物工程(大连)有限公司,细菌基因组 DNA 提取试剂盒、质粒小量提取试剂盒和 PCR 产物纯化试剂盒均购自美国 Omega 公司,蛋白胨、酵母抽提物购自 OXOID 公司,琼脂粉、葡萄糖、牛肉膏、磷酸氢二钾、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰、吐温-80、氯化钠、乙二胺四乙酸二钠、羧甲基纤维素钠(CMC-Na)、刚果红购自西安沃尔森生物有限公司和杨凌三利化玻仪器公司,甘油购自美国 Sigma 公司。
1.3 细菌基因组DNA和质粒DNA的提取
参照 Omega 公司细菌基因组 DNA 提取试剂盒操作说明提取枯草芽孢杆菌基因组DNA;参照Omega公司质粒小量提取试剂盒操作说明提取细菌质粒DNA。
1.4 内切葡聚糖酶基因的扩增及鉴定
根据GenBank(NC:000964.2)提供的序列,利用软件 Primer Premier 5.0 设计引物C1和 C2,并委托南京金斯瑞生物工程技术有限公司合成(下同)。引物序列:C1:5′-ATGAAACGGTCAAT-CTCGATTTT-3′,C2:5′-CTAATTTGGTTCTGTTCCCCAAATCA-3′。以B.subtilisWL001基因组DNA为模板,PCR 扩增内切葡聚糖酶基因celW,反应条件: 95 ℃预变性 3 min;95 ℃变性 30 s,52 ℃退火 30 s,72 ℃延伸 90 s,35 个循环;72 ℃延伸 10 min。片段回收纯化后与 pMD19-T 载体连接,转化大肠感受态细胞,经菌液 PCR和酶切鉴定后送南京金斯瑞生物工程技术有限公司测序验证,阳性克隆命名为pMD19-T-celW。
1.5 乳酸杆菌原核表达载体的构建及分泌表达
1.5.1 乳酸杆菌原核表达载体的构建 根据GenBank(No.:M76708.1;M60178.1)提供的序列,委托南京金斯瑞生物技术有限公司合成包含乳酸脱氢酶启动子PidhL、Usp45基因信号肽SPusp45和增强子LEISS的融合片段,并在上游5′端 引入BamH I酶切位点,下游3′端 引入SpeI酶切位点,双酶切后连接pLEM415,转化大肠杆菌感受态细胞,获得pLEM4155;以阳性克隆pMD19-T-celW为模板,用引物对C4(5′引入SpeI酶切位点)/C5(3′引入XbaI酶切位点)PCR扩增celW基因成熟肽celWM,反应条件同上。引物序列:C4:5′-CGGACTAGTCAGGGACAAAAACGCCAG-3′,C5:5′-TCCCTCTAGATAATTTGGTTCTGTTCCCC-AAATCA-3′(斜体部分为酶切位点)。celWM片段回收纯化后,经SpeI和XbaI双酶切,连接pLEM4155,转化大肠杆菌感受态细胞,获得pLEM4157(cel),酶切鉴定、测序确保阅读框正确。
1.5.2 pLEM4157(cel) 在罗伊乳酸杆菌中的分泌表达 重组载体质粒 pLEM4157(cel) 转化罗伊乳酸杆菌感受态细胞,PCR鉴定正确后,接种5 μg·mL-1红霉素的MRS液体培养基,37 ℃静置培养72 h。离心收集菌液上清和菌体细胞,PBS冲洗重悬菌体细胞,超声波破碎。菌液上清用超滤管浓缩后分别进行SDS-PAGE和Native-PAGE分析以及CMC-Na平板检测。
1.5.3 重组菌pLEM4157(cel) 酶活分析 以CMC-Na为底物,采用DNS法,分别对菌液上清和破碎后菌体上清进行酶活测定。
1.6 肉鸡饲养试验
1.6.1 供试菌种制备 重组罗伊乳酸杆菌的制备参照L.J.Mappley 等2013年的方法进行[16]。对重组罗伊乳酸杆菌进行平板划线,挑取单菌落接种10 mL MRS 液体培养基,37 ℃,厌氧静置培养 16 h 后,1∶100比例接种100 mL MRS 液体培养基,37 ℃,厌氧静置培养 16 h 后,3 000 r·min-1离心10 min,收集菌体细胞。菌体细胞用无菌水冲洗3遍后,重悬于20 mL 无菌水并定容到2 000 mL,使菌体细胞浓度达到2.5 × 108cfu·mL-1(细胞浓度的测定采用梯度稀释,平板计数的方法进行),分为4等份(500 mL·份-1)。
1.6.2 试验动物及试验设计 试验采用单因子完全随机设计。选取体重相近、健康的240 只1日龄AA肉鸡,随机分为3组,每组4个重复,每个重复20只鸡,按常规程序免疫。试验期42 d,分为育雏期(1~21 d)和育成期(21~42 d)两个阶段。第I组饲喂基础日粮;第II组饲喂基础日粮并饮水饲喂L.reuteripLEM4155;第III组饲喂基础日粮并饮水饲喂L.reuteripLEM4157(cel)。
1.6.3 基础日粮及饲养管理 试验基础日粮采用大麦-小麦型日粮,日粮组成见表1。采用笼养方式,自由采食,常规程序饲养管理。
1.6.4 生产性能指标测定 在整个试验期,准确记录每个重复肉仔鸡每天的投料量,并收集剩余料(剔除羽毛、皮屑和粪便)称重,计算饲料消耗量和平均日采食量。在肉仔鸡第1、21 和42天分别进行空腹称重,计算平均日增重。最后根据日采食量和日增重计算饲料转化率。
1.6.5 肠道pH测定 分别在肉仔鸡21和42日龄时,每个重复随机选取1只肉仔鸡,颈部放血处死后,解刨剥离十二指肠、空肠、回肠,每个肠段选取3个不同的点,用手持数显pH计,测定pH。
1.6.6 免疫器官指数的测定 在试验开始后的第21和42 天,每重复组随机抽取1只鸡,称量活体重,颈静脉放血处死后,分别采摘心、胸腺、胰腺、法氏囔、肝、肾和脾并称重,测定免疫器官指数。
1.6.7 血液生理生化指标测定 在试验开始后的第21 和42天,每重复组随机抽取1只鸡,颈静脉放血处死后,收集血液制备血清,置于-20 ℃低温冰箱中冻存备用。血清送杨凌高新技术示范区医院测定血清生理生化指标。
表1 试验日粮组成
Table 1 Composition of the experimental diet

%
1.预混料(/kg 日粮):1~21 d:Mn 120 mg,Fe 100 mg,I 0.7 mg,Zn 100 mg,Se 0.3 mg,Cu 8 mg,VA 8 000 IU,VE 20 IU,VD31 000 IU;核黄素 8.0 mg,VK 0.5 mg,硫胺素 2.0 mg,烟酸 35 mg,VB63.5 mg,生物素 0.18 mg,VB120.01 mg,泛酸 10.0 mg,抗氧化剂 0.4 g,叶酸 0.55 mg,氯化胆碱 1 g;22~42 d:Mn 60 mg,Fe 60 mg,I 0.6 mg,Mn 80 mg,Se 0.3 mg,Cu 8 mg,VA 6 000 IU,VE 30 IU,VD3500 IU,核黄素 5.0 mg,VK 0.5 mg,硫胺素 2.0 mg,烟酸 30 mg,VB63.0 mg,生物素 0.15 mg,VB120.01 mg,泛酸 10.0 mg,抗氧化剂 0.5 g,叶酸 0.55 mg,氯化胆碱 1 g
1.The premix provided per kilogram of diets:1-21 d:Mn 120 mg,Fe 100 mg,I 0.7 mg,Zn 100 mg,Se 0.3 mg,Cu 8 mg,VA 8 000 IU,V E 0 IU,VD31 000 IU,flavin 8.0 mg,VK 0.5 mg,thiamine 2.0 mg,niacin 35 mg,VB63.5 mg,biotin 0.18 mg,VB120.01 mg,pantothenic acid 10.0 mg,antioxidant 0.4 g,folic acid 0.55 mg,Choline-Cl 1 g;22-42 d:Mn 60 mg,Fe 60 mg,I 0.6 mg,Zn 80 mg,Se 0.3 mg,Cu 8 mg,VA 6 000 IU,VE 30 IU,VD3500 IU,flavin 5.0 mg,mVK 0.5 mg,thiamine 2.0 mg,niacin 30 mg,VB63.0 mg,biotin 0.15 mg,VB120.01 mg,pantothenic acid 10.0 mg,antioxidant 0.5 g,folic acid 0.55 mg,Choline-Cl 1 g
1.7 统计分析
试验数据采用 Excel 和 SPSS 13.0 进行 One-way ANOVA 统计分析,采用 Duncan 法检测分析各组差异显著性。
2 结 果
2.1 内切葡聚糖酶基因的扩增及鉴定
如图1泳道1和2所示,扩增条带大小1 500 bp,与目的条带预期大小一致;如图1泳道3和4所示,BamH Ⅰ 和Hind Ⅲ双酶切 pMD19-T-cel15 质粒,经琼脂糖凝胶电泳检测,得到大小为 1 500 bp 的目的片段和大小为 2 693 bp 的空载片段,表明celW成功连接 T 载体。测序结果经 Blast 比对发现,克隆序列与已报道内切葡聚糖酶基因序列相似性为99%,氨基酸序列相似性为100%,celW基因克隆成功。

M1.DNA相对分子质量标准DL 2000;1、2.内切葡聚糖酶基因 celW扩增片段; M2.DNA相对分子质量标准;3、4.BamH Ⅰ+ Hind Ⅲ双酶切 pMD19-T-celW 质粒片段M1.DL 2000 DNA ladder;1,2.Endoglucanase gene celW fragment;M2.1 kb DNA ladder;3,4,pMD19-T-celW fragments digested by BamH Ⅰ+Hind Ⅲ图1 内切葡聚糖酶基因的扩增及鉴定Fig.1 Amplification and identification of endoglucanase gene celW
2.2 乳酸杆菌原核表达载体的构建
PCR扩增celW基因成熟肽编码序列celWM,通过相应的酶切位点,克隆到 pLEM4155 载体中,产生 pLEM4157(cel) 载体(图2)。pLEM4157(cel) 转化E.coilDH5α 质粒,经SpeⅠ和XbaⅠ双酶切,凝胶电泳检测后,产生大小为 1 413 bp 的目的片段和 6 640 bp的骨架片段(图3),经测序鉴定阅读框完整正确,表明载体构建成功。
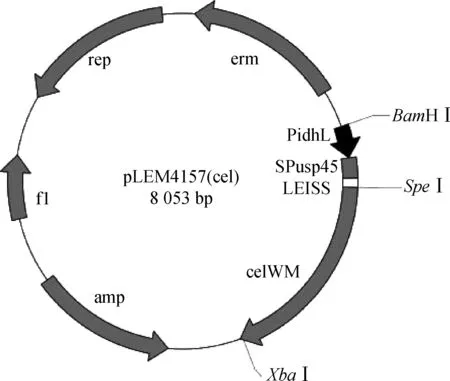
图2 pLEM4157(cel) 图谱Fig.2 pLEM4157(cel) map

M.DNA相对分子质量标准;1.Spe Ⅰ + Xba Ⅰ双酶切pLEM4157(cel) 质粒M.1 kb DNA ladder;1.pLEM4157(cel) digested by Spe Ⅰ + Xba Ⅰ图3 pLEM4157(cel) 双酶切鉴定Fig.3 Restriction enzyme analysis of pLEM4157(cel)
2.3 pLEM4157(cel) 在罗伊乳酸杆菌中的分泌表达及CMC-Na平板检测
如图 4所示,L.reuteripLEM4157(cel) 培养液经超滤管浓缩后,SDS-PAGE(泳道3)和 Native-PAGE(泳道4)凝胶电泳检测发现,在 50 ku 附近呈现特异性条带,与理论计算大小相符(目的片段大小约为 52.228 ku),判断该条带为重组蛋白产物带。 CMC-Na平板活性检测(图5)表明,L.reuteripLEM4157(cel) 重组菌胞外上清和胞内上清均具有内切葡聚糖酶活性,进一步说明内切葡聚糖酶在L.reuteripLEM4157(cel) 中被分泌到胞外,并具有一定的活性。
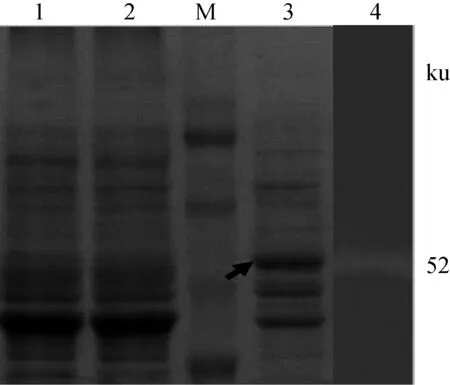
M.蛋白质相对分子质量标准;1.L.reuteri XC1 培养液上清蛋白SDS-PAGE;2.L.reuteri pLEM4155 培养液上清蛋白SDS-PAGE;3.L.reuteri pLEM4157(cel) 培养液上清蛋白SDS-PAGE;4.L.reuteri pLEM4157(cel) 培养液上清蛋白Native-PAGEM.14-120 ku Blue PlusTM Ⅱ Protein Marker;1.SDS-PAGE analysis of the culture supernatant proteins of L.reuteri XC1;2.SDS-PAGE analysis of the culture supernatant proteins of L.reuteri pLEM4155;3.SDS-PAGE analysis of the culture supernatant proteins of L.reuteri pLEM4157(cel);4.Native-PAGE analysis of the culture supernatant proteins of L.reuteri pLEM4157(cel)图4 L.reuteri XC1转化子培养液上清蛋白PAGE分析Fig.4 The culture supernatant proteins of L.reuteri XC1 transformants analyzed by PAGE
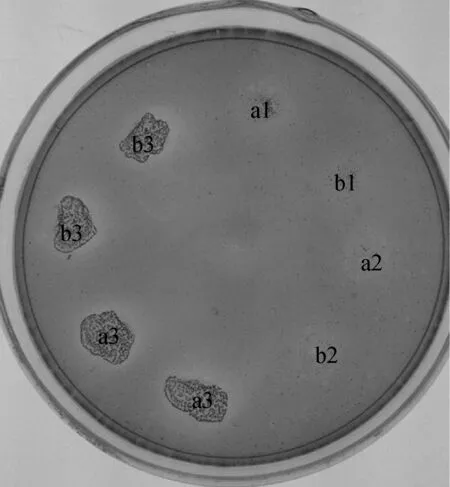
a.培养液上清;b.菌体破碎后胞内上清。1.L.reuteri XC1菌株;2.L.reuteri pLEM4155菌株;3.L.reuteri pLEM4157(cel) 菌株a.Culture supernatant;b.Cell supernatant after sonication.1.L.reuteri XC1;2.L.reuteri pLEM4155;3.L.reuteri pLEM4157(cel)图5 L.reuteri XC1转化子培养液上清蛋白及胞内上清蛋白内切葡聚糖酶活性平板检测Fig.5 Plate test for endoglucanase activity of L.reuteri XC1 transformants
2.4L.reuteripLEM4157(cel) 内切葡聚糖酶活性测定
如表2所示,L.reuteripLEM4157(cel) 培养上清和胞内上清内切葡聚糖酶活性分别为(0.96±0.08 )和(0.37±0.09) U·mL-1。培养液上清酶活性是胞内上清的2.5倍,占总酶活的72%。
2.5 转基因罗伊乳酸杆菌对肉鸡生产性能的影响
转基因乳酸杆菌对肉鸡采食量、日增重和饲料转化率的影响如表 3 所示。结果表明,与基础日粮组和L.reuteripLEM4155组相比,L.reuteripLEM4157(cel) 组对育雏饲养期(1~21 d)和育成饲养期(21~42 d)肉仔鸡日增重、日采食量和饲料转化率的影响差异均不显著(P>0.05),但育成饲养期(21~42 d)和整个饲养期(1~42 d)肉仔鸡日采食量有轻微下降的趋势。
表2L.reuteripLEM4157(cel) 内切葡聚糖酶活性测定
Table 2 The endoglucanase activity ofL.reuteripLEM4157(cel)

U·mL-1
表3 转基因罗伊乳酸杆菌对肉鸡生产性能的影响
Table 3 Effects of transformedL.reuteristrain supplementation on growth performance of broilers

组别Group基础日粮组BasaldietgroupL.reuteripLEM4155L.reuteripLEM4157(cel)1~21d日增重/(g·d-1)BWG28.14±1.2127.83±1.1927.57±0.42日采食量/(g·d-1)Feedintake39.73±1.7239.26±1.6839.33±1.03饲料转化率FCR1.41±0.051.41±0.021.43±0.0422~42d日增重/(g·d-1)BWG62.21±4.7861.46±8.7959.22±3.23日采食量/(g·d-1)Feedintake115.77±8.11117.47±7.98111.50±3.95饲料转化率FCR1.86±0.041.93±0.201.89±0.081~42d日增重/(g·d-1)BWG45.31±2.3944.74±4.4443.48±1.50日采食量/(g·d-1)Feedintake77.75±4.3378.37±4.2575.42±1.99饲料转化率FCR1.72±0.021.76±0.101.74±0.06
2.6 转基因罗伊乳酸杆菌对肉仔鸡肠道pH的影响
如图6A所示,21日龄时,L.reuteripLEM4155和L.reuteripLEM4157(cel) 组肉仔鸡十二指肠和空肠pH显著低于基础日粮组(P<0.05),而各处理组间肉仔鸡回肠pH差异不显著(P>0.05);如图6B所示,42日龄时,各处理组肉仔鸡十二直肠、空肠、回肠 pH 差异均不显著(P>0.05),说明重组乳酸杆菌的饲喂对肉仔鸡后期肠道 pH 的影响不明显。
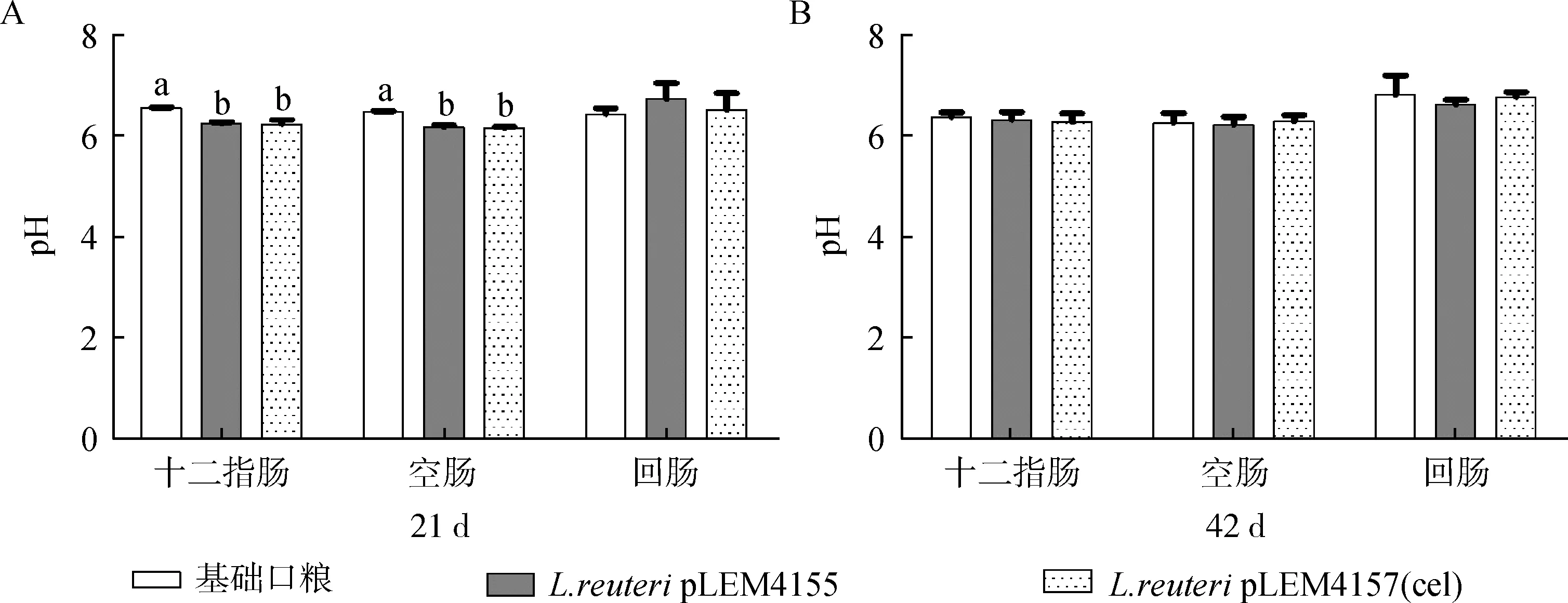
a,b.柱子上标字母不同表示差异显著(P<0.05)a,b.The different letters mean significant difference(P<0.05)图6 转基因罗伊乳酸杆菌对肉仔鸡肠道pH的影响Fig.6 Effects of transformed L.reuteri strain supplementation on intestinal tract pH of broilers
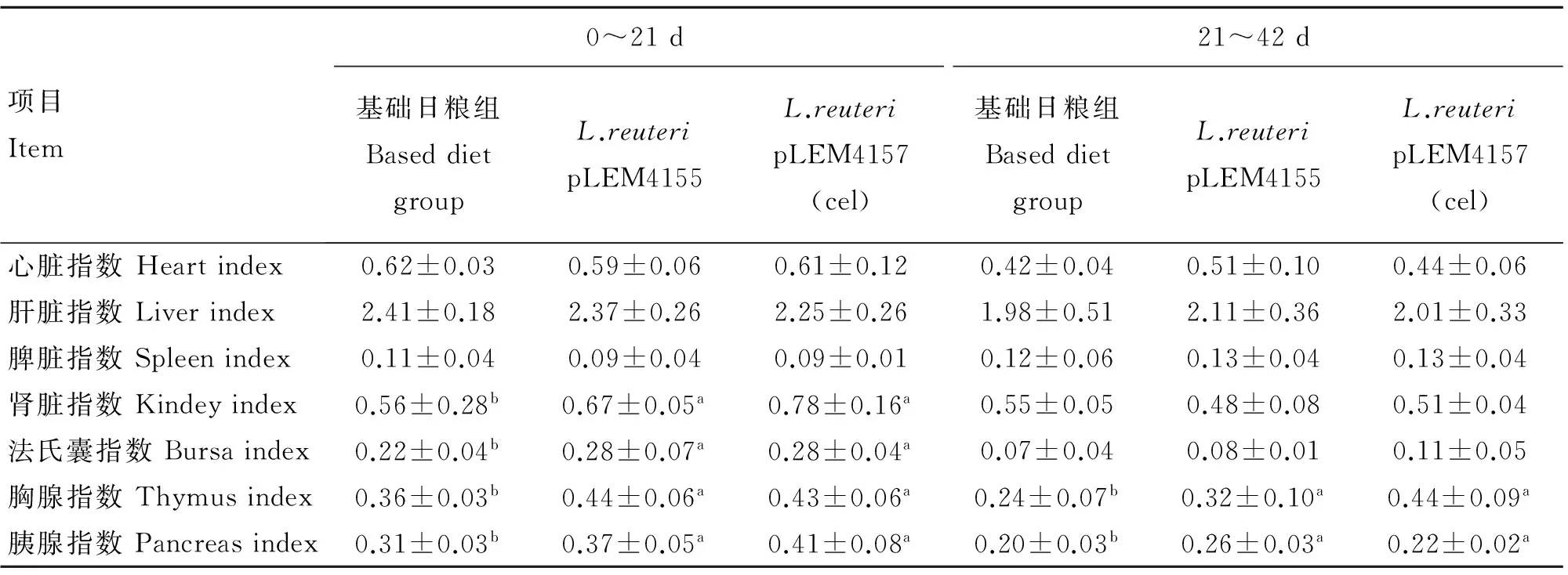
2.7 转基因罗伊乳酸杆菌对肉仔鸡内脏和免疫器官的影响
如表4所示,L.reuteripLEM4155和L.reuteripLEM4157(cel) 组肉仔鸡21 d的肾脏指数、法氏囊指数、胸腺指数和胰腺指数均显著高于基础日粮组(P<0.05),其他各指数差异不显著(P>0.05);L.reuteripLEM4155和L.reuteripLEM4157(cel) 组肉仔鸡42 d的胸腺指数和胰腺指数均显著高于基础日粮组(P<0.05),内脏器官指数差异不显著(P>0.05)。结果表明,乳酸杆菌对鸡胸腺、胰腺、法氏囊的发育均有促进作用,对内脏器官的发育没有影响。
表4 转基因罗伊乳酸杆菌对肉仔鸡内脏和免疫器官的影响
Table 4 Effects of transformedL.reuteristrain supplementation on viscera and immune organof broilers
项目Item0~21d21~42d基础日粮组BaseddietgroupL.reuteripLEM4155L.reuteripLEM4157(cel)基础日粮组BaseddietgroupL.reuteripLEM4155L.reuteripLEM4157(cel)心脏指数Heartindex0.62±0.030.59±0.060.61±0.120.42±0.040.51±0.100.44±0.06肝脏指数Liverindex2.41±0.182.37±0.262.25±0.261.98±0.512.11±0.362.01±0.33脾脏指数Spleenindex0.11±0.040.09±0.040.09±0.010.12±0.060.13±0.040.13±0.04肾脏指数Kindeyindex0.56±0.28b0.67±0.05a0.78±0.16a0.55±0.050.48±0.080.51±0.04法氏囊指数Bursaindex0.22±0.04b0.28±0.07a0.28±0.04a0.07±0.040.08±0.010.11±0.05胸腺指数Thymusindex0.36±0.03b0.44±0.06a0.43±0.06a0.24±0.07b0.32±0.10a0.44±0.09a胰腺指数Pancreasindex0.31±0.03b0.37±0.05a0.41±0.08a0.20±0.03b0.26±0.03a0.22±0.02a
a,b.同行肩标字母不同表示差异显著(P<0.05)。下表同
a,b.Means within the same row with different superscript letters are significantly different(P<0.05).The same as below
2.8 转基因罗伊乳酸杆菌对肉仔鸡血清生理生化指标的影响
如表5所示,L.reuteripLEM4155、L.reuteripLEM4157(cel) 组肉仔鸡21 d血清白球比、钙、磷含量显著高于基础日粮组(P<0.05),L.reuteripLEM4157(cel) 组肉仔鸡21 d血清葡萄糖含量显著高于基础日粮组和L.reuteripLEM4155组(P<0.05),其他各指标差异不显著(P>0.05);L.reuteripLEM4157(cel) 组肉仔鸡 42 d血清葡萄糖显著高于基础日粮组和L.reuteripLEM4155 组(P<0.05),其他各指标差异不显著(P>0.05)。结果表明,乳酸杆菌可增加肉仔鸡血清中总蛋白、白蛋白、球蛋白的含量,降低血清中尿酸的含量;转基因乳酸杆菌可增加肉鸡血清中葡萄糖的含量,说明分泌的内切葡聚糖酶在鸡肠道中发挥了一定的作用。
表5 转基因罗伊乳酸杆菌对肉仔鸡血清生理生化指标的影响
Table 5 Effects of transformedL.reuteristrain supplementation on serum physiological and biochemical index of broilers

项目Item0~21d21~42d基础日粮组BaseddietgroupL.reuteripLEM4155L.reuteripLEM4157(cel)基础日粮组BaseddietgroupL.reuteripLEM4155L.reuteripLEM4157(cel)总蛋白/(g·L-1)TP22.60±4.9922.65±4.4225.70±5.1827.70±3.7030.28±4.0730.49±8.15白蛋白/(g·L-1)ALB10.58±2.1411.82±2.5613.25±2.9012.53±1.3113.58±2.8711.35±2.47球蛋白/(g·L-1)GLO12.03±2.9410.83±1.8812.45±2.4815.18±2.4116.70±1.6219.13±6.95白球比A/G0.89±0.08b1.08±0.07a1.07±0.12a0.83±0.050.81±0.140.81±0.14尿素/(mmol·L-1)BUN0.35±0.110.36±0.150.37±0.090.35±0.120.34±0.120.33±0.03钙/(mmol·L-1)Ca1.59±0.21b1.84±0.33a2.05±0.39a2.41±0.402.70±0.372.57±0.05磷/(mmol·L-1)P1.74±0.10b2.10±0.36a2.09±0.28a2.33±0.152.57±0.332.34±0.46葡萄糖/(mmol·L-1)GLU10.98±1.54b9.55±1.49b13.95±1.68a7.77±2.09b9.73±2.61b11.17±1.85a总胆固醇/(mmol·L-1)T-chol2.89±0.673.13±0.573.48±0.673.44±0.363.75±0.843.11±0.67甘油三酯/(mmol·L-1)TG0.45±0.060.38±0.090.49±0.150.47±0.050.56±0.150.47±0.15尿酸/(mmol·L-1)UA0.26±0.150.28±0.100.22±0.060.24±0.070.22±0.080.20±0.04
3 讨 论
乳酸菌(LAB)是一类低GC含量的革兰阳性细菌,主要的代谢产物是乳酸,被美国FDA和欧洲食品安全权威机构认定为GRAS(Generally recognized as safe)级微生物,因此早期被广泛地应用于发酵食品(如牛奶、蔬菜和肉类)的生产和保存。选择乳酸菌作为表达宿主菌是因为其具有益生作用,能通过改善人和动物菌群平衡而对机体产生有利的影响。乳酸菌是人和动物体内优势的益生菌之一,具有多种生理功能,如控制肠道感染,增加某些食物的营养价值,控制血清胆固醇水平,改善乳糖代谢,诱导体内特异性及非特异性免疫应答以及抗肿瘤活性等功能[17-18],广泛地被作为宿主或载体定向表达和递送外源蛋白到动物肠道内。而外源基因能否在乳酸杆菌中高效地分泌表达,选择合适有效的启动子和信号肽是关键[19]。所以,本研究选用了已报道启动子中效率较高的乳酸脱氢酶启动子和应用较广泛的Usp45基因信号肽,并引入了增强子,实现了内切葡聚糖酶基因在乳酸杆菌中的分泌表达,并具有一定的水解活性。
本研究中,在大麦-小麦型基础日粮中添加转基因罗伊乳酸杆菌对肉仔鸡日增重、日采食量、饲料转化率无显著影响。B.Yu 等研究表明,在大麦型基础日粮中添加转 β-葡聚糖酶基因,L.reuteriPg4 能显著提高0~37 日龄肉仔鸡平均日增重,但对采食量和饲料转化率无显著影响[20]。J.R.Liu 等研究发现,在小麦型基础日粮中添加转木聚糖酶基因L.reuteriPg4 仅能显著提高0~21日龄肉仔鸡体增重,但对21~42日龄体增重、整个饲养期采食量和饲料转化率无显著影响[21]。L.Z.Jin 等在肉仔鸡日粮中添加L.acidophilusI-26 或 12 种乳酸杆菌的混合培养物可提高0~6周龄肉仔鸡体增重和饲料转化率[22]。然而,B.A.Watkins等报道,添加Lactobacillusspp.培养物对肉仔鸡的生产性能无明显的改善作用[23]。综上所述,菌株、饲喂剂量、制备方法和饲喂方式、肉仔鸡健康状态和饲养周期不同,其产生的饲喂效果也不尽相同[20]。
胸腺、法氏囊和脾是鸡重要的免疫器官,其中脾是机体最重要的外周免疫器官,胸腺是鸡的中枢内分泌器官和淋巴器官,法氏囊是鸡的中枢免疫器官,免疫器官相对重量增加,可以在一定程度上反映机体免疫功能的增强[24]。张春杨等研究表明,肉鸡饲喂分泌蛋白酶的乳酸菌,能明显促进免疫器官的生长发育,增加免疫器官指数[25]。相似的结果已在鸡、小鼠、猪、家兔等动物中有大量报道[26-30],本研究中,L.reuteripLEM4155和L.reuteripLEM4157(cel) 可显著提高肉仔鸡21 d的肾脏指数、法氏囊指数、胸腺指数和胰腺指数,42 d的胸腺指数和胰腺指数。研究表明,益生菌可通过调整动物肠道微生物菌群,使肠道微生态系统处于最佳的平衡状态,或通过特异性结合肠道抗原识别部位,活化肠黏膜内的相关淋巴组织,诱导淋巴细胞和巨噬细胞产生细胞因子,从而增强动物机体非特异性和特异性免疫能力[31]。同时,在本研究中,L.reuteripLEM4155和L.reuteripLEM4157(cel) 可显著降低肉仔鸡十二指肠和空肠 pH,说明益生乳酸杆菌可通过产生大量的乳酸和乙酸降低肠道pH或与致病菌竞争肠上皮细胞黏附位点,来抑制致病菌的生长,从而增强机体的免疫力。
血液生化指标可以反映机体各组织器官的功能和机体营养代谢情况。血清总蛋白含量高低反映蛋白质代谢水平和机体对蛋白质的吸收利用程度;白蛋白可维持血浆胶体渗透压恒定和营养供给,促进肝细胞的修复、再生、运输和解毒[32]。在本研究中,乳酸杆菌可增加肉仔鸡血清中总蛋白、白蛋白、球蛋白的含量,降低血清中尿酸的含量;转基因乳酸杆菌可增加肉鸡血清中葡萄糖的含量,说明乳酸菌在促进生长时,能够促进蛋白质的吸收和转化,免疫机能增强,促进成骨生成,同时由于血糖(即血清中葡萄糖)主要来源于肠道吸收和肝糖原分解,其进入血液循环后被运送到各组织细胞供全身利用,说明转基因乳酸杆菌分泌的内切葡聚糖酶在肉仔鸡肠道内促进了非淀粉多糖物质的降解和碳源的消化吸收。
4 结 论
本研究成功构建了可胞外分泌内切葡聚糖酶,具有降解β-葡聚糖能力的转内切葡聚糖酶基因的罗伊乳酸杆菌,肉鸡饲喂效果表明,其对肉仔鸡生长性能无显著影响,但可显著降低21日龄肉仔鸡十二指肠和空肠pH,促进21日龄肉仔鸡肾、法氏囊、胸腺和胰腺的生长发育,增加42 日龄肉仔鸡的胸腺指数和胰腺指数,提高肉仔鸡21 日龄血清白球比、钙、磷含量和42 日龄血清葡萄糖含量。
[1] ORLANDO A,MESSA C,LINSALATA M,et al.Effects ofLactobacillusrhamnosusGG on proliferation and polyamine metabolism in HGC-27 human gastric and DLD-1 colonic cancer cell lines[J].ImmunopharmacolImmunotoxicol,2009,31(1):108-116.
[2] AMIT-ROMACH E,SKLAN D,UNI Z.Microflora ecology of the chicken intestine using 16S ribosomal DNA primers[J].PoultSci,2004,83(7):1093-1098.
[3] DUMONCEAUX T J,HILL J E,HEMMINGSEN S M,et al.Characterization of intestinal microbiota and response to dietary virginiamycin supplementation in the broiler chicken[J].ApplEnvMicrobiol,2006,72(4):2815-2823.
[4] EHRMANN M A,KURZAK P,BAUER J,et al.Characterization of lactobacilli towards their use as probiotic adjuncts in poultry[J].JApplMicrobiol,2002,92(5):966-975.
[5] BOTES M,LOOS B,VAN REENEN C A,et al.Adhesion of the probiotic strainsEnterococcusmundtiiST4SA andLactobacillusplantarum423 to Caco-2 cells under conditions simulating the intestinal tract,and in the presence of antibiotics and anti-inflammatory medicaments[J].ArchMicrobiol,2008,190(5):573-584.
[6] BATEUP J M,MCCONNELL M A,JENKINSON H F,et al.Comparison ofLactobacillusstrains with respect to bile salt hydrolase activity,colonization of the gastrointestinal tract,and growth rate of the murine host[J].ApplEnvMicrobiol,1995,61(3):1147-1149.[7] ZUO R,CHANG J,YIN Q,et al.Phytase gene expression inLactobacillusand analysis of its biochemical characteristics[J].MicrobiolRes,2010,165(4):329-335.
[8] ZEGERS N D,KLUTER E,VAN DER STAP H,et al.Expression of the protective antigen ofBacillusanthracisbyLactobacilluscasei:towards the development of an oral vaccine against anthrax[J].JApplMicrobiol,1999,87(2):309-314.
[9] LIU J R,YU B,LIU F H,et al.Expression of rumen microbial fibrolytic enzyme genes in probioticLactobacillusreuteri[J].ApplEnvMicrobiol,2005,71(11):6769-6775.
[10] BEDFORD M R,SCHULZE H.Exogenous enzymes for pigs and poultry[J].NutrResRev,1998,11(1):91-114.
[11] MATHLOUTHI N,MOHAMED M A,LARBIER M.Effect of enzyme preparation containing xylanase and β-glucanase on performance of laying hens fed wheat/barley-or maize/soybean meal-based diets[J].BrPoultSci,2003,44(1):60-66.
[12] MATHLOUTHI N,JUIN H,LARBIER M.Effect of xylanase and β-glucanase supplementation of wheat-or wheat-and barley-based diets on the performance of male turkeys[J].BrPoultSci,2003,44(2):291-298.
[13] LIU J R,YU B,ZHAO X,CHENG K J.Coexpression of rumen microbial β-glucanase and xylanase genes inLactobacillusreuteri[J].ApplMicrobiolBiotechnol,2007,77(1):117-124.
[14] SCHULEIN M.Protein engineering of cellulases[J].BiochimBiophysActa-ProteinStructureMolEnzymol,2000,1543(2):39-52.
[15] CHO J S,CHOI Y J,CHUNG D K.Expression of Clostridium thermocellum endoglucanase gene inLactobacillusgasseriandLactobacillusjohnsoniiand characterization of the genetically modified probiotic Lactobacilli[J].CurrentMicrobiol,2000,40(4):257-263.
[16] MAPPLEY L J,TCHORZEWSKA M A,NUNEZ A,et al.Oral treatment of chickens withLactobacillusreuteriLM1 reduces Brachyspira pilosicoli-induced pathology[J].JMedMicrobiol, 2013,62(pt2):287-296.[17] PATTERSON J A,BURKHOLDER K M.Application of probiotics and probiotics in poultry production[J].PoultSci,2003,82(4):627-631.
[18] REID G,FRIENDSHIP R.Alternatives to antibiotic use;probiotics for the gut[J].AnimBiotechnol,2002,13(1):97-112.
[19] STEPHENSON D P,MOORE R J,ALLISON G E.Transformation of,and heterologous protein expression in,LactobacillusagilisandLactobacillusvaginalisisolates from the chicken gastrointestinal tract[J].ApplEnvMicrobiol,2011,77(1):220-228.
[20] YU B,LIU J R,HSIAO F S,et al.Evaluation ofLactobacillusreuteriPg4 strain expressing heterologous β-glucanase as a probiotic in poultry diets based on barley[J].AnimFeedSciTechnol,2008,141(1-2):82-91.
[21] LIU J R,LAI S F,YU B.Evaluation of an intestinalLactobacillusreuteristrain expressing rumen fungal xylanase as a probiotic for broiler chickens fed on a wheat-based diet[J].BrPoultSci,2007,48(4):507-514.[22] JIN L Z,HO Y W,ABDULLAH N,et al.Growth performance,intestinal microbial populations,and serum cholesterol of broilers fed diets containingLactobacilluscultures[J].PoultSci,1998,77(9):1259-1265.[23] WATKINS B A,MILLER B F.Competitive gut exclusion of avian pathogens byLactobacillusacidophilusin gnotobiotic chicks[J].PoultSci,1983,62(9):1772-1779.
[24] 程相朝,张春杰.中药免疫增强剂对肉仔鸡免疫器官生长发育及免疫活性细胞影响的研究[J].中兽医学杂志,2002,(3):6-8. CHENG X C,ZHANG C J.The effect of Chinese traditional immunopoteniators on growth and development of immune organ and immunocompetence cells in broilers[J].ChineseJournalofTraditionalVeteriuaryScience,2002,(3):6-8.(in Chinese)
[25] 张春杨,牛钟相,常维山,等.益生菌剂对肉用仔鸡的营养、免疫促进作用[J].中国预防兽医学报,2002,24(1):51-54. ZHANG C Y,NIU Z X,CHANG W S,et al.The promoting effects of probiotics to the nutrition and immunity of broilers[J].ChineseJournalofPreventiveVeterinaryMedicine,2002,24(1):51-54.(in Chinese)[26] 唐志刚,王俊峰,温 超,等.益生菌对肉鸡生产性能、免疫器官指数和血清指标的影响[J].江苏农业科学,2010,(4):208-210. TANG Z G,WANG J F,WEN C,et al.The effect of probiotics on growth performance,immune organ index and serum indicator in broilers[J].JiangsuAgriculturalScience,2010,(4):208-210.(in Chinese)
[27] DE FAZIO A,CHIEW Y E,DONOGHUE C,et al.Effect of sodium butyrate on estrogen receptor and epidermal growth factor receptor gene expression in human breast cancer cell lines[J].JBiolChem, 1992,267(25):18008-18012.
[28] HIROMI K,MASAHIRO S,HAJIME N,et al.Effect of antioxidative lactic acid bacteria on rats fed a diet deficient in vitamin E[J].JDairySci, 1993,76(9):2493-2499.
[29] GILL H S,RUTHERFURD K J.Viability and dose-response studies on the effects of the immunoenhancing lactic acid bacteriumLactobacillusrhamnosusin mice[J].BrJNutr,2001,86(2):285-289.
[30] 潘康成,何明清,刘克琳.地衣芽抱杆菌对家兔细胞免疫功能的影响[J].四川农业大学学报,1997,15(3):368-371. PAI K C,HE M Q,LIU K L.Study of the effect ofBacilluslicheniformisto cell-mediated immunity of rabbits[J].JournalofSichuanAgriculturalUniversity,1997,15(3):368-371.(in Chinese)
[31] YASUI H,NAGAOKA N,HAYAKAWA K.Augmentation of anti-influenza virus hemagglutinin antibody production by Peyer’s patch cells with Bifidobacterium breve VIT4064[J].ClinDiagnostLabImmunol,1994,1(2):244-246.
[32] 刘晓琳,郭世宁,石达友,等.复方紫锥菊对肉鸡部分血液生化指标的影响[J].中国兽医杂志,2008,(4):30-31. LIU X L,GUO S N,SHI D Y,et al.The effect of compoundEchinaceapurpureaon partial blood biochemical indicator in broilers[J].ChineseJournalofVeterinary,2008,(4):30-31.(in Chinese)
(编辑 郭云雁)
Construction of TransgenicLactobacillusreuteriwith Endoglucanase and Evaluation of Its Feeding Effectiveness on Broilers
WANG Lei1,2,CAO Ping-hua1,3,CAI Bei1,GAO Yin1,GAO Kang1,YANG Yu-xin1,YANG Ming-ming1,YUAN Chao4,CHEN Yu-lin1*
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China;2.QinghaiAcademyofAnimalScienceandVeterinaryMedicine,QinghaiUniversity,Xining810016,China;3.CollegeofAnimalScienceandTechnology,HenanUniversityofScienceandTechnology,Luoyang471003,China;4.LanzhouInstituteofHusbandryandPharmaceuticalSciences,ChineseAcademyofAgriculturalSciences,Lanzhou730050,China)
The objective of the study was to construct the transgenicLactobacillusreuteriwith the ability of exocellular secreting endoglucanase and hydrolyzing β-glucan and evaluate its feeding effect on broilers,which would establish the foundation for application of the transgenicL.reuteriin animal production.pLEM4157(cel) vector was constructed by PCR and restriction enzyme,then transformed into competent cells ofL.reuteriXC1 for SDS-PAGE analysis,determination of endoglucanase activity and evaluation of feeding effect on broilers.The results of PCR amplification and sequence blast showed that endoglucanase genecelWwas about 1 500 bp,the similarity of gene and amino acid sequence were 99% and 100%,respectively.Native-PAGE amd SDS-PAGE analysis showed that the molecular mass ofcelWgene mature peptide was approximately 52 ku,which was consistent to the predicted molecular weight.The endoglucanase activity in the extracellular and intracellular fraction in the transformedL.reutericulture were(0.96±0.08) and(0.37±0.09) U·mL-1,respectively.L.reuteripLEM4157(cel) had not significant effect on growth performance of broilers,but could decrease pH in duodenum and jejunum at 21 d,promote the growth development of kidney,cloacal bursa,thymus and pancreatic at 21 d,increase the thymus and pancreatic index at 42 d,improve the A/G and the content of Ca and P at 21 d,and the content of glucose at 42 d.L.reuteripLEM4157(cel) successfully secreted and expressed endoglucanase,displayed the ability to hydrolyze carboxymethyl cellulose and feeding effect on broier.
transgenes;endoglucanase gene;Lactobacillusreuteri;feeding effect;broilers
10.11843/j.issn.0366-6964.2015.05.013
2014-07-16
国家自然科学基金资助项目(cyh200803);国家公益性行业(农业)专项(20090300606)
王 磊(1983-),男,甘肃永昌人,博士生,主要从事动物分子营养研究,E-mail:277036818@qq.com
*通信作者:陈玉林,教授,博士生导师,主要从事动物遗传资源研究、动物饲料资源与开发利用方面的研究,E-mail:chenyulindk@163.com
S831;S815.5
A
0366-6964(2015)05-0774-10
