绵羊Otx-2基因的分子克隆、组织表达及其与季节性繁殖关系的研究
2015-03-22郭若婷鲁慧文欧科鹏顾真真刘小军
郭若婷,鲁慧文,欧科鹏,王 颖,刘 乙,顾真真,刘小军
(1.石河子大学动物科技学院,石河子 832003;2.新疆天康畜牧科技有限公司,昌吉 831100;3.河南农业大学牧医工程学院,郑州 450002)
绵羊Otx-2基因的分子克隆、组织表达及其与季节性繁殖关系的研究
郭若婷1,鲁慧文2,欧科鹏1,王 颖1,刘 乙1,顾真真1,刘小军3*
(1.石河子大学动物科技学院,石河子 832003;2.新疆天康畜牧科技有限公司,昌吉 831100;3.河南农业大学牧医工程学院,郑州 450002)
旨在研究绵羊Otx-2基因与绵羊繁殖的关系,从阿勒泰绵羊下丘脑组织中克隆Otx-2及MT1、KISS-1、GnRH基因CDs(Coding region)区部分序列,采用RT-PCR分析了这些基因在心、肝、脾、肺、肾、大肠、小肠、胃、大脑、小脑、子宫、垂体、松果体、下丘脑和甲状腺组织中的表达差异;进一步用实时荧光定量PCR方法分析繁殖期和繁殖间期绵羊下丘脑中这些基因在日间和夜间表达的变化规律。结果表明,Otx-2和KISS-1、MT1基因在各组织中均有不同程度的表达,其中Otx-2和KISS-1在下丘脑中的表达量较高。Otx-2基因与KISS-1和GnRH基因在繁殖期的表达量均高于繁殖间期的表达量,且均表现出夜间的表达量极显著高于日间表达量的相似表达规律,综上表明,Otx-2基因可能参与绵羊的季节性繁殖调控。
Otx-2基因;下丘脑;季节性繁殖;绵羊
动物的繁殖活动受下丘脑-垂体-性腺轴(Hypothalamic-pituitary-gonadal axis,HPGA)系统的调控[1]。下丘脑GnRH神经元合成分泌的促性腺激素释放激素(Gonadotrophin-releasing hormone,GnRH)是引起动物发情排卵的关键激素。2003年,两项独立的研究证实KISS-1基因及其产物Kisspeptin对动物的生殖活动具有重要的调控作用[2-3]。经Kisspeptin处理的成年动物可观察到GnRH分泌增加[4-5],而GnRH拮抗物acyline可阻断大鼠、小鼠和灵长类动物Kisspeptin激发促性腺激素的释放[6],可见Kisspeptin促进促性腺激素的分泌是通过下丘脑通路激活GnRH神经元实现的。此外,体外研究也表明,Kisspeptin可诱导体外培养大鼠下丘脑组织中GnRH的释放[7]。在GnRH分泌神经元细胞系(GT1-7和GN11)中,GnRH分泌和GnRHmRNA水平随着Kisspeptin处理以剂量和时间依赖的方式增加[8]。进一步的研究显示,KISS-1基因的表达受到褪黑激素(Melatonin,MT)介导的光周期调控,而褪黑激素的昼夜节律效应由下丘脑视交叉上核(Suprtchiasmtic nucleus,SCN)的褪黑激素受体来完成,其繁殖效应由垂体结节部(Parstuberalis,PT)的褪黑激素受体来完成[9]。哺乳动物褪黑激素受体分两个亚型,即MT1(Melatonin receptor 1A,MTNR1A又简称MT1)与MT2(Melatonin receptor 1B,MTNR1B又简称MT2)。哺乳动物褪黑激素主要通过MT1的介导发挥作用,MT2可能由于其基因编码区无义突变导致蛋白功能丧失。褪黑激素受体和KISS-1基因共同表达于下丘脑基底部[10],把母绵羊从长日照转换到短日照时,其下丘脑视前区和弓状核尾部Kisspeptin表达量均增加,从而导致GnRH释放,绵羊进入繁殖期[11]。
GnRH分泌细胞系和转基因小鼠的研究发现,小鼠GnRH基因启动子区存在有Kisspeptin作用的顺式反应元件(Kisspeptin-response element,KsRE),而且具有1个潜在的转录因子Otx-2(Orthodenticle homeobox-2,Otx-2)的结合位点。Kisspeptin处理,使Otx-2 mRNA和蛋白水平都升高,并使结合于KsRE的Otx-2增加[12]。
Otx-2基因属于同源性脊椎动物中的果蝇正小齿基因[13];这个直系同源组的成员在感光细胞和延髓脑区的发育中发挥重要作用[14]。Otx-2基因编码转录因子,可激活GnRH基因启动子[15-16]。人、小鼠、山羊、绵羊Otx-2基因的CDs序列已被克隆。绵羊Otx-2基因位于绵羊第7号染色体,其结构包含两个外显子和1个内含子,编码275个氨基酸。基因序列的比较分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi)表明,绵羊Otx-2基因核苷酸序列与人、小鼠、山羊的一致性分别为88.93 %、88.55 %和89.90 %。迄今为止,Otx-2基因在绵羊各组织中的表达水平尚不清楚,在绵羊繁殖调控中的作用也未见报道。本研究的目的首先是检测绵羊Otx-2基因在各组织中的表达情况进行分析,以确定Otx-2基因在绵羊下丘脑有较高水平的表达,进而分析绵羊下丘脑中Otx-2基因及其与繁殖季节性相关的基因MT1、KISS-1、GnRH在繁殖期与繁殖间期的表达规律,从而探讨绵羊Otx-2基因与绵羊繁殖调控的关系,为揭示绵羊季节性发情的分子机制提供理论基础。
1 材料和方法
1.1 材料
1.1.1 样本采集 试验绵羊选取符合品种特征的同龄阿勒泰成年母羊29只,同条件饲养。繁殖间期(6月份)母羊13只,在日间(10:00-16:00)屠宰5只、夜间(22:00-次日5:00)屠宰8只;繁殖期(同年11月份)母羊16只,在日间(10:00-16:00)屠宰6只、夜间(22:00-次日5:00)屠宰10只,采集下丘脑组织。采集繁殖间期日间包括心、肝、脾、肺、肾、大肠、小肠、胃、大脑、小脑、子宫、垂体、松果体、下丘脑和甲状腺组织,锡纸包裹液氮保存。
1.1.2 主要试剂 琼脂糖、氨苄青霉素(AMP)、琼脂糖凝胶DNA回收试剂盒、pGM-T克隆试剂盒均购自北京天根生物科技有限公司;2×EasyTaq PCR SuperMix、MarkerⅠ购自北京康为生物科技有限公司;RNA提取试剂Trizol购自美国Invitrogen公司;Primescript RT reagent Kit with gDNA Erase试剂盒购自大连TaKaRa公司;QuantiFast SYBR Green PCR Kit试剂盒购自美国QIAGEN公司;胰蛋白胨、酵母提取物和琼脂粉购自OXOID;IPTG、X-gal购自Promega公司。
1.2 方法
1.2.1 总RNA 的提取与反转录 分别取各组织样100 mg于液氮中研磨,用Trizol法提取总RNA,采用1 %的琼脂糖凝胶电泳验证RNA的完整性,用Nano 2000测定总RNA浓度,-80 ℃保存备用。RNA反转录按照PrimeScript RT reagent Kit with gDNA Eraser(perfect Real Time) 试剂盒说明书进行操作,反转录获得的cDNA置于-20 ℃保存,用于后续试验。
1.2.2 引物设计 根据NCBI上已知的绵羊Otx-2(GenBank:XM_004011036.1)、MT1(GenBank:NM_001009725.1)、KISS-1(GenBank:XM_004013945.1)、GnRH(GenBank:XM_004004179.1)基因的核苷酸序列,用Primer premier 5.0 软件设计特异性引物(表1)用于RT-PCR和荧光实时定量PCR;β-actin基因引物根据NCBI上已知的β-actin(GenBank:NM_001009784.1)基因序列设计。引物均由深圳华大基因科技服务有限公司合成。
表1 PCR引物序列及扩增片段大小
Table 1 The primer sequences and product size for PCR

引物名称Primername引物序列(5'-3')Primersequence序列长度/bpSequencelength退火温度/℃Tmβ-actinF:AGAGCAAGAGAGGCATCCR:TCGTTGTAGAAGGTGTGGT10855MT1F:GTGGTGGTGTTCCATTTCATAGR:GCTTCAGTTTCGGTTTGTTGT12159KISS-1F:GCCTGATCCCGGCTCCGAR:CGTAGCGCAGGCCGAAGGAG9067Otx-2F:AAGTGCCGCCAACAR:GGGCTCCAGATAGACA18860GnRHF:TCCTGCTGACTTTCTGTGR:CTTAGGTTCTACTGGCTGAT14359
1.2.3Otx-2、MT1、KISS-1和GnRH基因部分CDs序列的克隆 取下丘脑组织总RNA反转录合成的cDNA产物1 μL作为模板,应用2×EasyTaq PCR SuperMix试剂盒进行PCR扩增,PCR反应体系均为25 μL:2×EasyTaq PCR SuperMix 12.5 μL,上下游引物各1.25 μL(10 μmol·L-1),cDNA 1.25 μL,补ddH2O至25 μL。PCR反应程序:94 ℃预变性2 min;94 ℃ 15 s,退火15 s,72 ℃ 15 s,共40个循环;72 ℃延伸 7 min。扩增产物经1.5 %琼脂糖凝胶电泳检测。
PCR产物回收纯化后,经T4连接酶连入pGM-T载体,转化DH5α感受态细胞后,37 ℃过夜培养,蓝白斑筛选阳性菌落,并扩大培养8 h,鉴定为单个阳性克隆,送交深圳华大基因科技服务有限公司测序。
1.2.4Otx-2、MT1、KISS-1和GnRH基因的组织表达谱分析 将各组织总RNA反转录合成的cDNA稀释成相同浓度为模板,以β-actin基因作对照,用半定量RT-PCR进行组织表达谱分析,PCR反应体系均为25 μL:2×EasyTaq PCR SuperMix 12.5 μL,上下游引物(表1)各1.25 μL(10 μmol·L-1),相同浓度的cDNA 1.25 μL,补ddH2O至25 μL。PCR反应条件:94 ℃预变性 2 min;94 ℃ 15 s,退火 15 s,72 ℃ 15 s,共40个循环;72 ℃延伸 7 min。每个PCR重复3次。扩增产物经1.5 %琼脂糖凝胶电泳检测。
1.2.5Otx-2、MT1、KISS-1和GnRH基因表达的定量分析 根据实时荧光定量PCR的方法,按照QuantiFast SYBR Green PCR Kit试剂盒的操作说明,以β-actin为内参,检测Otx-2、MT1、KISS-1和GnRH基因在阿勒泰绵羊繁殖期日间和夜间、繁殖间期日间和夜间下丘脑中的表达。每个样本设置3个重复。实时荧光定量PCR反应体系:2×QuantiFast SYBR Green PCR Master Mix 12.5 μL,上下游引物(表1)各2 μL,cDNA 0.5 μL,补ddH2O至25 μL。β-actin基因的反应体系:2×QuantiFast SYBR Green PCR Master Mix 12.5 μL,β-actin上下游引物各2 μL,cDNA 0.5 μL,补ddH2O至25 μL。PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s,退火 30 s,72 ℃ 30 s,共45个循环;72 ℃延伸 7 min。1.2.6 数据分析 根据熔解曲线来判断PCR反应的特异性,根据荧光定量PCR所给出的Ct值和标准曲线中的扩增效率计算出定量试验结果。所得结果采用MX3000P定量分析软件进行分析,目的基因和内参基因扩增效率接近,为100%±5%,相对定量的结果采用的2-ΔΔCt方法进行分析,首先计算出繁殖期、繁殖间期的日间、夜间的下丘脑同一样品3次重复的平均Ct值,然后计算出繁殖期、繁殖间期的日间、夜间的下丘脑目的基因与内参基因的Ct差值,以其中同一时间点的下丘脑为对照,分别计算出其他时间点下丘脑的相对表达量。采用SPSS17.0 软件的单因素方差分析,比较不同季节同一时段的下丘脑,以及不同时间段同一季节的下丘脑表达量的差异。P<0.05表明差异显著,P<0.01表明差异极显著。
2 结 果
2.1Otx-2、MT1、KISS-1和GnRH基因部分CDS序列克隆
以绵羊的下丘脑组织的总RNA反转录产物为模板,进行PCR扩增,获得长度分别为188、121、90和143 bp的Otx-2、MT1、KISS-1和GnRH的CDs序列。扩增片段经回收、克隆、测序后进行Blast比对,结果表明,PCR扩增产物均为特异性目的基因。
2.2Otx-2、MT1、KISS-1和GnRH基因的组织表达谱
Otx-2、MT1、KISS-1和GnRH基因的组织表达谱见图1。Otx-2、MT1和KISS-1基因在心、肝、脾、肺、肾、大肠、小肠、胃、大脑、小脑、子宫、垂体、松果体、下丘脑、甲状腺组织中均有不同程度的表达,尤其在子宫、松果体、下丘脑中表达较高。Otx-2基因在心、肾、小肠、小脑、子宫、松果体和下丘脑组织中表达较高;KISS-1基因在子宫、垂体、松果体和下丘脑中表达较高;MT1基因在心、肾、小肠、小脑和子宫中表达较高;GnRH基因在很多组织中均未检测到,但在垂体和下丘脑中有较高表达。
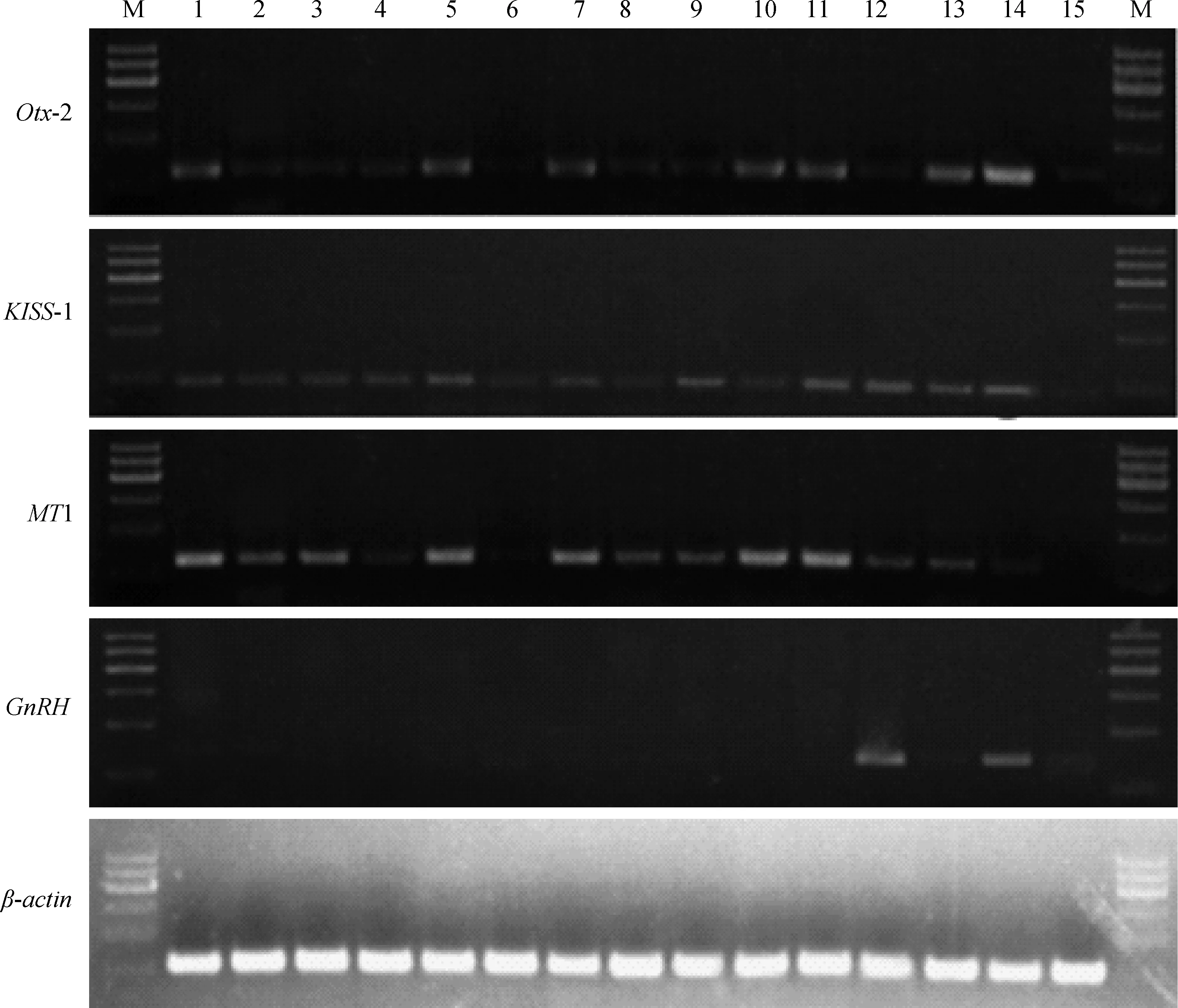
1.心;2.肝;3.脾;4.肺;5.肾;6.大肠;7.小肠;8.胃;9.大脑;10.小脑;11.子宫;12.垂体;13.松果体;14.下丘脑;15.甲状腺;M.MarkerⅠ1.Heart;2.Liver;3.Spleen;4.Lung;5.Kidney;6.Large intestine;7.Small inestine;8.Stomach;9.Brain;10.Epencephalon;11.Uterus;12.Hypophysis;13.Pineal body;14.Hypothalamus;15.Thyroid;M.MarkerⅠ图1 阿勒泰绵羊Otx-2、KISS-1、MT1、GnRH和β-actin基因半定量RT-PCR表达结果Fig.1 The expression of Otx-2,KISS-1,MT1,GnRH and β-actin genes in different tissues of Altay sheep
2.3 繁殖期和繁殖间期Otx-2、MT1、KISS-1和GnRH基因在日间、夜间下丘脑中的表达
2.3.1Otx-2、MT1、KISS-1和GnRH基因在下丘脑中的表达情况 繁殖期和繁殖间期Otx-2及MT1、KISS-1、GnRH基因在日间、夜间下丘脑中的表达情况见图2。Otx-2、MT1、KISS-1和GnRH基因在繁殖期和繁殖间期的日间、夜间的下丘脑都有不同程度的表达。
在繁殖期,Otx-2、KISS-1和GnRH基因夜间的相对表达量均极显著高于日间(P<0.01);而在繁殖间期,Otx-2和KISS-1基因的相对表达量均为夜间极显著高于日间(P<0.01),KISS-1基因的相对表达量夜间极显著高于日间(P<0.01),但GnRH基因日间与夜间的相对表达量无显著性差异(P>0.05)。日间,Otx-2、KISS-1和GnRH基因在繁殖期与繁殖间期的相对表达量无显著性差异;夜间,Otx-2、KISS-1和GnRH基因在繁殖期的相对表达量均极显著高于繁殖间期(P<0.01)。无论繁殖期和繁殖间期,MT1基因(图2C)日间的相对表达量均极显著高于夜间的相对表达量(P<0.01)。但在日间或夜间,繁殖期与繁殖间期的相对表达量均无显著性差异。

同一时段不同季节间大写字母不同表示差异极显著(P<0.01),小写字母不同表示差异显著(P<0.05);不同时段同一季节间**.差异极显著(P<0.01);*.差异显著(P<0.05)。A.Otx-2基因;B.KISS-1基因;C.MT1基因;D.GnRH基因In different seasons of same time,different uppercase and lowercase letters severally indicate extremely signicant difference(P<0.01) and difference(P<0.05);In same season of different time,** and *severally indicate extremely signicant difference(P<0.01) and difference(P<0.05).A.Otx-2;B.KISS-1;C.MT1;D.GnRH图2 阿勒泰绵羊Otx-2、MT1、KISS-1和GnRH基因在繁殖期和繁殖间期的下丘脑相对表达量Fig.2 The relative expression of Otx-2,MT1,KISS-1 and GnRH genes in breeding seasons and non-breeding seasons of Hypothalamus of Altay sheep
3 讨 论
下丘脑是动物繁殖的调控中心,因此,在证实KISS-1基因及其产物Kisspeptin对动物的生殖活动具有重要的调控作用后[2-3],人们首先对KISS-1基因在下丘脑中的表达规律进行了研究。运用RT-PCR和免疫组织化学等技术对多种动物的研究表明,KISS-1基因在下丘脑中表达,并且证实在啮齿类动物中,KISS-1基因主要在下丘脑前腹侧室周核(Anteroventral periventricularnucleus,AVPV)和弓状核(Arcuate nucleus,ARC)上表达[17-20],除下丘脑之外,在垂体和卵巢上也发现KISS-1基因表达[21-23],这些区域都是参与促性腺激素分泌调控的关键位点。对绵羊脑室内注射Kisspeptin导致GnRH大量释放入脑脊液中,同时血液促黄体素(Luteinizing hormone,LH)水平同步升高[24],对小鼠、大鼠、猴和猪等多种动物的研究表明,KISS-1基因在下丘脑的表达量于初情期明显增加,且体内注射Kisspeptin能促进LH的分泌[25-27],在小鼠和大鼠的婴儿期和幼年期,脑室内灌注或静脉注射Kisspeptin均能促进GnRH、促卵泡素(Follicle-stimulating hormone,FSH)和LH的分泌[28-29]。最近的研究发现,在苏淮山羊的KISS-1基因的内含子1上,存在一个多态位点有利于提高山羊的产羔数[30]。利用实时荧光定量PCR技术研究发现,母羊发情期下丘脑KISS-1基因的表达显著高于发情周期的其他阶段[31],本研究通过半定量RT-PCR和实时荧光定量PCR分析发现,KISS-1基因在下丘脑-垂体-性腺轴系统中的各位点及子宫等性器官都有表达,并且在下丘脑繁殖期的表达量显著高于繁殖间期,这些研究都表明KISS-1基因参与了动物的繁殖活动,并且对调控动物生殖激素的分泌有一定促进作用。
褪黑素主要是由松果体分泌的一种吲哚类激素,I.Blazer等[32]研究发现,在所有动物中褪黑素除有昼夜节律变化外,还存在季节性节律变化(夏季分泌期缩短,冬季分泌期延长)这对机体活动起重要调节作用。研究者对各种哺乳动物做了大量的研究发现,褪黑激素的分泌与动物生殖密切相关[33],短日照对绵羊这类动物的生殖具有促进作用[34]。褪黑激素的昼夜节律效应由SCN的褪黑激素受体来完成,其繁殖效应由PT的褪黑激素受体来完成[9],对于绵羊,在PT处发现MT1型受体,提示垂体结节部可能是褪黑激素繁殖效应的主作用位点。这些研究结果表明,MT1基因与绵羊的季节性繁殖活动有关。本研究通过RT-PCR分析发现,MT1基因在阿勒泰绵羊的垂体和下丘脑中表达量很高;实时荧光定量PCR结果与前人研究结果相符[35-36],在下丘脑中的表达呈现夜间低、日间高的趋势,繁殖期与繁殖间期的表达量差异不显著,说明下丘脑中的MT1基因与昼夜节律相关。
在人类的研究中发现,Otx-2基因变异可导致眼部畸形、多种垂体激素缺乏症和垂体柄中断综合征[15-16,37-38];Otx-2基因主要在中枢神经系统的前部表达,其表达的后界位于中脑与后脑的交界处[39]。H.J.Novaira等[8]研究发现,随着Kisspeptin处理时间及处理剂量的增加,GnRHmRNA水平和蛋白分泌水平都有所提高。细胞体外试验和转基因小鼠的研究中表明,用Kisspeptin处理后的细胞,Otx-2 mRNA和蛋白质的表达量都提高,并且其结合到GnRH启动子的活性也有所提高;敲除Otx-2基因的小鼠,与野生型小鼠相比,下丘脑GnRH的分泌量减少了80%,并且用Kisspeptin处理以后不能使GnRHmRNA表达增加[12]。这些研究都表明,Otx-2是Kisspeptin调控GnRH基因表达和动物生殖活动的重要因子。本研究表明,在Otx-2基因高表达的组织中,KISS-1、GnRH及MT1基因在这些组织中同样表达量较高;在下丘脑中,KISS-1基因在繁殖期的夜间表达量最高时,Otx-2和GnRH基因也在这个生理状态下表达量最高,这样的现象表明,在绵羊中,Otx-2基因与KISS-1和GnRH基因的表达规律间存在一定联系,可能协同调节绵羊的生殖和季节性繁殖活动,但Otx-2调控绵羊繁殖活动的分子机制是否与小鼠相同,还有待于进一步研究。大鼠的研究发现,Kisspeptin能通过GnRH促进LH的分泌,其中在发情期作用最大,而在间情期的作用最小[40]。本研究显示,在繁殖间期Otx-2的表达量与KISS-1和GnRH没有呈现明显的规律性变化,可能是在繁殖间期,KISS-1基因的表达量很低,Otx-2基因的表达受Kisspeptin的调控作用减弱。Kisspeptin在繁殖间期可能不是调控Otx-2的主要因素。在复杂的机体内环境中,Otx-2基因的表达量可能还受除Kisspeptin以外的其他因素调节,这些相关因素还需要进一步深入探究。
4 结 论
绵羊Otx-2基因在心、肝、脾、肺、肾、大肠、小肠、胃、大脑、小脑、子宫、垂体、松果体、下丘脑和甲状腺组织中都有表达,但以下丘脑中的表达量较高。在繁殖期Otx-2、KISS-1和GnRH基因在下丘脑中的表达规律一致,因此推测绵羊Otx-2基因可能具有与小鼠Otx-2基因相似的功能,参与绵羊的季节性繁殖调控。
[1] GREIVES T J,MASON A O,SCOTTI M,et al.Environmental control of kisspeptin:implications for seasonal reproduction[J].Endocrinology,2007,148(3):1158-1166.
[2] DE ROUX N,GENIN E,CAREL J C,et al.Hypogonadotropic hypogonadism due to loss of function of theKiSS1-derived peptide receptor GPR54[J].ProcNatlAcadSciUSA,2003,100(19):10972-10976.
[3] SEMINARA S B,MESSAGER S,CHATZIDAKI E E,et al.TheGPR54 gene as a regulator of puberty[J].NEnglJMed,2003,349(17):1614-1627.
[4] PIELECKA-FORTUNA J,CHU Z,MOENTER S M.Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol[J].Endocrinology,2008,149:1979-1986.
[5] ROA J,VIGO E,CASTELLANO J M,et al.Opposite roles of estrogen receptor(ER)-alpha and ERbeta in the modulation of luteinizing hormone responses to kisspeptin in the female rat:implications for the generation of the preovulatory surge[J].Endocrinology,2008,149:1627-1637.
[6] SHAHAB M,MASTRONARDI C,SEMINARA S B,et al.Increased hypothalamic GPR54 signaling:a potential mechanism for initiation of puberty in primates[J].ProcNatlAcadSciUSA,2005,102:2129-2134.
[7] THOMPSON E L,PATTERSON M,MURPHY K G,et al.Central and peripheral administration of kisspeptin-10 stimulates the hypothalamic-pituitary-gonadal axis[J].JNeuroendocrinol,2004,16:850-858.[8] NOVAIRA H J,NG Y,WOLFE A,et al.Kisspeptin increases GnRH mRNA expression and secretion in GnRH secreting neuronal cell lines[J].MolCellEndocrinol,2009,311:126-134.
[9] WEAVER D R,REPPERT S M.The Mel1a melatonin receptor gene is expressed in humans uprachiasmatic nuclei[J].Neuroreport,1996,8(1):109-112.
[10] ANSEL L,BOLBOREA M,BENTSEN A H,et al.Differential regulation of KISS1 expression by melatonin and gonadal hormones in male and female Syrian hamsters[J].BiolRhythms,2010,25(2):81-91.
[11] 薛海龙,宋兴超,杨镒峰,等.褪黑激素对动物繁殖活动的影响及调控机理[J].特产研究,2014,1:64-66. XUE H L,SONG X C,YANG Y F,et al.Effect of melatonin on animal reproduction and the mechanism of action[J].SpecialWildEconomicAnimalandPlantResearch,2014,1:64-66.(in Chinese)
[12] NOVAIRA H J,FADOJU D,DIACZOK D,et al.Genetic mechanisms mediating kisspeptin regulation of GnRH gene expression[J].JNeurosci,2012,32:17391-17400.
[13] SIMEONE A,ACAMPORA D,MALLAMACI A,et al.A vertebrate gene related to orthodenticle contains a homeodomain of the bicoid class and demarcates anterior neuroectoderm in the gastrulating mouse embryo[J].EMBOJ,1993,12:2735-2747.
[14] ARENDT D.Evolution of eyes and photoreceptor cell types[J].IntJDevBiol,2004,477-478.
[15] DATEKI S,FUKAMI M,SATO N,et al.Otx2 mutation in a patient with anophthalmia,short stature,and partial growth hormone deficiency:functional studies using the IRBP,HESX1,and POU1F1 promoters[J].JClinEndocrinolMetab,2008,93:3697-3702.
[16] DATEKI S,KOSAKA K,HASEGAWA K,et al.Heterozygous orthodenticle homeobox 2 mutations are associated with variable pituitary phenotype[J].JClinEndocrinolMetab,2010,95:756-764.
[17] GOTTSCH M,CUNNINGHAM M,SMITH J,et a1.A role for kisspeptins in the regulation of gonedotropin 8 eclwdon in the mouse[J].Endocrinology,2004,145(9):4073-4077.
[18] KAUFFMAN,GOTTSCH M,ROA J,et a1.Sexual differentiation of KISS-l gene expression in the brain of the rat[J].Endocrinology,2007,148(4):1774-1783.
[19] SMITH J,CANNINGHAM M,RISSMAN B,et al.Regulation of KISS-l gene expression in the brain of the female mouse[J].Endocrinology,2005,146(9):3686-3692.
[20] SMITH J,DUNGAN H,STOLL E,et a1.Differential regulation of KISS-l mRNA expression by sex steroids in the brain ofthe male mouse[J].Endocrinology,2005,146(7):2976-2984.
[21] KOTANI M,DETHEUX M,ANDENBOGAERDE A,et a1.The metastasis suppressor gene KISS-1 encodes kisspeptins,the natural ligands of the orphan G protein-coupled receptor GPR54[J].JBiolChem,2001,276(37):34631-34636.
[22] MUI A,CHAMBERLAIN L,EISHOURBAGY N,et al.AXORl2,a novel human G protein-coupled receptor,activated by the peptide KISS-l[J].JBiolChem,2001,276(31):28969-28975.
[23] CASTELLANO J,GAYTAN M,ROA J,et a1.Expression of KiSS-l in rat ovary:putative local regutator of ovulation?[J].Endocrinology,2006,147(10):4852-4862.
[24] MESSAGER S,CHATZIDAKI E E,MA D,et al.Kisspeptin directly stimulates gonadotropin-releasing hormone release via G protein-coupled receptor 54[J].ProcNatlAcadSciUSA,2005,102(5):1761-1766.
[25] TENA-SEMPERE M.GPR54 and kisspeptin in reproduction[J].HumReprodUpdate,2006,12(5):631-639.
[26] TOVAR S,VAZQUEZ M,NAVARRO V,et al.Effects of single or repeated intravenous administration of kisspeptin upon dynamic LH secretion in conscious male rats[J].Endocrinology,2006,147(6):2696-2704.
[27] KADOKAWA H,MATSUI M,HAYASHI K,et al.Peripheral administration of kisspeptin-10 increases plasma concentrations of GH as well as LH in prepubertal Holstein heifers[J].JEndocrinol,2008,196(2):331-334.
[28] HAN S,GOTTSCH M,LEE K,et al.Activation of gonadotropin-releasing hormone neurons by kisspeptin as a neuroendocrine switch for the onset of puberty[J].JNeurosci,2005,25(49):11349-11356.
[29] CASTELLANO J,NAVARRO V,FERNANDEZ-FERNANDEZ R,et al.Ontogeny and mechanisms of action for the stimulatory effect of kisspeptin on gonadotropin-releasing hormone system of the rat[J].MolCellEndocrinol,2006,26:257-258.
[30] 李隐侠,张 俊,钱 勇,等.KISS-1基因多态性与苏淮山羊产羔数的关联分析[J].畜牧兽医学报,2014,45(12):1917-1923. LI Y X,ZHANG J,QIAN Y,et al.KISS-1 gene polymorphisms and its association with litter sizes in Suhuai goats[J].ActaVeterinariaetZootechnicaSinica,2014,45(12):1917-1923.(in Chinese)
[31] 王 军,孙 蕾,吕文发,等.KISS-1/GPR54系统在不同发情周期母羊下丘脑中的表达规律[J].西北农林科技大学学报(自然科学版),2011,12:49-52,59. WANG J,SUN L,LÜ W F,et al.Expression of KISS-1/GPR54 system in the ewe hypothalamus during the estrous cycle[J].JournalofNorthwestA&FUniversity(NatureScienceEdition), 2011,12:49-52,59.(in Chinese)
[32] BLAZER I,BEHRMANN G,HARDELAND R.Evolutionary significance of the presence of melatonin in unicells and plants[J].Ibid,1995,14:2-3.
[33] 葛仕豪.济宁青山羊生殖激素分泌规律及GnRHR在垂体和卵巢的免疫组化研究[D].泰安:山东农业大学,2007. GE S H.Study on the endocrine mechanism of reproduction hormone of the immunohistochemistry of GnRHR in pituitary and oavry of Jining Gary goat[D].Taian:Shandong Agricultural University,2007.(in Chinese)
[34] 马友记,李发弟,张 利.褪黑素对动物生殖调控机理的研究进展[J].中国草食动物,2007,Sl:85-88. MA Y J,LI F D,ZHANG L.Melatonin on animal reproductive regulation mechanism research[J].ChinaHerbivores,2007,Sl:85-88.(in Chinese)
[35] 杜玉珍,童 建.视交叉上核中褪黑素受体mRNA的昼夜节律性表达[J].苏州大学学报(医学版),2002,22(1):1-3. DU Y Z,TONG J.Circadian expression of melatonin receptor mRNA in suprtchiasmtic nucleus[J].SuzhouUniversityJournalofMedicalScience,2002,22(1):1-3.(in Chinese)
[36] MARTINE M,AGNES D,BENOIT M.MTNR1A melatonin receptors in the ovine premammillary hypothalamus:day-night variation in the expression of the transcripts[J].BiolReprod,2005,72(2):393-398.
[37] DIACZOK D,ROMERO C,ZUNICH J,et al.A novel dominant negative mutation of Otx2 associated with combined pituitary hormone deficiency[J].JClinEndocrinolMetab,2008,93(11):4351-4359..
[38] TAJIMA T,OHTAKE A,HOSHINO M,et al.Otx2 loss of function mutation causes anophthalmia and combined pituitary hormone deficiency with a small anterior and ectopic posterior pituitary[J].JClinEndocrinolMetab,2009,94:314-319.
[39] 邓锦波,徐晓波,范文娟.小脑发育及其基因调节[J].解剖科学进展,2010,16(2):181-186. DENG J B,XU X B,FAN W J.Development and gene regulation of cerebellum[J].ProgressofAnatomicalSciences,2010,16(2):181-186.(in Chinese)
[40] ROA J,VIGO E,CASTELLANO J,et al.Hypothalamic expression of KISS-1 system and gonadotropin-releasing effects of kisspeptin in different reproductive states of the female rat[J].Endocrinology,2006,147(6):2864-2878.
(编辑 程金华)
Cloning and Tissues Expression Analysis ofOtx-2 and the Associations with Seasonal Breeding in Sheep
GUO Ruo-ting1,LU Hui-wen2,OU Ke-peng1,WANG Ying1,LIU Yi1,GU Zhen-zhen1,LIU Xiao-jun3*
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832003,China;
2.TECONAnimalHusbandryTechnologyCorporation,Changji831100,China;3.CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
In order to understand the effect ofOtx-2 gene on sheep reproductive regulation,the part of CDS(Coding region)Otx-2,MT1,KISS-1,GnRHgenes were cloned from Altay sheep hypothalamus tissue.Semi-quantitative RT-PCR was used to analyze the tissues(heart,liver,spleen,lung,kidney,large intestine,small inestine,stomach,brain,epencephalon,uterus,hypophysis,pineal body,hypothalamus,thyroid) expression profile of the genes.The expression patterns ofOtx-2,MT1,KISS-1 andGnRHgenes in hypothalamus with different periods were further investigated by real-time fluorescence quantitative PCR.The results showed thatOtx-2 andKISS-1,MT1 mRNAs were expressed in many tissues tested,which hypothalamus showed higher expression levels forOtx-2 andKISS-1.In addition,theOtx-2 gene showed a similar expression pattern toKISS-1 andGnRH,which were significantly higher in the breeding seasons than that in the non-breeding seasons(P<0.01),and also significantly higher in the night than in the day time(P<0.01).It was concluded thatOtx-2 gene might take part in seasonal reproduction in sheep.
Otx-2 gene;hypothalamus;seasonal breeding;sheep
10.11843/j.issn.0366-6964.2015.05.003
2014-10-30
教育部高等学校博士学科点专项科研基金(博导类)(20126518110004)
郭若婷(1990-),女,新疆石河子人,硕士生,主要从事绵羊分子遗传育种研究,E-mail:674470976@qq.com
*通信作者:刘小军,教授,博导,E-mail:xjliu2008@hotmail.com
S826.2
A
0366-6964(2015)05-0696-08
