铁氧化物的合成及其对碘离子的吸附性能研究
2015-03-20汪葵
汪 葵
(江西环境工程职业学院,江西 赣州 341000)
铁氧化物的合成及其对碘离子的吸附性能研究
汪 葵
(江西环境工程职业学院,江西 赣州 341000)
通过改变铁盐种类和pH值合成多种羟基氧化铁,并探究其吸附去除碘离子的性能。对吸附碘离子的时间、pH值、温度、离子强度等条件进行优化。探究最优吸附条件下羟基氧化铁对I-的饱和吸附量。研究表明:在pH为7.00时,以0.50mol/L NaOH滴定0.25mol/L FeCl3所制备γ-FeOOH对碘离子吸附效果最好;γ-FeOOH对碘离子的吸附较快,大约5min就能达到吸附平衡;最佳吸附pH值为7;吸附效果随NO3-离子强度的增大而下降;优化条件下对碘离子的饱和吸附容量为21.50mg/L。
铁氧化物 γ-FeOOH 碘离子 吸附
引言
铁氧化物广泛存在于各种环境介质中,是生物-土壤-矿物-水体界面之间交互作用的重要媒介[1]。羟基氧化铁是铁氧化物的重要组成部分,不同相的羟基氧化铁的相型结构和稳定性都各有差异,彼此间存在相的转化[2]。通常利用羟基氧化铁来氧化降解酚类等有机化合物[3],有效地吸附土壤和水体环境中的重金属离子,修复土壤,净化自然环境介质中的污染物[4]。因此,羟基氧化铁作为一种重要的铁氧化物,在改善环境污染和化工原料研究领域的应用越来越受到重视。而随着科技的不断进步,碘系化学品的应用领域也在不断的扩展,碘在核工业、医学研究领域的应用越来越广泛,这使得放射性碘对土壤、水体等环境的污染越来越严重。不同的制备方法将得到不同结构和特性的羟基氧化铁,本文采用不同制备方法合成了多个铁氧化物,并对所制得的样品进行了物性表征和碘离子吸附研究。
1.实验方法
1.1 样品制备
将配制好的铁盐溶液(c=0.25mol/L氯化铁、硝酸铁、硫酸铁)转移到1000mL的烧杯中,放入磁石,保持铁盐按适当速度搅拌,边搅拌边往烧杯中逐滴缓慢滴加NaOH溶液,至溶液达到所需pH值后,停止滴加NaOH,将溶液放在60℃的恒温环境中陈化48小时,取出溶液,抽滤,洗涤至无Cl-、NO3-或SO42-,烘干,研磨,过筛100目,放于干燥器中待用。
1.2 羟基氧化铁对碘离子吸附实验
1.2.1 碘离子的测定方法
取一定量碘标准溶液或是吸附离心液放到50mL容量瓶中,加入3滴溴水,摇匀,待溴水反应完全后,加入2mL 10 %的HCOOH溶液,摇匀,待反应完全后,加入1mL 20%的H3PO4溶液,1mL 100g/L的KI溶液,定容摇匀,放置于暗处显色30min,然后在350nm处,以试剂空白为参比溶液,测定吸光度。同时做一份样品空白试验。
1.2.2 羟基氧化铁样品对I-的吸附方法
称取0.1500g羟基氧化铁样品放于50ml锥形瓶中,加入25ml 100.00mg/L的KI溶液于锥形瓶中,恒温振荡2小时,将溶液转移至离心管中,4000r/min离心30min,取上清液0.50mL放到50mL容量瓶中,其余按1.2.1所述操作,计算羟基氧化铁对于碘离子的吸附率。其吸附率公式如下:
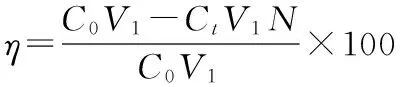
其中:η为羟基氧化铁对于碘离子的吸附率,C0为加入初始溶液的碘离子的浓度,单位为mg/L,V1为移取的溶液的体积,单位为mL,Ct为吸附后溶液中碘离子的浓度,单位为mg/L,N为溶液稀释倍数,m1为称取样品的质量,单位为mg。
1.2.3 羟基氧化铁对碘离子饱和吸附实验
配制一定浓度梯度的I-溶液,加入显色剂,待显色后测定吸光度,绘制I-标准曲线。其余按照1.2.1,1.2.2所述操作,其饱和吸附量计算公式:
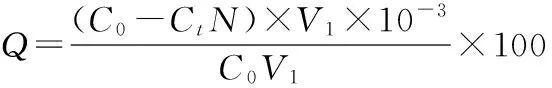
其中:Q为饱和吸附量,单位为mg/g;C0为未吸附时碘离子的浓度,单位为mg/L;Ct为吸附试验之后溶液中的碘离子的浓度,单位为mg/L;N为溶液稀释倍数;m为加入的羟基氧化铁的质量,单位为mg。
2.结果与讨论
环境以及制备条件都会影响羟基氧化铁的形态及晶型,采用不同的制备方法,得到的产物具有不同结构和特性[5]。不同结构其物理化学性质存在差异,进而对碘离子的吸附效果也会有所不同。铁盐的种类和浓度、沉淀剂的种类及浓度、pH值、陈化时间、温度、搅拌以及滴加反应物的速度等都会对产物的矿相、晶型、结构组成、颗粒形貌和大小造成一定程度的影响,也会影响碘离子的吸附。
2.1 不同羟基氧化铁的制备及对I-的吸附
本实验主要采用水解中和合成羟基氧化铁的方法,选用0.5mol/L的NaOH为滴定剂,铁盐分别为0.25mol/L 250mL的硫酸铁、硝酸铁、氯化铁三种铁盐,用pH计控制终点pH分别为7、10和12,陈化时间为48小时,陈化温度60℃。烘干温度80℃。
将所制备的羟基氧化铁样品在相同实验条件下吸附25mL 100mg/L的KI溶液,取吸附后的溶液进行紫外光度法测定其吸光度,计算各样品对I-的吸附率,选择出吸附效果较好的样品。结果见图1所示:pH值较低时,制得的样品对碘离子的吸附效果较好,而且随着pH值的升高,样品的吸附效果逐渐降低,三种铁盐中,氯化铁、硝酸铁在pH等于7时制备的羟基氧化铁对碘离子的吸附效果最佳且氯化铁的吸附效果优于硝酸铁。所以选择吸附效果最好的FeCl3与NaOH滴定至终点pH值为7时制得的羟基氧化铁进行条件优化实验。
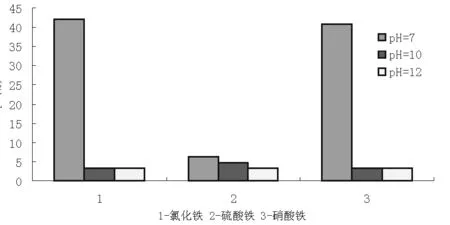
图1 不同铁盐合成材料对I-的吸附率
2.2 γ-FeOOH对碘离子吸附条件的优化
2.2.1 吸附时间的选择
研究羟基氧化铁样品对碘离子最佳吸附时间的实验中,设置的吸附时间分别为0,2,5,10,20,30,60,90,120,150,180min,其他条件不变。KI的初始浓度为50mg/L。
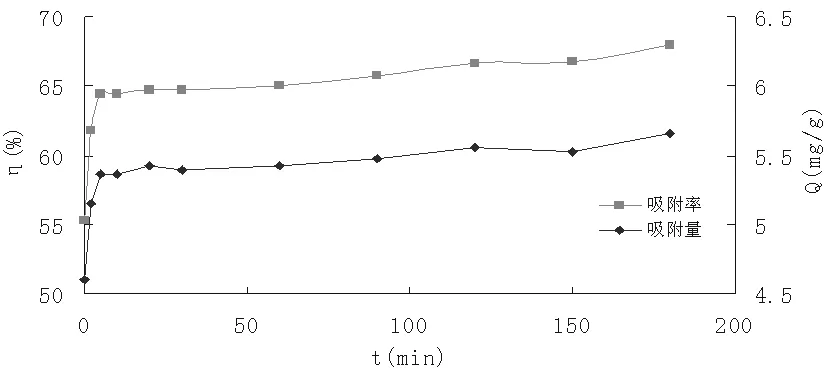
图2 吸附时间对I-吸附效果的影响
由图2可知,在0-5min的时间内,随着吸附时间的增加,羟基氧化铁对于I-的吸附率、吸附量均逐渐增加,超过5分钟之后,随着吸附时间的增加,I-的吸附率以及吸附量增加量非常小,几乎保持平衡。最大吸附率达67.97%,最大吸附量为5.66mg/g。说明羟基氧化铁对于I-的吸附时间很短,大约为5min就可达到吸附平衡。这一实验结果可能是与碘离子的吸附机理有关,碘离子被吸附时主要靠静电作用,导致碘离子的吸附时间极短。
2.2.2 吸附pH值的选择
本实验在探讨pH值对于I-吸附效果的影响的过程中,分别将吸附液的pH值设置为:3.00,4.00,5.00,6.00,7.00,8.00,9.00,10.00,其他条件不变。KI的初始浓度为50mg/L。
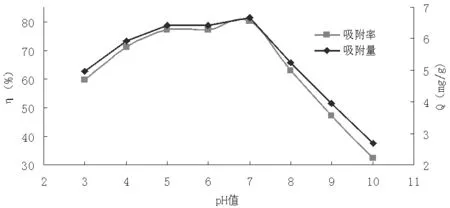
图3 pH对I-的吸附效果的影响
如图3所示可知,随着KI溶液pH的增大,羟基氧化铁对于I-的吸附效果也越来越好,但当pH增加到大于7时,随着pH的增大,羟基氧化铁对I-的吸附效果逐渐降低。当pH值在5.00-7.00之间时,吸附效果较好,其中当pH值为7.00时,吸附率达到80.14%,吸附量为6.68mg/g。所以,可知羟基氧化铁对于I-的最佳吸附pH值为7.00。
2.2.3 吸附温度的选择
在探讨pH值对于I-吸附效果的影响的实验中,分别将吸附温度设置为:25.00,35.00,45.00,55.00,65.00,75.00℃,其他条件不变。KI的初始浓度为50mg/L。
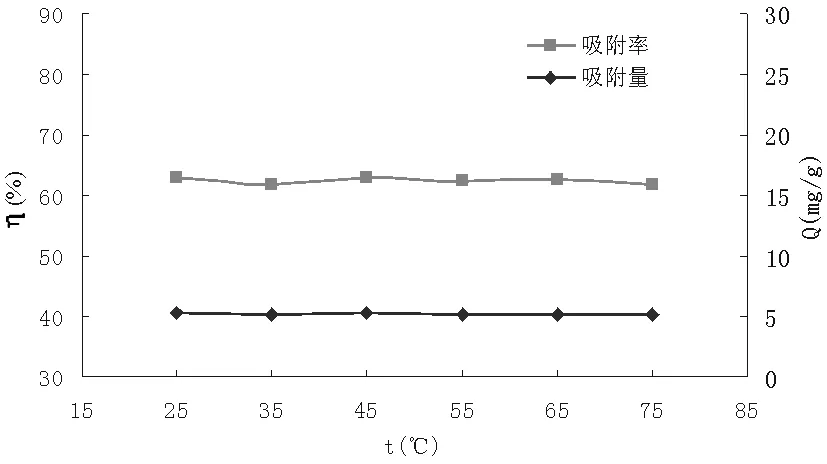
图4 温度对I-的吸附效果影响
如图4所示可知,随着温度的增加,羟基氧化铁对于I-的吸附率和吸附量变化均很小,即使不断改变吸附温度,吸附率都保持在61%左右,吸附量也维持在5.20mg/g左右。所以,羟基氧化铁对于I-的吸附效果与吸附温度没有直接关系。推测可能是因为羟基氧化铁对于I-的吸附时间极短,I-在极短时间内就达吸附平衡。
2.2.4 离子强度对于I-的吸附
在探究离子强度对I-吸附效果的影响实验中,将干扰离子NO3-的初始浓度设置为0,0.005,0.02,0.04,0.06,0.08,0.10,0.20,0.30mol/L,其他条件不变。KI的初始浓度为50mg/L。
如图5所示,当NO3-的浓度为0mol/L时,吸附率最大,为71.88%,吸附量最大,为5.99mg/g,随着NO3-浓度的增大,羟基氧化铁对于I-的吸附率和吸附量也越来越小,当NO3-的浓度增大到0.1mol/L时,吸附率和吸附量随着浓度的增大而趋近于不变,且吸附率只有2%左右,吸附量为0.20mg/g左右。说明NO3-的加入极大的抑制了羟基氧化铁对I-的吸附。可见在制备羟基氧化铁时,洗涤样品至样品中无NO3-等阴离子是非常有必要的。
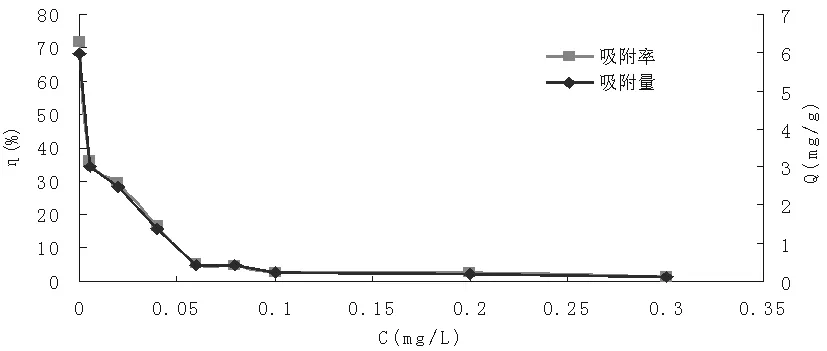
图5 NO3-对于I-吸附效果的影响
综上所述,羟基氧化铁对于I-的最佳吸附条件为:由于当吸附时间大于5min之后,随吸附时间的增加,碘离子吸附率的变化很小,几乎保持平衡,基于实验内容多,时间有限等综合考虑,我们将吸附时间设置为30min;吸附pH值为7;无NO3-等干扰离子的吸附条件下吸附效果最佳,吸附与温度无关。
2.3 γ-FeOOH对I-的饱和容量吸附
在I-吸附的最佳条件下,探究γ-FeOOH对于I-的饱和吸附容量,将I-的初始浓度设置为:5.00,20.00,50.00,100.00,200.00,300.00,400.00,500.00,600.00 mg/L,吸附pH值为7,在室温下振荡30min。
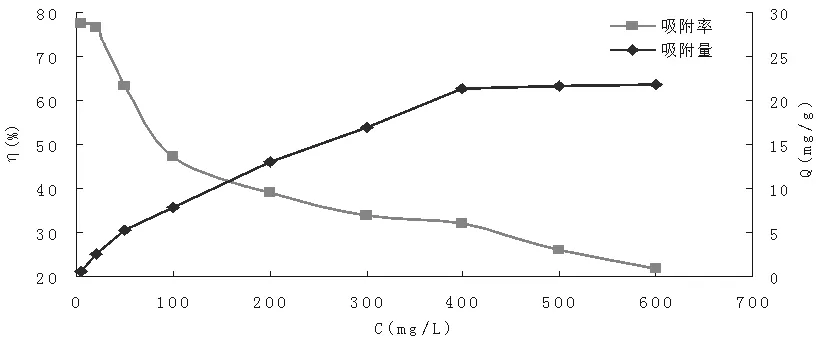
图6 羟基氧化铁对I-的饱和吸附容量
由图6可知,γ-FeOOH对于I-的吸附容量随着I-的浓度的增大也逐渐增大,吸附率随着I-浓度的增大逐渐减小。当浓度增大到400mg/L时,随着I-的浓度的增大,羟基氧化铁对I-的吸附容量基本趋近于不变,达到饱和吸附状态。在该实验条件下测得的饱和吸附容量为21.50mg/g左右。
3.结论
(1)研究制备的γ-FeOOH吸附效果好,且操作简单,设备要求简单,成本低,可行性高。
(2)γ-FeOOH最佳制备工艺是:选用0.25mol/L的FeCl3为反应铁盐,0.5 mol/L的NaOH为滴定剂,边搅拌边缓慢逐滴滴加氢氧化钠至溶液pH值为7,60℃陈化48小时,抽滤,洗涤,80℃烘干。
(3)羟基氧化铁对I-的最佳吸附条件:碘离子的吸附时间极短,大约5min左右就可达到吸附平衡,最佳吸附pH值为7,温度不影响碘离子的吸附效果,NO3-的存在会极大地抑制羟基氧化铁对于碘离子的吸附。
(4)由于NO3-的存在会极大地抑制羟基氧化铁对于碘离子的吸附,可望找到一种合适的改性剂,使改性后的羟基氧化铁可以更好的吸附I-,且吸附效果不受NO3-的影响。
[1]李伟伟,邓霞,俞骞.羟基氧化铁的制备影响及污水处理中的应用[J].山西建筑,2012,38(19):134-135.
[2]刘向农,朱慧,杨宇翔,等.β-FeOOH的微乳法合成研究[J].化学世界,2005,18(12):3-5.
[3]Huang Y H,Zhang T C.Effects of dissolved oxygen on f ormation of corrosion products and concomitant oxygen and nit rate reductionin zero-valent iron syst ems with or without aqueous Fe2+[J].Water Research,2005,39(9):1751-1760.
[4]周顺桂,周立祥.施氏矿物Schw ertmannite的微生物法合成、鉴定及其对重金属的吸附性能[J].光谱学与光谱分析,2007,27(12):367-370.
[5]巩志坚,田原宇,李文华,徐振刚.不同方法制备羟基氧化铁的脱硫活性研究[J].煤炭转化,2006,29(3):71-74.
