利用污水厂二级出水对富油微藻藻种的培育和筛选
2015-03-20段书芬郑柏洪
方 华,段书芬,何 磊,陈 丽,郑柏洪
(1. 南京信息工程大学环境科学与工程学院,江苏南京 210044;2. 大气环境与装备技术协同创新中心,江苏南京 210044;3. 江苏立能环保水处理工程有限公司,江苏苏州 215168)
富油微藻被认为是唯一具有完全替代化石燃料潜力的生物柴油原料[1],但微藻制备生物柴油的高成本制约了该技术发展[2],而其中微藻培养成本则占到生物柴油生产总成本的70%以上[3]。另一方面,微藻生长的同时也会大量摄取水中的营养物质,利用微藻对污水进行深度脱氮除磷处理,自20 世纪中叶以来即被提出和研究[4,5]。假如能利用污水厂二级出水培养富油微藻,可同步实现富油微藻培养和污水深度净化,并能大幅降低微藻培养成本,具有极佳的环境效益和经济效益,而适宜藻种的筛选及其在二级出水中生长和富油特性的研究则是这一技术的基础。本研究选取了国内外常用于生物柴油制备和污水处理的普通小球藻(Chlorella vulgaris)、二形栅藻(Scenedesmus obliquus)、蛋白核小球藻(Chlorella pyrenoidosa)和海水小球藻(Chlorella pacifica)等4种微藻为对象,对比研究了它们在二级生化出水中的生长、油脂积累和脱氮除磷性能,以期为筛选出适于在二级出水中培育的富油微藻提供依据。
1 材料与方法
1.1 试验废水
采用模拟二级出水[6]为微藻培养液,水质如表1 所示。

表1 二级出水水质Tab.1 Water Quality of Secondary Effluent
1.2 藻种及微藻培养
普通小球藻、二形栅藻和蛋白核小球藻购自中国科学院水生生物研究所,海水小球藻购自青岛海洋研究所。采用BG11 为基础培养基进行藻种的扩大培养。
微藻培养在500 mL 锥形瓶中进行,按1 ∶9(体积比)将藻液接种至灭菌后二级出水中;接种前藻液采用15 mg /L 的NaHCO3溶液清洗2 遍;接种后置于光照培养箱中,温度为25 ℃、光照强度为8 000 lux、光暗比为12 ∶12 的条件下培养。
1.3 微藻生物量和油脂含量的测定
微藻干重采用重量法测定[7],藻细胞的光密度值采用分光光度法测定[8,9]。分别建立4 种微藻光密度值与干重的标准曲线,用于微藻生物量计算。培养液中微藻油脂含量采用重量法测定[10],提取剂为氯仿-甲醇混合液;同步测定藻干重,计算藻细胞含油率。
1.4 微藻生长与氮磷去除模型拟合
利用Logistic 模型对微藻生长特性进行拟合分析。Logistic 模型常用于描述微生物生长速率和生物量之间的关系[11],其表达式如式(1)所示。
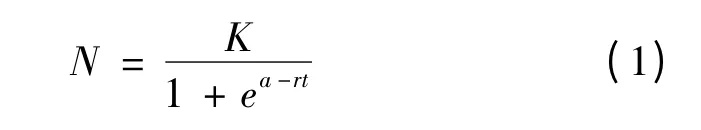
其中t—培养时间,d;
N—t 时刻微藻生物量,mg/mL;
K—微藻最大生物量,mg/mL;
a—初始偏移量;
r—比生长速率,d-1。
当N 为K 的一半时,生物量增长速率最大,以Rmax表示,其计算式如式(2)所示。
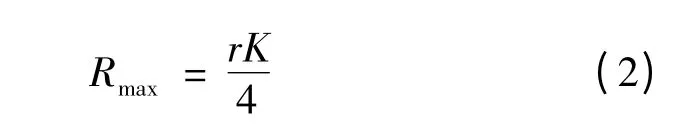
利用一级反应动力学模型对氮磷去除进行拟合。一级动力学反应是指反应速率与反应物含量的一次方成正比的反应,可用来描述氮磷等污染物的生物降解过程[12],其表达式如式(3)所示。

其中—si—t 时刻的营养盐浓度;
s0—初始的营养盐浓度;
k—一级反应常数。
1.5 水质分析
TN 采用过硫酸钾氧化-紫外分光光度法测定;TP 采用钼酸铵分光光度法测定;COD 采用重铬酸钾法测定。培养后藻液以4 000 r/min 离心30 min 后,取上清液测定。
2 结果与讨论
2.1 微藻生长特性
模拟二级出水中,4 种微藻生长及其Logistic 模型拟合曲线如图1 所示,采用origin 软件所得拟合结果如表2 所示。
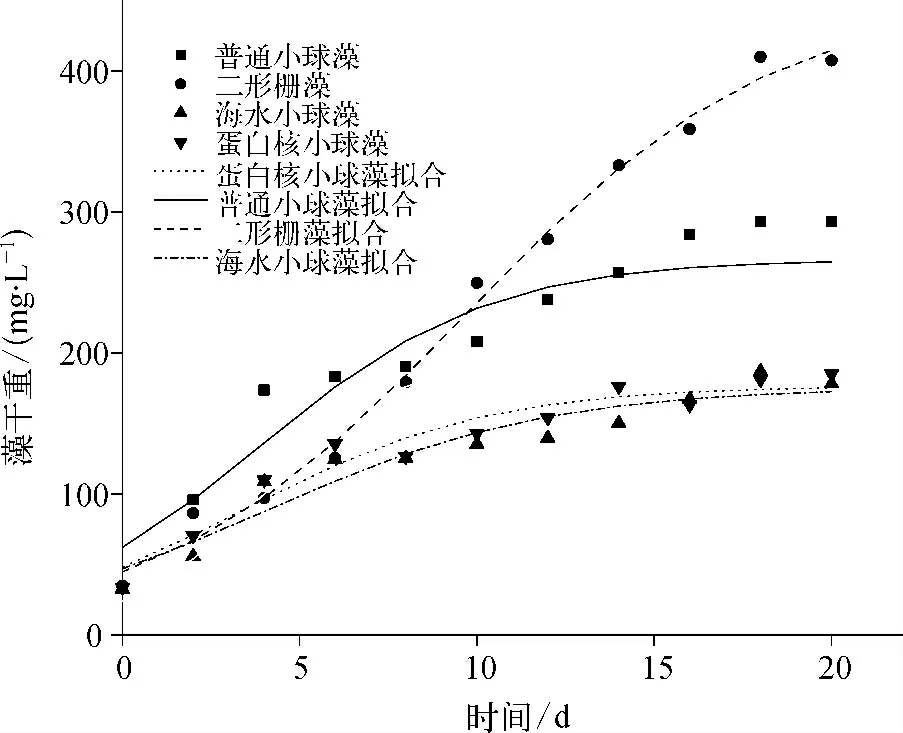
图1 生物量随时间的变化Fig.1 Variation of Biomass with Time
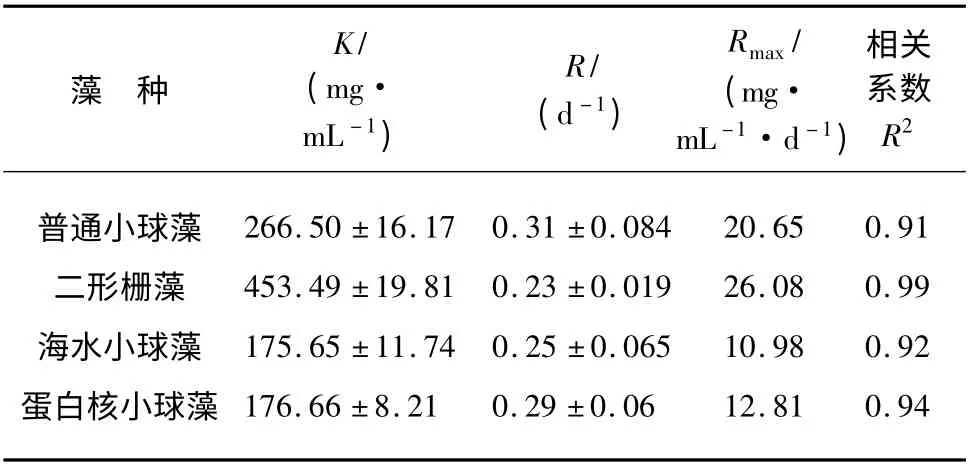
表2 四种藻的生长特征参数Tab.2 Growth Parameters of Four Species of Microalgae
4 种微藻的生长均呈现出先快速增长后趋于平缓的规律,与经典的微生物批次培养生长特性相符。普通小球藻和二形栅藻的生长速率与生物量显著高于其他两种微藻,18 d 时最大藻干重分别可达293.04 和409.94 mg/L。已有研究中,小球藻、栅藻等在BG11 等常用培养基中生长的生物量一般为300 ~500 mg/L 左右[13];本试验所用的二级出水虽然氮磷等营养盐的浓度较低,但培养后微藻生物量与此相近,初步表明二级出水可满足微藻生长需要。由拟合结果可知,4 种微藻的生长曲线与Logistic 模型相关性均较好;普通小球藻的比生长速率r 最大,为0. 31 d-1;二形栅藻的最大生物量K 最高,为453.49 mg/mL;普通小球藻和二形栅藻的最大生物量增长速率Rmax分别为20.65 与26.08 mg/mL·d,大大高于其他两种微藻。这些均表明普通小球藻和二形栅藻更适于在二级出水中生长。
2.2 油脂含量与含油率

图2 油脂含量随时间的变化Fig.2 Variation of Lipid Productivity with Time
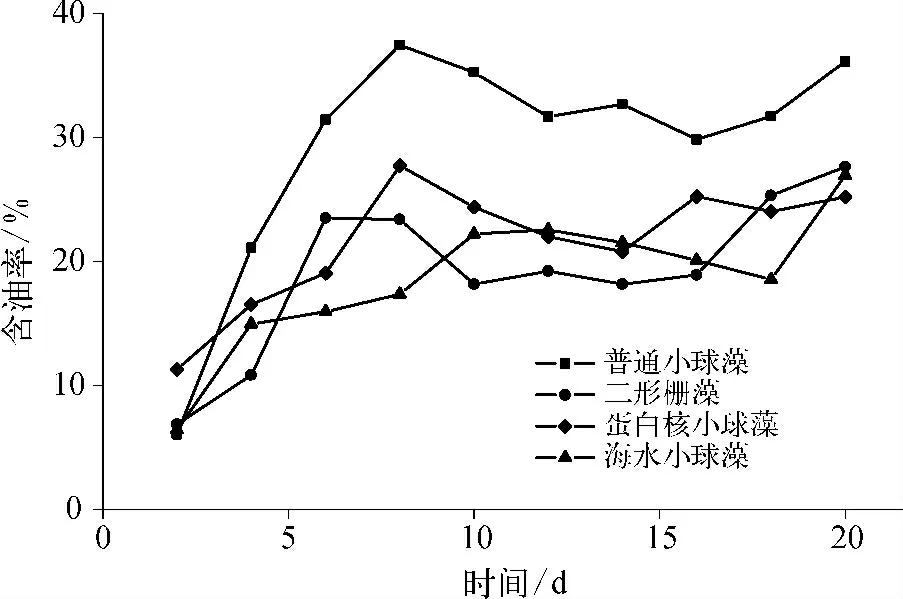
图3 含油率随时间的变化Fig.3 Variation of Lipid Content of Time
4 种微藻在模拟二级出水中的油脂含量及藻细胞含油率变化如图2 和图3 所示。4 种微藻藻液中油脂含量随培养时间延长总体呈现先快速增加后趋于稳定的趋势,与生物量变化规律相似,表明微藻生物量是决定油脂含量的重要因素。培养前期,藻生物量的快速增殖使得油脂含量同步大幅提高;而普通小球藻和二形栅藻因生物量较高,其油脂含量也显著高于其他两种微藻,20 d 时分别可达94 和113 mg/L。但与生长曲线不同,油脂含量在培养后期再次呈现上升趋势,表明微藻进入生长稳定期后存在着显著的油脂富集过程。
4 种微藻的含油率随培养时间延长呈现先快速上升、后小幅下降、再上升的趋势,在培养的中后期与生物量变化存在明显差异。这表明微藻生长和油脂富集过程中存在着一定的相互制约关系;进入稳定期后,微藻生长速率下降可促进油脂的积累。有研究认为,在氮源受限的条件下,藻细胞中蛋白质和核酸等基本结构物的合成速率降低,使得碳固定的主要产物转变为碳水化合物和油脂[14]。在培养末期,培养液中氮元素含量大幅降低引起了微藻油脂富集作用加强,从而使得藻细胞含油率及藻液中油脂含量上升。在本研究中,普通小球藻的含油率可达37.46%,明显高于其他三种微藻,且高于一般培养条件下的普通小球藻的油脂含量(28%~32%)[15],表现出可观的产油潜力。
2.3 氮磷去除能力
培养过程中,4 种微藻对TN 和TP 的去除效果如图4 所示。
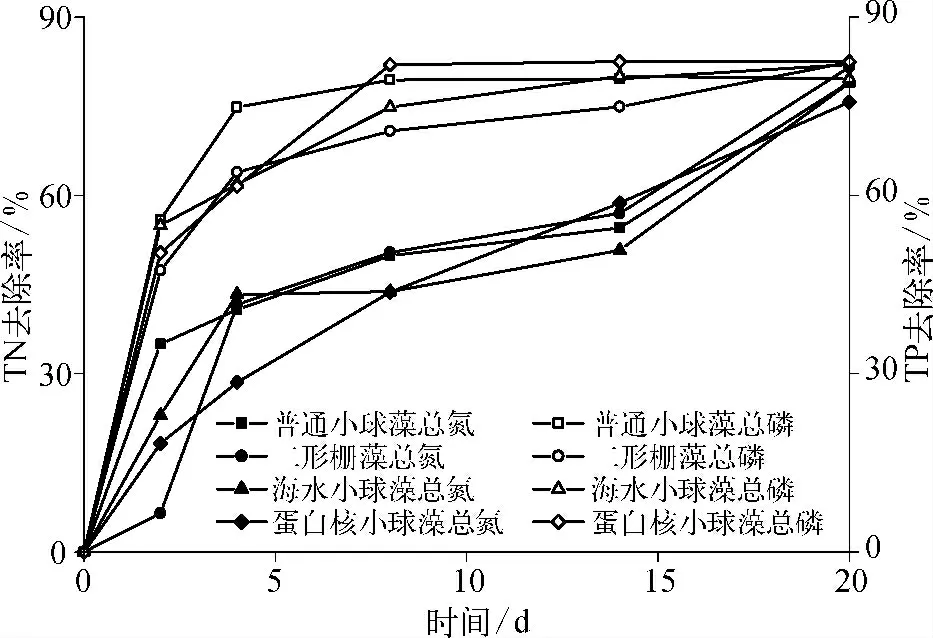
图4 TN 和TP 的去除Fig.4 Removal Rate of TN and TP
由图4 可知4 种微藻对TN(初始浓度为38.8 ~40.1 mg/L)的去除效果较为接近,随时间呈现稳步上升的趋势;培养20 d 后,去除率可达75%左右。4种微藻对TP(初始浓度为2.7 ~3.1 mg /L)的去除效果均较好,短时间内即可达到较好的去除效果(8 d 时去除率达80%以上),并趋于稳定。微藻为自养型生物,可通过光合作用直接利用水中的无机氮和有机氮合成氨基酸和蛋白质,也可通过多种磷酸化途径将水中的磷转化成磷脂等物质,对氮、磷等污染物质具有吸附作用强、净化效果好的优势[5]。总体来看,4 种微藻在二级生化出水中均展现出较强的脱氮除磷效能。
采用一级反应方程对微藻培养过程中氮磷去除进行拟合,结果如表3 所示。
4 种微藻的反应速率常数kN较为接近。4 种微藻对磷的去除存在一定差异,其中普通小球藻的反应速率常数kP最高,为0.36 d-1。Wang 等[12]研究表明氮浓度提高可促进微藻对磷的吸收,当培养基中N/P >9 时,kP将显著大于kN;本试验中N/P 约为12.5 ~14.5,故4 种藻的kP大大高于kN,即微藻对磷的去除要快于对氮的去除,这也与前述的TN 和TP 的去除曲线一致。
3 结论
(1)4 种微藻在二级出水中生长符合经典的微生物生长规律,二形栅藻和普通小球藻可达到较高生物量,分别为409.94 和293.04 mg /L;普通小球藻的比生长率最大(0.31 d-1),栅藻的最大生物量最高(453.49 mg/mL);两种藻的最大生物量增长速率分别为20.65 与26.08 mg/mL·d,这表明两种微藻更适于在二级出水中生长。
(2)普通小球藻和二形栅藻培养后藻液中油脂含量显著高于其他两种微藻,分别可达94. 00 和112.63 mg/L;微藻进入生长稳定期后存在着显著的油脂富集过程;淡水小球藻的含油率最高为37.46%,表现出可观的产油潜力。
(3)4 种微藻在二级生化出水中均表现出较强的脱氮除磷效果,TP 的去除率都达到80%以上,TN去除率达到75%以上;微藻对磷的去除速率要显著大于对氮的去除速率。
[1]Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances,2007,25(3):294-306.
[2]Gomez C,Escudero R,Morales M M,et al. Use of secondarytreated wastewater for the production of Muriellopsis sp.[J]. App Microbiol Biotechnol,2013,97(5):2239-2249.
[3]Behzadi S,Farid M M. Review:examining the use of different feedstock for the production of biodiesel[J]. Asia-Pacific Journal of Chemical Engineering,2007,2(1):480-486.
[4]Marinho Soriano E,Azevedo C A A,Trigueiro T G,et al.Bioremediation of aquaculture wastewater using macroalgae and Artemia[J]. International Biodeterioration & Biodegradation,2011,65(1):253-257.
[5]Aslan S,Kapdan I K. Batch kinetics of nitrogen and phosphorus removal from synthetic wastewater by algae [J]. Ecological Engineering,2006,28(1):64-70.
[6]汤会军,李鑫,胡洪营. 初始密度及饥饿对栅藻LX1 氮磷去除的影响[J].水处理技术,2010,26(7):33-39.
[7]Hu YiRu,Guo Chen,Wang Feng,et al. Improvement of microalgae harvesting by magnetic nanocomposites coated with polyethylenimine [J]. Chemical Engineering Journal,2014,242(11):341-347.
[8]Mandal S,Mallick N. Microalgae Scenedesmus obliquus as a Potential Sourcefor Biodiesel Production[J]. Applied Microbiology and Biotechnology,2009,84(2):281-291.
[9]Kong Q X,Li L,Martinez B,et al. Culture of microalgae Chlamydomonas reinhardtii in wastewater for biomass feedstock production[J]. APPI. Biochem. Bioteehnol,2010,160(1):9-18.
[10]Caroline Souza Pamplona Silva,Maria Estela Silva-Stenico,Marli Fátima Fiore,et al. Optimization of the cultivation conditions for Synechococcus sp. PCC7942 (cyanobacterium)to be used as feedstock for biodiesel production [J]. Algal Research,2014,3(6):1-7.
[11]Xu Yaoyang. Wiebke J Boeing. Modeling maximum lipid productivity of microalgae:Review and next step[J]. Renewable and Sustainable Energy Reviews,2014,32(7):29-39.
[12]Wang Meng,Wenye Camilla Kuo-Dahab,Sona Dolan,et al.Kinetics of nutrient removal and expression of extracellular polymeric substances of the microalgae, Chlorella sp. and Micractinium sp.,in wastewater treatment [J]. Bioresource Technology,2014,154(9):131-137.
[13]Li X,Hu HY,Yang J. Lipid accumulation and nutrient removal proerties of a newly isolated freshwater microalgae,Scenedesmus sp.LX1 growing in secondary effluent[J]. New Biotechnol,2010,27(8):59-63.
[14]Gao Yingying, Yang Maochun, Wang Changhai. Nutrient deprivation enhances lipid content in marine microalgae [J].Bioresource Technology,2013,147(6):484-491.
[15]Chisti Y. Biodiesel from microalgae beats bioethanol[J]. Trends Biotechnol,2008,26(9):126-131.
