全脑CT灌注成像联合CT血管成像评估动脉瘤夹闭和血管内介入术后缺血并发症
2015-03-20程晓青陈谦周长圣李建瑞黄伟卢光明
程晓青,陈谦,周长圣,李建瑞,黄伟,卢光明
颅内动脉瘤破裂导致蛛网膜下腔出血是临床常见的急性病变,具有较高的致残率及病死率[1]。显微手术夹闭和血管内介入治疗是其主要的治疗方法[2]。但是,颅内动脉瘤术后缺血并发症的发生率达到7.6%~65%[3-5],严重影响预后。目前,CT灌注成像(CT perfusion imaging,CTPI)是临床应用较广的血流动力学评估方法[6-7],但是由于CTPI扫描覆盖范围限制,难以显示前后循环供血区,因而较少应用于颅内动脉瘤的术后评估。随着CT探测器层数的增加以及自适应4D螺旋扫描模式的应用,一次扫描可以得到全脑的CT灌注成像(whole brain CT perfusion,WB-CTPI)和CTA数据,真正实现CTPI与CTA的一站式检查[8]。
本研究对破裂动脉瘤行显微手术夹闭和血管内介入治疗术后出现神经功能损害或临床高度怀疑有缺血并发症的患者进行动态容积CT扫描,通过WB-CTPI和CTA重建对手术造成血管损伤导致的缺血并发症进行分类和血流动力学评估。
材料与方法
1.一般资料
搜集2013年3月-2014年4月因动脉瘤破裂行显微手术夹闭和血管内介入治疗术,术后出现神经功能损伤或临床高度怀疑缺血并发症的58例患者的病例资料男25例,女33例,平均年龄(52±11)岁。其中。对有临床症状的患者于当天行WB-CTPI检查,而没有症状的患者于术后3~14d接受检查。搜集患者的临床资料,包括Hunt and Hess分级、术后出现的临床症状、治疗策略以及动脉瘤的大小(<7mm,7~12mm,13~25mm,>25mm)和部位。所有患者检查前均签署书面知情同意书。
2.仪器与方法
动态容积CT扫描:采用Siemens Somatom Definition Flash双源128层螺旋CT进行动态容积CT扫描。采用自适应4D螺旋扫描模式,于CT平扫后,采用高压注射器经肘前静脉注入30mL非离子型对比剂碘普安(300mg I/mL)及30mL生理盐水,注射流率为5mL/s。延迟5s后,平行于眶听线,自下颌骨至颅顶15cm范围进行动态灌注扫描,总扫描时间40.17s(0~24.1s为第一扫描时相,间隔时间为1.5s,共扫描17次;24.1~40.17s为第二扫描时相,间隔时间为3s,共扫描5次)。扫描参数:80kV,100mAs;球管转速0.28s/r。容积CT扫描的辐射剂量为5.31mGy。WB-CTPI扫描层厚5mm、层间距5mm,CTA重建层厚0.75mm、层间距0.5mm。
WB-CTPI后处理:将原始数据传入SyngoMMWP VE40B后处理工作站,使用VPCT Neuro软件中的Stroke模式进行后处理。经过运动校正,4D降噪,去除颅骨,软件自动选择大脑前动脉为输入动脉,上矢状窦为输出静脉后,经重建得到脑血流量(cerebral blood flows,CBF),脑血容量(cerebral blood volume,CBV),达峰时间(time to peak,TTP),延迟时间(time to delay,TTD)和平均通过时间(mean transit time,MTT)的伪彩图。两位有3年以上灌注后处理经验的神经影像科医生进行兴趣区(ROI)的划取。根据文献报道,TTD较其他的血流灌注参数敏感性更高,能够更好的评估脑缺血异常灌注的范围[6],因此本研究根据TTD图为标准,观察伪彩图异常灌注区的分布,避开血管夹或弹簧圈伪影层面手动划取ROI,同时镜像得到对侧大脑ROI的CBF、CBV、TTP、TTD和MTT的绝对值。
CTA后处理:将原始数据传入工作站重建出多期相的4DCTA图像,选取对比剂充盈最好的动脉期进行3DCTA的重建,重点观察血管夹或弹簧圈与父血管和分支血管之间的关系。
4.缺血并发症的判定
通过WB-CTPI显示脑血流灌注异常评估动脉瘤术后缺血并发症的发生,并预测脑梗死,所有患者于出院前经CT平扫出现新的低密度病灶,确诊脑梗死的发生,需除外由于脑出血,脑室引流或者动脉粥样硬化等原因引起的脑梗死。通过CTA评估血管夹或弹簧圈造成父血管或邻近血管的狭窄或闭塞,需除外粥样硬化造成脑动脉狭窄闭塞的患者。3个月随访,对脑梗死患者进行改良Rankin量表评估预后,按残疾等级从0到6进行评分[9]。
3.统计学分析
采用SPSS 17.0统计血软件进行统计学分析,计数资料表示为例数或百分比(%),计量资料表示为均值±标准差。采用配对t检验比较患侧与对侧大脑半球脑血流灌注值差异,以P≤0.05为差异有统计学意义。
结 果
1.临床特征
58例患者中,男25例,女33例,平均年龄(52± 11)岁。术前经CTA或DSA确诊共有73枚动脉瘤,其中位于大脑中动脉(middle cerebral artery,MCA)18枚,前交通动脉16枚,后交通动脉13枚,大脑前动脉(anterior cerebral artery,ACA)11枚,眼动脉6枚,颈内动脉床突上段5枚,颈内动脉海绵窦段2枚,基底动脉1枚,小脑后上动脉1枚。动脉瘤平均直径为(7.03±6.05)mm;62枚动脉瘤直径<7mm,6枚动脉瘤直径7~12mm,3枚动脉瘤直径13~24mm,2枚巨大动脉瘤直径>25mm。
58例患者中,44例患者接受显微手术夹闭,9例患者接受血管内介入治疗,5例多发动脉瘤患者接受上述两种手术方式。手术后共有38例患者出现神经功能损伤,症状出现于术后12h~5d,平均发病时间为(1.75±1.14)d,其中出现头痛、呕吐21例,失语6例,偏瘫8例,意识丧失3例,其他20例患者没有明显神经功能损伤。
2.WB-CTPI和CTA结果
58例患者中有15例患者WB-CTPI显示脑血流灌注异常,CTA根据血管形态改变将其分为Ⅲ型:Ⅰ型6例,血管夹或弹簧圈导致父血管管腔狭窄;Ⅱ型2例,血管夹导致父血管或分支血管闭塞;Ⅲ型7例,不明原因或无法判断的血管损伤。随访CT发现,11例患者(73%)有脑梗死发生,脑梗死部位与损伤的责任血管供血区一致。最常见的脑梗死部位是ACA供血区(n=9),其次是MCA供血区(n=2)。
6例Ⅰ型患者中,WB-CTPI显示4例患者患侧与对侧相比,CBF和CBV正常,TTP、TTD和MTT均延长[患侧TTP(13.21±1.61)s,对侧TTP(11.41± 1.75)s,t=3.11,P=0.05;患侧TTD(7.16±2.03)s,对侧TTD(5.09±0.82)s,t=3.28,P=0.05;患侧MTT(6.26±2.43)s,对侧MTT(3.22±1.07)s,t= 3.12,P=0.05],随访CT未发现脑梗死。另外2例患者患侧与对侧相比,CBF降低,CBV降低或正常,TTP、TTD和MTT延长,随访CT证实这2例患者发生脑梗死,其mRS评分分别为1分和2分(图1)。
2例Ⅱ型患者,WBCTPI显示患侧与对侧相比,CBF和CBV降低,而TTP、TTD和MTT延长,随访CT证实这2例患者均发生脑梗死,其mRS评分分别为3和4分(图2)。
7例Ⅲ型患者中,6例能够清楚显示血管夹或弹簧圈与邻近血管的解剖结构,未发现明显血管狭窄或闭塞,1例由于弹簧圈伪影难以观察局部血管结构。7例患者WB-CTPI显示患侧与对侧相比,CBF降低,CBV降低或正常[患侧CBF(37.03±10.83)mL/(100mL·min),对侧CBF(52.63±5.62)mL/(100mL ·min),t=3.49,P=0.01;患侧CBV(2.38±0.70)mL/100mL,对侧CBV(3.26 ±0.35)mL/100mL,t=3.14,P=0.02],TTP、TTD和MTT均有延长[患侧TTP(14.28±3.74)s,对侧TTP(11.09±3.99)s,t=6.16,P=0.001;患侧TTD(7.96±1.41)s,对侧TTD(4.40±0.36)s,t=5.67,P=0.001;患侧MTT(5.45±1.01)s,对侧MTT(4.02 ±0.36)s,t=3.46,P=0.01],随访证实这7例患者均发生脑梗死(图3)。7例患者中,2例mRS评分为1分,2例为2分,1例为3分,2例患者4分。
讨 论

图1 女,36岁,前交通动脉瘤破裂行显微手术夹闭,术后10h出现右侧肢体偏瘫。a)WBCTPI示左侧大脑半球灌注异常,与右侧相比,CBF下降,CBV正常,TTP、TTD及MTT明显延长;b)CTA示左侧大脑前动脉受血管夹压迫,局部管腔狭窄(箭);c)随访CT证实左侧额叶脑梗死(箭)。
颅内动脉瘤行显微手术夹闭或血管内介入术后,由于血管夹或弹簧圈对父血管或分支血管的损伤,可引起术后神经功能损伤,导致缺血并发症的发生,如不能及时治疗可导致脑梗死,严重影响手术的预后。根据文献报道,血管损伤导致的缺血并发症发生率不低,Diederik等[10]回顾性分析了200例动脉瘤手术夹闭患者,37例(19%)发生了与手术相关的并发症,其中19例患者为血管损伤导致的。Im等[11]报道435例行血管内介入的患者中,44例患者发生与手术相关的并发症,其中24例为血栓形成,11例为父血管被弹簧圈压迫。本组58例接受WB-CTPI和CTA扫描的患者中,15例(26%)患者有脑血流灌注异常,经随访CT证实其中11例患者发生脑梗死。此外,文献报道血管内介入术后血栓栓塞也是导致缺血并发症的常见原因之一[12-13],但是本组病例中未发现血栓栓塞的患者,可能是因为血管内介入手术后接受 WBCTPI检查的患者较少,也可能是因为CTA难以显示小血管的栓塞。


图2 男,44岁,大脑中动脉分叉部动脉瘤破裂行显微手术夹闭,术后突发意识不清。a)术前CTA示左侧大脑中动脉分叉部动脉瘤(箭);b)术后CTA示动脉瘤被夹闭,但左侧大脑中动脉水平段下支闭塞(箭);c)WB-CTPI示左侧大脑半球灌注异常,与右侧相比CBF,CBV下降,TTP、TTD和MTT明显延长;d)随访CT示左侧颞叶和枕叶脑梗死(箭)。
数字减影血管造影(digital subtraction angiography,DSA)是诊断颅内动脉瘤及评估动脉瘤术后瘤颈残留和残腔形成的金标准,然而DSA是有创性的检查,特别是对于动脉粥样硬化的老年人,有并发脑梗死的风险[14]。CTA和MRA可无创性评估动脉瘤术后弹簧圈与父血管的关系,动脉瘤复发,残存动脉瘤颈和残腔[15-17]。但是,这些血管检查手段只能够评估血管解剖形态的异常,而无法提供血流动力学信息。本研究通过WB-CTPI证实血流灌注异常的患者,CTA根据父血管与血管夹或栓塞物的位置,可分为3型,不同分型的预后和治疗方法不同:对于Ⅰ型的6例患者,仅有2例发生梗死,其余4例患者预后较好,可采取定期随访的方法;而Ⅱ型的2例患者,都发生相应闭塞血管供血区的梗死,其预后较差,如果闭塞血管发生于MCA,可采取颞浅动脉与MCA搭桥术治疗;对于Ⅲ型的7例患者,预后较差,全部发生脑梗死,此类患者仅通过CTA检查会造成漏诊,只有结合WB-CTPI才能评估血流动力学损伤情况,早期采取治疗。
CTPI被广泛应用于评估急性脑梗死的缺血半暗带,以及慢性脑血管狭窄造成血流动力学损伤和手术治疗的疗效[6-7]。Schichor等[18]采用CTPI联和CTA评估动脉瘤术中发生血管痉挛或血管损伤等缺血事件,并报道1例动脉瘤夹闭术中CTPI诊断缺血性并发症,通过调整血管夹的位置,术后未发生明显的神经功能损害。但是,术中进行CTPI与CTA检查可能会干扰手术正常流程,由于条件限制,难以在临床常规应用。本研究是利用术后对特定患者进行WB-CTPI检查,根据血流动力学的不同,可分为三个不同阶段:①代偿期,血流动力学有损伤但未发生脑梗死,表现为TTP、TTD和MTT有延长,但CBF和CBV正常;②失代偿前期,表现为TTP、TTD和MTT有延长,CBF下降,CBV正常,此时如果及时治疗能够挽回部分缺血脑组织;③失代偿期,CBF与CBV下降,TTP、TTD和MTT延长,此时脑组织发生梗死。因此,本研究认为动脉瘤术后血管损伤与脑动脉粥样硬化或血栓导致脑梗死的血流动力学变化基本一致,对于血管损伤II型或III型的患者更容易发生失代偿期改变,可能是由于侧枝代偿不及时所致。本研究与Binaghi等和Lefournier等[19-20]报道一致,与时间相关的参数(MTT、TTP和TTD)在评估血流动力学损伤和预测脑梗死发生具有高度的敏感性,CBV的降低提示脑自动调节功能的障碍,也是预测脑梗死的重要指标。
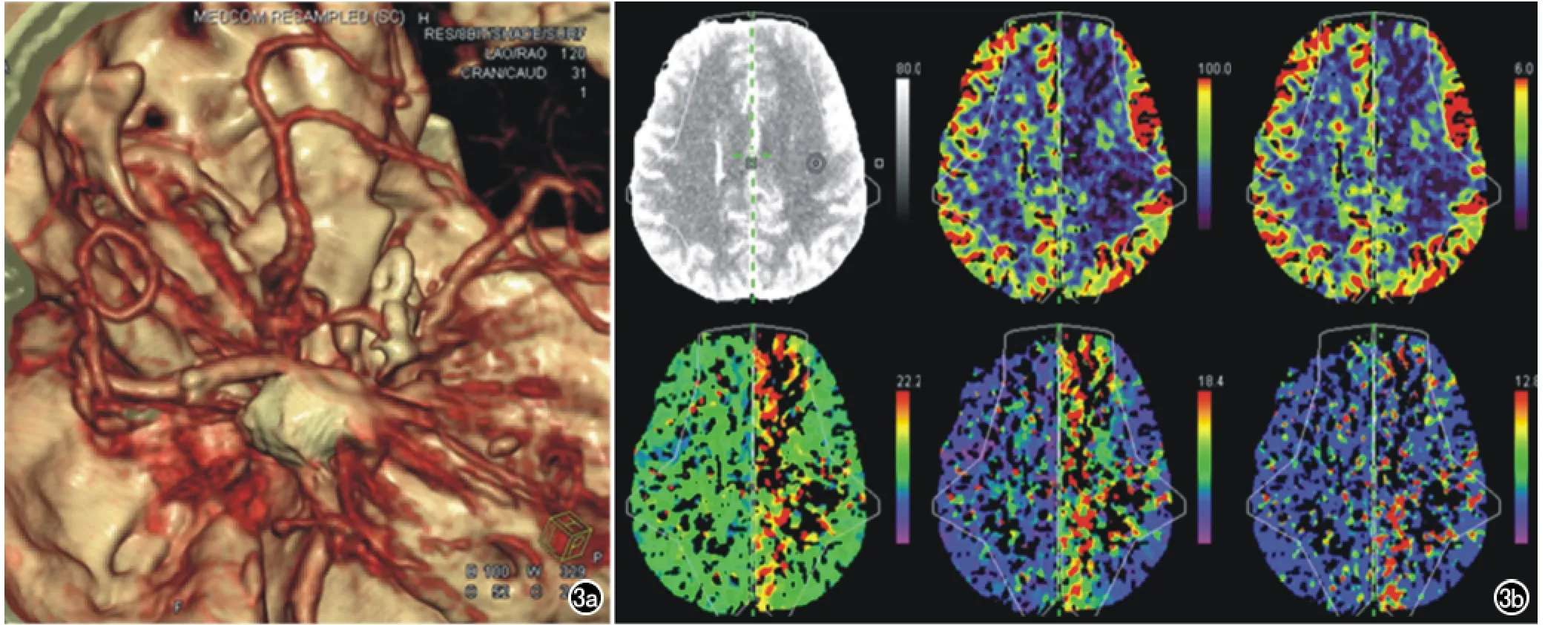

图3 男,47岁,右侧脉络膜前动脉及左侧颈内床突上段动脉瘤行显微手术夹闭和血管内介入治疗术,术后发生右侧肢体偏瘫。a)CTA图像,由于弹簧圈伪影无法观察局部血管损伤情况;b)WB-CTPI示左侧大脑半球血流灌注异常,与右侧相比,CBF和CBV降低,TTP、TTD和MTT延长;c)随访CT证实左侧额顶叶多发脑梗死(箭)。
本研究存在两个缺陷:①为了防止血管夹或栓塞物伪影的干扰,在测量灌注值时笔者忽略了有伪影的层面,可能会造成数据的误差;②本研究血管内介入手术接受WB-CTPI检查的患者较少,因此无法对两种手术方法造成的并发症进行对比。
综上所述,WB-CTPI结合CTA不仅能够有效的评估颅内动脉瘤术后缺血并发症发生,对血管损伤进行分型,而且能够根据血流动力学损伤情况进行脑梗死预测,指导临床治疗。
[1] Steiner T,Juvela S,Unterberg A,et al.European stroke organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage[J].Cerebrovasc Dis,2013,35(2):93-112.
[2] 中华医学会神经外科学分会神经介入学组.颅内动脉瘤血管内介入治疗中国专家共识[J].中华医学杂志,2013,93(39):3093-3103.
[3] Oishi H,Yamamoto M,Shimizu T,et al.Endovascular therapy of 500small asymptomatic unruptured intracranial aneurysms[J].AJNR,2012,33(5):958-964.
[4] Umredkar A,Gupta SK,Khandelwal N,et al.Intracerebral infarcts following clipping of intracranial aneurysms:incidence,clinical correlation and outcome[J].Br J Neurosurg,2010,24(2):156-162.
[5] Juvela S,Siironen J,Kuhmonen J.Hyperglycemia,excess weight,and history of hypertension as risk factors for poor outcome and cerebral infarction after aneurysmal subarachnoid hemorrhage[J].J Neurosurg,2005,102(6):998-1003.
[6] Thierfelder KM,Sommer WH,Baumann AB,et al.Whole-brain CT perfusion:reliability and reproducibility of volumetric perfusion deficit assessment in patients with acute ischemic stroke[J].Neuroradiology,2013,55(7):827-835.
[7] Cheng XQ,Tian JM,Zuo CJ,et al.Hemodynamic alterations in unilateral chronic middle cerebral artery stenosis patients and the effect of percutaneous transluminal angioplasty and stenting:a perfusion-computed tomography study[J].Acta Radiol,2014,doi:10.1177/0284185114538793.http://acr.sagepub.com/content/early/2014/07/03/0284185114538793.long.
[8] Morhard D,Wirth CD,Fesl G,et al.Advantages of extended brain perfusion computed tomography:9.6cm coverage with time resolved computed tomography-angiography in comparison to standard stroke-computed tomography[J].Invest Radiol,2010,45(7):363-369.
[9] Van Swieten JC,Koudstaal PJ,Visser MC,et al.Interobserver agreement for assessment of handicap in stroke patients[J].Stroke,1988,19(5):604-607.
[10] Bulters DO,Santarius T,Chia HL,et al.Causes of neurological deficits following clipping of 200consecutive ruptured aneurysms in patients with good-grade aneurysmal subarachnoid haemorrhage[J].Acta Neurochir(Wien),2011,153(2):295-303.
[11] Im SH,Han MH,Kwon OK,et al.Endovascular coil embolization of 435small asymptomatic unruptured intracranial aneurysms:procedural morbidity and patient outcome[J]AJNR,2009,30(1):79-84.
[12] Kan P,Jahshan S,Yashar P,et al.Feasibility,safety,and periprocedural complications associated with endovascular treatment of selected ruptured aneurysms under conscious sedation and local anesthesia[J].Neurosurgery,2013,72(2):216-220.
[13] Pierot L,Cognard C,Anxionnat R,et al.CLARITY investiga-tors:ruptured intracranial aneurysms:factors affecting the rate and outcome of endovascular treatment complications in a series of 782patients(CLARITY study)1[J].Radiology,2010,256(3):916-923.
[14] Kaufmann TJ,Huston 3rd J,Mandrekar JN,et al.Complications of diagnostic cerebral angiography:evaluation of 19,826consecutive patients[J].Radiology,2007,243(3):812-819.
[15] Fahrendorf DM,Goericke SL,Oezkan N,et al.The value of dualenergy CTA for control of surgically clipped aneurysms[J].Eur Radiol,2011,21(10):2193-2201.
[16] Serafin Z,Strzesniewski P,Lasek W,et al.Comparison of remnant size in embolized intracranial aneurysms measured at follow-up with DSA and MRA[J].Neuroradiology,2012,54(12):1381-1388.
[17] 赵艳娥,宁辉,郑玲,等.双能量CT虚拟单能谱成像技术在脑动脉瘤夹闭术后评估中的应用[J].放射学实践,2014,29(9):988-992.
[18] Schichor C,Rachinger W,Morhard D,et al.Intraoperative computed tomography angiography with computed tomography perfusion imaging in vascular neurosurgery:feasibility of a new concept[J].J Neurosurg,2010,112(4):722-728.
[19] Binaghi S,Colleoni ML,Maeder P,et al.CT angiography and perfusion CT in cerebral vasospasm after subarachnoid hemorrhage[J].AJNR,2007,28(4):750-758.
[20] Lefournier V,Krainik A,Gory B,et al.Perfusion CT to quantify the cerebral vasospasm following subarachnoid hemorrhage[J].J Neuroradiol,2010,37(5):284-291.
[21] Qureshi AI,Janardhan V,Hanel RA,et al.Comparison of endovascular and surgical treatments for intracranial aneurysms:an evidence-based review[J].Lancet Neurol,2007,6(9):816-825.