小鼠骨髓间充质干细胞对呼吸道合胞病毒毛细支气管炎小鼠模型的免疫调节作用
2015-03-18刘金凤
刘金凤
(河北省丰宁县医院,河北 丰宁 068350)
小鼠骨髓间充质干细胞对呼吸道合胞病毒毛细支气管炎小鼠模型的免疫调节作用
刘金凤
(河北省丰宁县医院,河北 丰宁 068350)

目的 探讨小鼠骨髓间充质干细胞(BMSCs)对呼吸道合胞病毒(RSV)毛细支气管炎小鼠的免疫调节作用,为毛细支气管炎的治疗提供新的思路和依据。方法 采用RSV鼻腔接种法制作毛细支气管炎小鼠模型;通过贴壁培养法体外分离纯化扩增BMSCs,使用第3代(P3)BMSCs作为实验细胞;将60只3周BALB/C小鼠随机分成模型组、BMSCs组、磷酸缓冲液(PBS)组、健康组,每组15只,BMSCS治疗组和PBS组分别经尾静脉注射BMSCs和PBS,24 h后处置,经流式细胞术检测Treg和Th17细胞百分率;收集外周血和肺泡灌洗液(BALF),ELISA法检测IL-4、IFN-γ、IL-10、TGF-β和IL-17细胞因子表达水平。结果与健康组相比,模型组Treg百分率降低,Th17百分率升高,差异均有统计学意义(P均<0.01);与模型组相比,BMSCs组Treg百分率升高,Th17百分率下降,差异均有统计学意义(P均<0.01)。模型组IL-4、IL-17水平高于健康组(P均<0.05),IFN-γ、IL-10、TGF-β水平低于健康组(P均<0.05);BMSCs组IL-4、IL-17水平明显低于模型组(P均<0.05),IL-10、TGF-β水平明显高于模型组(P均<0.05),IL-17表达水平显著高于健康组(P<0.05);BMSCs组IL-10、TGF-β表达水平高于模型组(P均<0.05)。结论 BMSCs对RSV毛细支气管炎小鼠模型有积极的免疫调节作用,通过纠正Th1/Th2和Treg/Th17失衡,达到治疗毛细支气管炎的作用。
骨髓间充质干细胞;毛细支气管炎;细胞因子;免疫调节
毛细支气管炎是婴幼儿常见的呼吸道疾病,且多发生于2岁以内的小儿,多由呼吸道合胞病毒(RSV)感染引起[1]。临床上主要表现为发作性喘憋、咳嗽和“三凹征”,常伴有呼气相哮鸣音和低热。目前研究认为其是一种特殊类型的肺炎,也称之为喘憋性肺炎。临床中多采用白三烯调节剂、沙丁胺醇、布地奈德或静脉注射糖皮质激素治疗,尚无安全有效的疫苗和特效药物。骨髓间充质干细胞(BMSCs)是来源于中胚层的一类具有自我更新及多向分化能力的干细胞,是近年来干细胞领域研究热点之一。因其具有炎症部位聚集和趋向性,故可能对治疗RSV毛细支气管炎有一定作用。本研究探讨了BMSCs对RSV毛细支气管炎小鼠模型的免疫调节作用,现将结果报道如下。
1 实验资料
1.1材料 SPF级、3周BALB/C小鼠,雌雄不拘,体质量14~15 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2006-0009。实验过程中对动物的处置符合中华人民共和国科技部2006年颁发的《关于善待实验动物的指导性意见》标准。
1.2主要试剂及仪器 胎牛血清(FBS)、细胞培养液L-DMEM(美国Gibco公司),胰蛋白酶(Sigma公司),荧光标记抗鼠抗体(美国BD公司),流式细胞仪(美国Coulter-Elite公司),倒置显微镜(日本OLYMPUS公司),ELISA检测试剂盒(美国R&D公司),小鼠外周血单核细胞分离液(上海博耀生物科技有限公司)。
1.3小鼠BMSCs的分离与培养(贴壁分离法) 小鼠脱颈处死,于75%乙醇中浸泡3~4 min,无菌状态下取双侧股骨放在装有L-DMEM培养液的玻璃皿中,用无菌纱布擦去肌肉,培养液反复冲洗,再用剪刀剪开骨两端,用1 mL一次性无菌注射器冲出骨髓于另一15%FBS的L-DMEM完全培养液中,反复吹打,抽吸,形成单细胞悬液,以1 000 r/min离心5 min;去上清,15%FBS L-DMEM完全培养液重悬沉淀,接种至25 cm2培养瓶中。37 ℃、5%CO2恒温培养箱中培养;2 d后首次换液,以后每隔2~3 d换液1次,待细胞铺满瓶底约90%,进行1∶2传代。取第3代(P3)纯化的BMSCs作为实验细胞,用胰蛋白酶消化制成细胞悬液,调整密度约为1×109L-1待用。
1.4分组及模型制备 将60只小鼠分为健康组、模型组、磷酸缓冲液(PBS)组、BMSCs组,每组15只。除健康组外,其余组采用鼻腔接种法制作毛细支气管炎小鼠模型[2-3]。造模成功后,PBS组和BMSCs组分别通过尾静脉注射法输注0.5 mL PBS和BMSCs细胞悬液。
1.5外周血和肺泡灌洗液(BALF)收集 输注24 h后,小鼠经眼球摘除放血后处死,血液放入2 mL抗凝管,-20 ℃备用;切开气管后置入留置针,并以缝线固定,0.8 mL PBS灌洗,反复2次,回收率80%以上,4 ℃、1 500 r/min离心10 min,回收上清置于-80 ℃进行细胞因子检测[4]。
1.6流式细胞仪检测单个核细胞表型 使用等体积生理盐水稀释抗凝血,加入塑料离心管中细胞分离液表面,以450 g离心25 min收集单个核细胞,参照李营营等[2]方法经流式细胞仪检测外周血调节T细胞(Treg)和Th17的表达情况。
1.7BALF中白细胞介素-4(IL-4)、IL-10、γ干扰素(IFN-γ)、TGF-β和IL-17细胞因子检测 操作步骤均按照ELISA试剂盒所附说明书进行。

2 结 果
2.1各组细胞免疫表型检测情况 模型组外周血Treg百分率显著低于健康组(P<0.01),Th17细胞百分率显著高于健康组(P<0.01);BMSCs组外周血Treg百分率显著高于模型组(P<0.01),Th17细胞百分率显著低于模型组(P<0.01)。见表1。
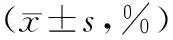
表1 各组外周血Treg百分率和Th17细胞百分率比较
注:①与模型组比较,P<0.01。
2.2各组IL-4、IL-10、IL-17、IFN-γ和TGF-β水平比较 模型组IL-4、IL-17水平高于健康组(P均<0.05),IFN-γ、IL-10、TGF-β水平低于健康组(P均<0.05);BMSCs组IL-4、IL-17明显低于模型组(P均<0.05),IL-10、TGF-β水平明显高于模型组(P均<0.05)。见表2。
3 讨 论
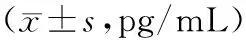
表2 各组IL-4、IL-10、IL-17、IFN-γ及TGF-β水平比较
注:①与健康组比较,P<0.05;②与模型组比较,P<0.05。
BMSCs是近年来医学和生物学领域中最引人注目的干细胞之一,但其在骨髓中的含量极少,平均每1万个有核细胞中仅有1个,所以根据BMSCs具有贴壁生长的特性,目前普遍采用贴壁培养法和percoll分离法进行分离纯化,获得纯度较高的稳定的BMSCs。本研究正是在这种方法基础上进行改良培养,对小鼠BMSCs培养血清选择Gibco顶级胎牛血清,控制血清培养液比例10%~15%,原代培养时使细胞相对密度较大,48 h首次换液,之后每隔2~3 d换液1次,这样就能保证原代培养的细胞长满瓶底约90%,传代培养以1∶2比例进行,这样培养到P3代的细胞纯度较高,分化比例低,为小鼠干细胞体内移植提供细胞材料。
目前有研究表明,BMSCs具有免疫调节作用,可以通过下调固有免疫细胞和获得性免疫细胞的活性来抑制机体的免疫反应[5]。崔蕾等[6]将人BMSCs移植治疗大鼠急性肺损伤,结果治疗组较对照组血浆促炎因子、肿瘤坏死因子α、IL-6等明显降低,IL-10明显升高,表明BMSCs对急性肺损伤有一定保护作用,使肺内炎性递质和抗炎递质保持平衡,从而阻止炎症继续进展。李营营等[2]通过人脐带对毛细支气管炎大鼠模型免疫调节作用研究显示,RSV毛细支气管炎大鼠体内存在Th1/Th2失衡及Treg/Th17失衡。因此可以利用干细胞免疫调节这一特性,对肺损伤相关疾病进行病理机制和免疫调节研究。
BALB/c小鼠为近交繁殖产生,对多种病原体具有易感性,选择利用小鼠建立RSV模型的优点是它易获得,遗传背景清楚均一,基因改造技术成熟,是目前应用最广泛的实验动物。小鼠感染RSV后肺部的炎症变化与人类一致,为典型的间质性肺炎的表现。本研究参考近年来的相关文献研究,采用鼻腔接种法建立RSV小鼠模型,可以用于RSV感染的发病机制及治疗的研究。
以表达IL-2和IFN-γ为主的Th1型细胞和以表达IL-4、IL-6、IL-10为主的Th2型细胞,使机体存在Th1/Th2平衡状态[7],机体Th1/Th2一旦失衡则可以引起多种疾病,如哮喘的发病机制即与其密切相关[8],与哮喘有着相似临床症状的毛细支气管炎也与Th1/Th2失衡关系密切[8-9]。本研究显示,毛细支气管炎发病时,IFN-γ低于健康组,IL-4高于健康组,经BMSCs治疗后,IL-4水平下降,提示存在Th1/Th2失衡,但具体机制有待进一步研究。
免疫调节中另一重要的机制即为Treg/Th17平衡[10-12],本研究结果显示,与健康组相比,模型组Treg水平降低,Th17水平升高,同时Treg分泌的IL-10和TGF-β细胞因子表达降低,经BMSCs治疗后,Treg上升,Th17下降。推测Treg可能参与了RSV毛细支气管炎病理生理的发生发展过程,引起Th2应答增强,导致炎症增加,促进Th17分泌IL-17,引起炎症反应。提示毛细支气管炎存在与哮喘类似的气道炎症。
综上所述,BMSCs移植入毛细支气管炎小鼠体内,对一系列的细胞和细胞因子都具有积极的调节作用,通过降低IL-4,升高IFN-γ,降低Th17细胞,升高Treg来纠正Th1/Th2和Treg/Th17失衡,达到治疗毛细支气管炎的作用,但具体机制和治疗方案有待进一步研究。
[1] Terry P,Klassen MD,MSC,FRCPC. Recent advances in the treatment of bronchiolitis[J]. Pediatric Clinics of North Am,1997,44(1):249
[2] 李营营,李洪波,吴福玲,等. 人脐带间充质干细胞对毛细支气管炎大鼠模型免疫调节作用[J]. 中华微生物学和免疫学杂志,2014,34(5):348
[3] 廉国利,俞海国,赵晓东,等. 小鼠呼吸道合胞病毒感染模型的建立[J]. 西安交通大学学报:医学版, 2003,24(4):329-332
[4] 侯长春,赵海金,蔡绍曦,等. 支气管哮喘小鼠模型肺组织和肺泡灌洗液高迁移率族蛋白B1的表达及地塞米松的干预作用[J]. 南方医科大学学报,2010,30(9):2051-2054
[5] Corcione A,Benvenuto F,Ferretti E,et al. Human mesenchymal stem cells modulate B-cell functions[J]. Blood,2006,107(1):367-372
[6] 崔蕾,雷鑫,牛玉虎,等. 人脐带间充质干细胞移植治疗大鼠急性肺损伤[J]. 中国组织工程研究,2013,17(14):2563-2569
[7] 魏海明,刘杰,田志刚. 检测Th1/Th2亚群的临床意义[J]. 中华医学检验杂志,1998,21(1):56-59
[8] Lan F,Liu K,Zhang J,et al. Th17 response is augmented in OVA-induced asthmatic mice exposed to HDM[J]. Med Sci Monit,2011,17(5):BR132-138
[9] 刘晓梅,崔振泽. 毛细支气管炎与哮喘相关性的研究进展[J]. 医学综述,2011,17(5):738-741
[10] 张文林,张建军,姚明荣,等. Th1、Th2、Th17和Treg研究现状[J]. 医药前沿,2012,2(13):29-30
[11] 李宾,吴福玲,冯学斌,等. 呼吸道合胞病毒毛细支气管炎患儿外周血CD4+、CD25+调节性T细胞与Th17细胞功能变化及意义[J]. 细胞与分子免疫学杂志,2012,28(4):426-428
[12] Chen Z,Lin F,Gao Y,et al. FOXP3 and RORrt:transcriptional regulation of Treg and Th17[J]. Int Immunopharmacol,2011,11(5):536-542
Immunomodulation of mice bone marrow mesenchymal stem cells In mice with respiratory syncytial virus bronchiolitis
LIU Jinfeng
(Fengning County Hospital, Fengning 068350, Hebei, China)
Objective It is to study the immunomodulation of mice bone marrow mesenchymal stem cells in mice with respiratory syncytial virus bronchiolitis, so to provide new ideas and basis for the treatment of bronchiolitis. Methods Respiratory syncytial virus (RSV) was dripped through nose into mice, to establish an murine model. Obtaining BMSCs cells through the method of adherent culture. Sixty three-week old BALB/C mice were randomly divided into four groups: health control group, model group, PBS group, BMSCs group.PBS group and BMSCs group were injected with PBS and BMSCs by tail vein injection, then experimenting after 24h. Treg and Th17 cellular percentage were detected by FCM, BALF was collected and the levels of cytokines such as IL-4, IFN-γ, IL-10, IL-10, TGF-βand IL-17 were determined by ELISA. Results The percentage of Treg was significantly lower and the percentage of Th17 was higher in model group than that in health group(P<0.05); Compared with the model group, the percentage of Treg was higher and the percentage of Th17 was lower in BMSCs group(P<0.05). Compared with the health group, the level of IL-4 was higher, the level of IFN-γ was lower in model group(P<0.05). On the contrary, compared with the model group, the level of IL-4 was lower(P<0.05) and the level of IFN-γ was higher(P>0.05). The level of IL-10 and TGF-β were lower and the level of IL-17 was higher in model group than that in health group(P<0.05). The level of IL-10 and TGF-β were higher and the level of IL-17 was lower in BMSCs group than model group(P<0.05). Conclusion The immunomodulation of BMSCs in mice with respiratory syncytial virus bronchiolitis was activity, which can correct the Th1/Th2 and Treg/Th17 imbalances, thus to treat for cellular percentage.
bone marrow mesenchymal stem cells; bronchiolitis; cytokine; immunomodulation
刘金凤,女,副主任医师,主要从事儿科临床及教学工作。
10.3969/j.issn.1008-8849.2015.08.005
R-332
A
1008-8849(2015)08-0811-03
2014-09-15
