半滑舌鳎IGF1基因编码区的多态性与生长性状及表达的相关性分析❋
2015-03-18黄政举温海深李吉方司玉凤赵君丽任源远徐捷凯中国海洋大学水产学院山东青岛266003
黄政举, 何 峰, 温海深, 李吉方, 司玉凤, 赵君丽, 任源远, 邢 德, 徐捷凯(中国海洋大学水产学院, 山东 青岛 266003)
半滑舌鳎IGF1基因编码区的多态性与生长性状及表达的相关性分析❋
黄政举, 何 峰❋❋, 温海深, 李吉方, 司玉凤, 赵君丽, 任源远, 邢 德, 徐捷凯
(中国海洋大学水产学院, 山东 青岛 266003)
胰岛素样生长因子1(IGF1)在鱼类生长内分泌调节过程中发挥着重要的调控作用。本研究检测了半滑舌鳎(Cynoglossussemilaevis)IGF1基因外显子的单核苷酸多态性(SNPs),分析其基因型与生长性状、血液生化指标的关系及基因表达的相关性。结果显示,IGF1基因外显子5的884bp处一个位点发生突变,此突变处碱基C变为A,即C884A,此突变发生于终止密码子之后,并且发生在WD40结构域,可能会对基因的转录、表达和生长性状产生影响。此位点与体重(P<0.05)、去内脏重(P<0.05)呈显著相关性,AA基因型的体重和去内脏重显著高于AB基因型(P<0.05),AA基因型的尿素含量显著大于AB基因型(P<0.05),AA基因型的mRNA表达量也显著高于AB基因型(P<0.05)。研究表明,IGF1基因编码区的多态性对半滑舌鳎的生长性状、血液生化指标和基因表达有显著影响,IGF1基因可以作为选择育种的一种分子标记,从遗传学的角度辅助半滑舌鳎优良品种的分子选育。
IGF1基因; 半滑舌鳎; 单核苷酸多态性; 血液生化; 生长性状; 基因表达
半滑舌鳎(Cynoglossussemilaevis)主要分布在中国的渤海和黄海,是一种暖温性近海大型底层鱼类,其味道鲜美、经济价值较高,近年来已成为中国重要的养殖品种之一[1]。半滑舌鳎的雄性个体比雌性个体小的多,因此人们需要优选雄性个体,以加速雄性个体的品质改良[2]。单核苷酸多态性被广泛应用于相关的候选基因的研究,是第三代重要的遗传标记技术[3]。
生长激素-胰岛素样生长因子(GH-IGF)系统在调控脊椎动物生长的过程中扮演着重要的角色。生长激素轴(Somatotropicaxis)是由下丘脑-垂体-生长激素-靶器官上有关激素及其受体所组成的神经内分泌轴[4]。垂体产生的生长激素(GH)首先与生长激素结合蛋白(GHBP)结合,经血液运至肝细胞,然后与肝细胞上的受体相结合,刺激IGF1的产生[4]。然后IGF1与IGF1结合蛋白结合,经血液运送至各组织器官,与各组织器官上的IGF1受体相结合,促进细胞的生长与分化[4]。在鱼类,IGF主要受GH在生长促进方面的影响并且受生长的自分泌、旁分泌和内分泌方面的调控[5-6]。GH能够促进各种组织中IGF1和IGF2的合成。一些研究显示,肝中注射GH可以提高虹鳟(Oncorhynchusmykiss)、斑点叉尾鮰(Ictaluruspunctateus)和黑鲫(Carassiuscarassius)的肝中IGF1和IGF2的合成[7-9]。IGF1和IGF2分别与受体结合,通过PI3K/AKT/TOR和MAPK/ERK 2条信号通路来促进骨骼肌的生长[10]。
IGF1在生长和发育的过程中起着重要的作用。IGF1基因的单核苷酸多肽性可以影响动物的代谢、生长、寿命和疾病等相关性状[11-12]。基因的多态性在哺乳动物(尤其是家畜、家禽)中研究的较多,如印度肉鸡IGF1基因启动子的多态性对于其基因表达和生长有显著影响[13]。一年生菜牛的IGF1基因的多态性与体重有显著关系[12]。而鱼类IGF1基因的报道还比较少,文献[14]研究了黑鲈(Micropterussalmoides)IGF1基因5′端区域的多态性与生长性状有显著相关性[14]。Ma等人克隆了半滑舌鳎IGF1基因并研究了其mRNA的表达[15]。IGF1的主要功能是调节生长和发育,其mRNA表达量高意味着生长能力强。如日本花鲈(Lateolabraxjaponicus)IGF1基因mRNA的表达与生长性状有着重要的关系[16]。银鲑(Oncorhynchuskisutch) 肝中IGF1基因mRNA的表达水平也与生长性状显著相关[17]。这些结果表明,IGF1基因mRNA的表达水平可能是生长的一个指标,同时也说明IGF1基因可以作为动物生长发育的候选基因。在鱼类生长指标中,血液指标是鱼类生长的一个很重要的反映特征,血液反映了鱼类的生理生化状态,也可以评价其健康状况、营养水平以及环境中水质的情况等。性别、种类、年龄、选用的饲料和疾病等都可以影响鱼类血液的生理生化指标[18]。基因型的改变对鱼类血液生理生化指标也可能产生影响。因此,研究鱼类血液生化指标对于研究鱼类的生长也很重要。
半滑舌鳎IGF1基因(GenBank Accession No. FJ608667.1)是由5个外显子组成的,包含937个核苷酸,编码197个氨基酸。目前,还没有半滑舌鳎IGF1基因多态性的报道,本研究的目的是寻找半滑舌鳎IGF1基因多态性,研究其对半滑舌鳎的生长性状、血液生化、基因表达的影响,以筛选出大量的雄性优良品种,来改善遗传资源。
1 材料与方法
1.1 材料
半滑舌鳎来自于青岛嘉洋高新水产育苗养殖基地。随机选取亲本来源相同的72尾同龄的二龄雄鱼,这些雄鱼具有类似的尺寸,平均体长32.00cm和平均体重225.00g。将其饲养在自然海水中(温度(20±0.5) ℃;O2≥4ng/mL;光周期(H∶L=14∶10)),喂食商业饲料。
在实验室暂养1d,不进行投喂。对鱼进行麻醉,静脉取血。解剖各组织器官于分子管中,放于-80 ℃,便于随取随用,同时称量鱼的肝重、性腺重和去内脏重。计算肝重指数、性腺指数:
肝重指数HSI=[肝重/(体重-去内脏重)]×100,
性腺重指数GSI=[性腺重/(体重-去内脏重)]×100。
1.2 方法
1.2.1 DNA提取和PCR扩增 用酚-氯仿法提取肌肉组织中的基因组DNA,用琼脂糖凝胶电泳法检测DNA完整性,并用超微核酸蛋白测定仪(BD-1000)测量DNA的浓度。根据Genebank中IGF1基因的cDNA的序列,用primer premier 5软件设计了5个引物(见表1)。PCR总反应体系共25 μL,包括模板DNA 1 μL,dNTP 0.2 mmol/L,10×PCR buffer 2.5 μL,引物各0.20 mmol/L和Easy Taq DNA酶0.5 U。反应程序为双链DNA,94 ℃预变性5 min;94 ℃变性45 s,退火45 s,72 ℃延伸45 s,40个循环;72 ℃ 10 min。扩增的PCR产物用琼脂糖凝胶进行检测。

表1 半滑舌鳎IGF1基因外显子的扩增引物
1.2.2 PCR-SSCP检测 6 μL PCR产物与10.8 μL变性buffer(98%去离子甲酰胺,0.01 mol/L EDTA, 0.025%亚甲基蓝,0.025%溴酚蓝,0.2%甘油)混合,在PCR仪中98 ℃ 10 min,然后立即放于冰箱-20 ℃静置10 min以上。变性的PCR产物进行10%的聚丙烯酰胺凝胶电泳,在冰箱4 ℃下电泳7~10h。然后电泳结果进行银染,进行DNA分型。剩余的PCR产物用DNA胶回收试剂盒(TIANGEN,China)进行纯化,蓝白斑筛选后进行不同基因型的测序。
1.2.3 激素和血液生理生化指标测定 用125I放射免疫测定法检测血液中的四碘甲状腺原氨酸(T3)和三碘甲状腺原氨酸(T4)水平[19]。另外,作者用自动化分析仪检测了一些血液生化指标像总蛋白、血清白蛋白、血尿酸、尿素、总胆固醇、甘油三酸酯、葡萄糖、钙和磷(迈瑞公司BS-180,中国)。
1.2.4 RNA提取和反转录(RT-PCR) 用RNA提取试剂盒从50 mg肝组织中提取总RNA含量(TakaRa,日本),用分光光度计检测RNA浓度。A260/A280在1.8~2.0之间。1 μL RNA由反转录试剂盒反转录成cDNA(Bio-Rad)。使用反转录引物(上游引物:5′-AGTCCTTCGCTGCTGTT-3′,下游引物:5′-CCCTGTTGGTTGGCTTA-3′)进行基因148个核苷酸的扩增。反转录体系为20 μL,包括2 μL cDNA模板,每个样本0.4 μL反转录引物,10 μL SYBR荧光染料,0.4 μL ROX参照染料,0.6 μL RNA灭菌水。反应条件为95 ℃30 s,40个循环95 ℃5 s变性,60 ℃34 s退火,72 ℃30 s延伸。每个样重复3次,使用18s作为参照基因(引物:上游:5′-GAATTGACGGAAGGGCACCACCAG-3′;下游:5′-ACTAAGAACGGCCATGCACCACCAC-3′)[20]。相关表达由2-ΔΔCt方法计算获得,计算结果与18s核糖体RNA进行对比。
1.2.5 统计学分析 利用Stat View软件9.0版,通过单因素方差分析(one-way ANOVA)其突变位点和相关[21]。利用邓肯多重比较分析不同基因型均值的差异性。
2 结果
2.1 PCR扩增
提取72尾半滑舌鳎基因组DNA为模板,利用设计的引物进行PCR扩增。各引物均得到了特异性条带,其中只有引物5在后续的实验中检测到多态性,所以本文只对引物5进行详细介绍,其他不再赘述。引物5的PCR扩增结果如图1所示。扩增产物单一,且无非特异性扩增,可以进行下一步的SSCP分析。
图1 外显子5引物的PCR扩增结果
2.2 PCR-SSCP检测
采用PCR-SSCP法检测IGF1基因的单核苷酸多态性。从SSCP胶图中发现引物5的扩增片段都存在3种基因型,根据后续的测序结果将3种基因型分别定义为AA、AB和BB型,其SSCP分析结果及3种基因型的定义如图2所示。基因型频率和等位基因频率见表2,AA、AB和BB的基因型频率分别为22.22%、61.11%和16.67%。A和B的等位基因频率分别为52.78%和47.22%。

图2 IGF1基因的基因分型

位点Locus基因频率Genotypesfrequencies/%AAAB等位基因频率Allelefrequencies/%BBABSNP22.2261.1116.6752.7847.22
2.3 各基因型序列
通过银染检测到外显子5具有多态性,经进一步测序检测到突变位点,发现有1个SNP突变,即C884A。AA、AB和BB 3种基因型的序列如图3所示。

图3 IGF1基因的AA、AB和BB基因型的序列测定
2.4 突变位点基因结构位置
通过(http://www.ncbi.nlm.nih.gov/Structure/lexington/lexington.cgi?cachecdqs=QM3-data_cache-25 8478F792FA36ED-5284342CEECE1)预测IGF1基因的结构(见图4),在850~1075bp之间有一个结构域WD40。
2.5 基因型与性状的相关分析
作者做了72条鱼和11个生长性状之间关系的分析,了解到基因型与体重(P<0.05)和去内脏重(P<0.05)显著相关(见表3)。AA基因型的体重和去内脏重显著高于AB基因型(P<0.05)(见图5)。

图4 WD40结构位置的预测
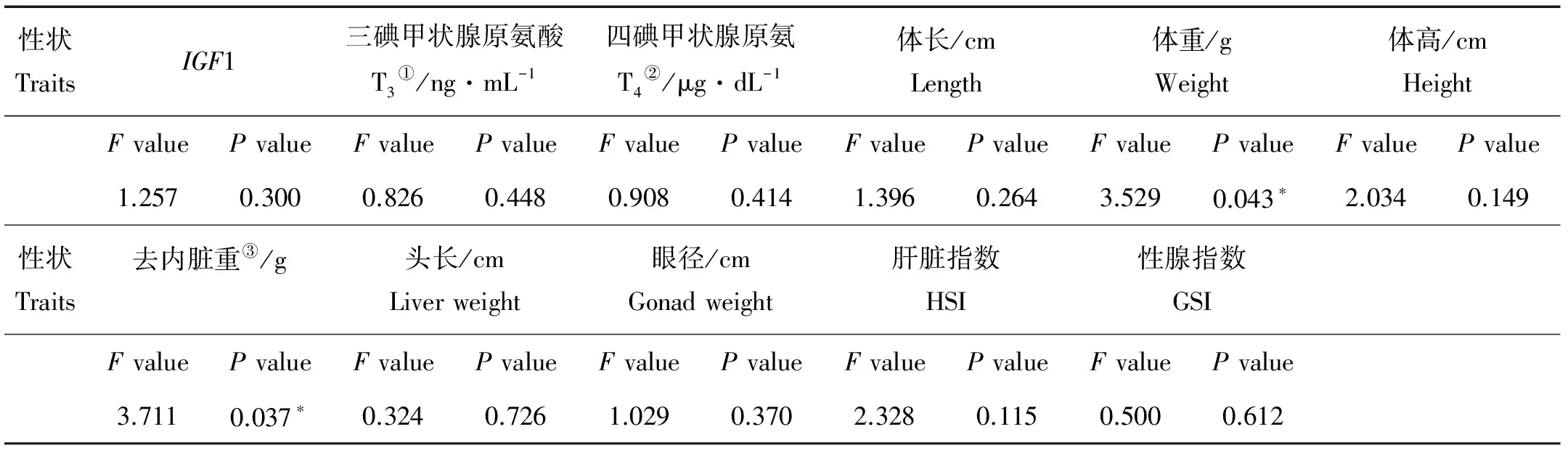
性状TraitsIGF1三碘甲状腺原氨酸T3①/ng·mL-1四碘甲状腺原氨T4②/μg·dL-1体长/cmLength体重/gWeight体高/cmHeightFvaluePvalueFvaluePvalueFvaluePvalueFvaluePvalueFvaluePvalueFvaluePvalue1.2570.3000.8260.4480.9080.4141.3960.2643.5290.043∗2.0340.149性状Traits去内脏重③/g头长/cmLiverweight眼径/cmGonadweight肝脏指数HSI性腺指数GSIFvaluePvalueFvaluePvalueFvaluePvalueFvaluePvalueFvaluePvalue3.7110.037∗0.3240.7261.0290.3702.3280.1150.5000.612
注:*:P<0.05.①Triiodothyrontne;②Tetraiodothyronine;③Weight without viscera
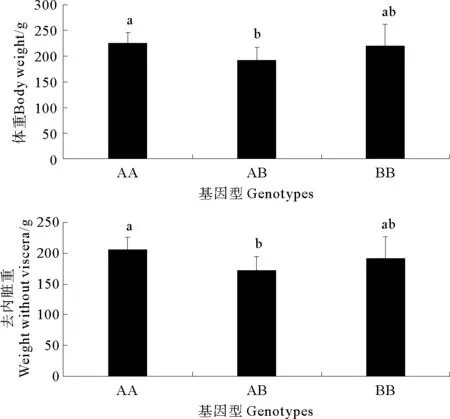
(误差线上的不同字母表示差异显著(P<0.05)。Different letters above the error bars means significant difference atP<0.05.)
图5 不同基因型生长性状的多重比较
Fig.5 Multiply comparison of growth trait among different genotypes
2.6 血液生化与生长性状的相关分析
通过分析显示AA基因型的尿素(UREA)值显著高于AB基因型(P<0.05),其结果列于表4。
2.7 基因型与表达的相关分析
肝中IGF1基因外显子5各基因型的表达量进行比较分析,结果显示AA基因型的表达量显著高于AB基因型(P<0.05)(见图6)。
3 讨论
生长激素(GH)/胰岛素样生长因子1(IGF1)轴是人类体细胞生长的关键调节因子,并且其基因在研究生长个体的突变上是重要的候选基因[22]。IGF是一类多肽,它调节着脊椎动物生长和细胞代谢的各个阶段[14]。特别是IGF1,它在脊椎动物代谢活动,生长和发育中扮演着重要的角色。在鱼类,IGF1在生长的调控方面也起到了重要的作用[23]。
对于生长轴基因,文献[21]已经报道了半滑舌鳎GH基因和生长激素受体基因(GHR)的多态性对于生长性状的显著影响,而对于IGF1基因研究的还比较少。黑鲈IGF1基因5′端区域的多态性与生长性状有着密切的关系[14]。印度山羊在不同年龄阶段IGF1基因的单核苷酸多态性对生长性状有着重要作用[24]。类似的,在本文的研究中,发现半滑舌鳎IGF1基因外显子5上发生突变,即C884A,与体重和去内脏重有着显著的关系(P<0.05)。因为遗传多态性可能对编码蛋白质区域以外的部分造成影响,非编码序列的RNAs也可能对基因表达产生影响[25]。类跨膜通道蛋白1(TMC1)基因外显子3的非编码序列的突变被证明与伊朗耳聋家族有关[26]。与本研究相类似,突变位点位于终止密码子之后,但是仍对生长性状,血液生化和基因表达产生显著影响。特别是该位点位于WD40区,这种典型的结构:从N端开始,有11~24个生长激素二肽的残基,从C端开始有40个色氨酸-天冬氨酸的残基所以叫WD40[27]。在GH和WD之间有一个保守的核心,持久稳定地发挥着促进作用,像螺旋桨一般,蛋白质通过这个平台可以稳固或可逆地结合在一起。这个像螺旋桨一样的核心实际上是由几叶“桨片”组成的,每叶“桨片”又是由四股反向平行的Β折叠片组成的;作者猜测这些物质或多或少通过重复(这种复制拷贝是可以观察到的)二聚化的形式来形成更大的结构;每一个WD40重复序列形成了一叶“桨片”中的三股,和下一叶中的一股;C端的WD40重复序列完成了第一个WD40重复结构的“桨片”结构,这样一个闭合环状的结构就是“螺旋桨”的一部分。“螺旋桨”顶部和底部表面的残基将被用于调节与其它蛋白或配体的相互作用[27]。884 bp处C→A的突变正好位于WD结构域,其在生物体中主要参与信号转导,转录调控以及RNA剪切等基因调控作用。真核细胞中WD40结构域在信号转导过程中,参与前体mRNA的加工以及细胞骨架的集合装配等多种多样的功能,因此其位点的突变必然对基因的转录和表达产生作用[28]。
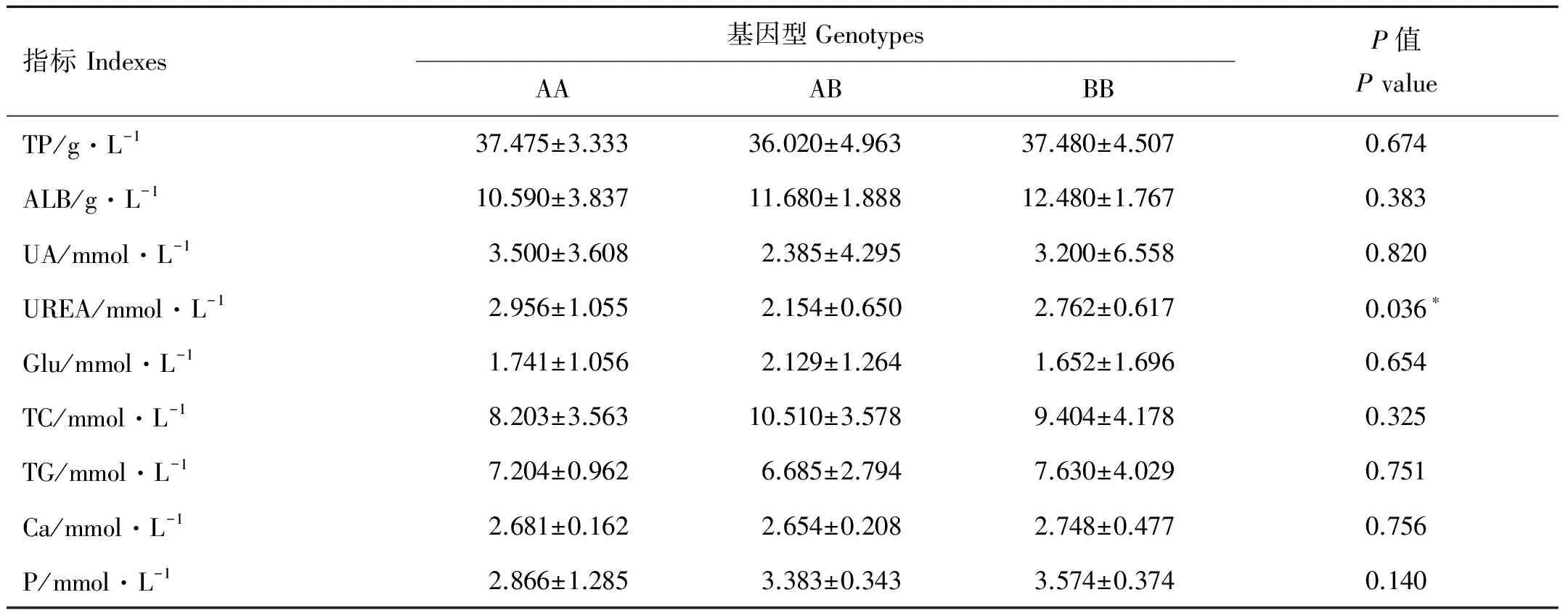
表4 不同基因型生理生化指数的相关性
Note: *:P<0.05
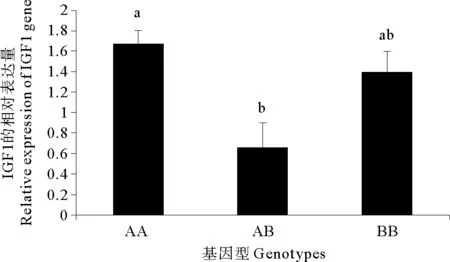
(误差线上的不同字母表示差异显著(P<0.05)。Different letters above the error bars means significant difference atP<0.05.)
图6 不同基因型的相对表达量
Fig.6 Relative expression of different genotypes
在早期的研究中,肝在总蛋白、血清白蛋白、血尿酸、尿素、总胆固醇、甘油三酸酯、葡萄糖、钙和磷的基础代谢上起着关键的作用,肝的损伤可能会改变血液生化指标,并且肝的损伤会影响一系列结构和生化组成上的改变[29],这与本文的研究相一致。肝中提取IGF1基因序列发生突变对于血液生化有着显著的影响,所以,AA基因型的尿素含量显著高于AB基因型(P<0.05)。这可能是因为肝中IGF1基因型的改变影响着其DNA的结构,对代谢(尿素)产生影响。
Nolten等报道在心脏、鳃、肌肉、肠和肝中都发现了IGF1肽,但实时定量PCR分析显示,肝比其它的组织有更高的IGF1基因表达量[30]。另外,IGF1基因的表达量的降低是胎儿生长受限的关键因素[31]。对于兔子来说,其高生长的个体会有更高的IGF1基因的表达量[32]。这些研究都表明,IGF1基因的表达与生长是正相关关系。Carnevali等研究了黑鲈、斑点叉尾鮰、和罗非鱼(Tilapia)的IGF1基因,结果都表明,IGF1基因有着更高的mRNA的表达量的基因型有着更高的生长表现型[33-35]。这与本文的研究一致,AA基因型的体重和去内脏重显著高于AB基因型(P<0.05),这和AA基因型的基因表达量也显著高于AB基因型(P<0.05)是一致的。这些研究都更加确认了肝IGF1在半滑舌鳎生长的过程中起了关键的作用。尽管外显子5上的突变发生在终止子之后,但其仍然对基因表达有着很大的调控作用,所以在表现型上才有很大的差别。可以选择AA基因型进行培育,扩大养殖,从而培育出更加优良的性状。
[1] 房子恒. 不同盐度对半滑舌鳎幼鱼生长的影响及其生理生态学机制的研究 [D]. 青岛: 中国海洋大学, 2013.
[2] 李虎, 陈四清, 刘海金, 等. 半滑舌鳎养殖群体的性比与雌雄形态差异比较 [J]. 水产学报, 2012, 36(9): 1331-1336.
[3] Vignal A, Milan D, SanCristobal M, et al. A review on SNP and other types of molecular markers and their use inanimal genetics [J]. Genet Sel Evol, 2002, 34: 275-305.
[4] 范炜, 殷红, 李春风, 等. 胰岛素样生长因子1调节生长发育的研究进展 [J]. 黑龙江畜牧兽医, 2013(1): 19-22.
[5] Le Roith D, Bondy C, Yakar S, et al. The somatomedin hypothesis: 2001 [J]. Endocr Rev, 2001, 22(1): 53-74.
[6] Reindl K M, Sheridan M A. Peripheral regulation of the growth hormone-insulin-like growth factor system in fish and other vertebrates [J]. Comp Biochem Phys A, 2012, 163(3): 231-245.
[7] Shamblott M J, Cheng C M, Bolt D, et al. Appearance of insulin-like growth factor mRNA in the liver and pyloric ceca of a teleost in response to exogenous growth hormone [J]. P Natl Acad Sci USA, 1995, 92(15): 6943-6946.
[8] Peterson B C, Bosworth B G, Bilodeau A L. Differential gene expression ofIGF-I,IGF-II, and toll-like receptors 3 and 5 during embryogenesis in hybrid (channel× blue) and channel catfish [J]. Comp Biochem Phys A, 2005, 141(1): 42-47.
[9] Zhong H, Zhou Y, Liu S, et al. Elevated expressions ofGH/IGFaxis genes in triploid crucian carp[J]. Gen Comp Endocr, 2012, 178(2): 291-300.
[10] Fuentes E N, Valdés J A, Molina A, et al. Regulation of skeletal muscle growth in fish by the growth hormone-Insulin-like growth factor system[J]. Gen Comp Endocr, 2013, 192(1): 136-148.
[11] Moraa M, Perales M J, Serra-Prat M, et al. Aging phenotype and its relationship with IGF-I gene promoter polymorphisms in elderly people living in Catalonia [J]. Growth Horm IGF Res, 2011, 21(3): 174-180.
[12] Pereira A P, Alencar M M, Oliveira H N, et al. Association ofGHandIGF-1 polymorphisms with growth traits in a synthetic beef cattle breed [J]. Genet Mol Biol, 2005, 28(2): 230-236.
[13] Pandey N K, Singh R P, Saxena V K, et al. Effect ofIGF1 gene polymorphism and expression levels on growth factors in Indian colored broilers [J]. Livest Sci, 2013, 155(2): 157-164.
[14] Li X H, Bai J J, Ye X, et al. Polymorphisms in the 5′flanking region of the insulin-like growth factor I gene are associated with growth traits in largemouth bass [J]. Fish Sci, 2009, 75(2): 351-358.
[15] Ma Q, Liu S F, Zhuang Z M, et al. Molecular cloning, expression analysis of insulin-like growth factor I (IGF-I) gene and IGF-I serum concentration in female and male Tongue sole (Cynoglossus semilaevis) [J]. Comp Biochem Phys B, 2011, 160(4): 208-214.
[16] Men K, Ai Q, Mai K, et al. Effects of dietary corn gluten meal on growth, digestion and protein metabolism in relation toIGF-Igene expression of Japanese seabass, Lateolabrax japonicas [J]. Aquaculture, 2014, 428-429: 303-309.
[17] Duan C, Plisetskaya E M, Dickhoff W W, et al. Expression of insulin-like growth factor I in normally and abnormally developing coho salmon(Oncorhynchus kisutch) [J]. Endocrinology, 1995, 136(2): 446-452.
[18] 韩娜娜. 半滑舌鳎和塞内加尔鳎血液生理生化指标的研究 [D]. 青岛: 中国海洋大学, 2011.
[19] He F, Wen H, Yu D, et al. Single nucleotide polymorphism of FSHβ gene associated with reproductive traits in Japanese flounder (Paralichthys olivaceus) [J]. Journal of Ocean University of China, 2010, 9(4): 395-398.
[20] Ponce M, Infante C, Funes V, et al. Molecular characterization and gene expression analysis of insulin-like growth factors I and II in the redbanded seabream,: transcriptional regulation by growth hormone [J]. Comp Biochem Phys B, 2008, 150(4): 418-426.
[21] 赵君丽. 雄性半滑舌鳎GH/IGF-1轴相关基因SNP和DNA甲基化与生长性状的相关性研究 [D]. 青岛: 中国海洋大学, 2014.
[22] Hendriks A E J, Brown M R, Boot A M, et al. Common polymorphisms in theGH/IGF-1 axis contribute to growth in extremely tall subjects [J]. Growth Horm IGF Res, 2011, 21(6): 318-324.
[23] Silverstein J T, Wolters W R, Shimizu M, et al. Bovine growth hormone treatment of channel catfish: strain and temperature effects on growth, plasmaIGF-Ilevels, feed intake and efficiency and body composition [J]. Aquaculture, 2000, 190(1): 77-88.
[24] Sharma A, Duttb G, Sivalingam J, et al. Novel SNPs inIGF1,GHRandIGFBP-3 genes reveal significant association with growth traits in Indian goat breeds [J]. Small Ruminant Res, 2013, 115(1): 7-14.
[25] Hrdlickova B, Almeida R C, Borek Z, et al. Genetic variation in the non-coding genome: Involvement of micro-RNAs and long non-coding RNAs in disease [J]. Bba-Mol Basis Dis, 2014, 1842(10): 1910-1922
[26] Elham D, Sirous Z, Nejat M, et al. A transversion mutation in non-coding exon 3 of the TMC1 gene in two ethnically related Iranian deaf families from different geographical regions; evidence for founder effect [J]. Int J Pediatr Otorhi, 2013, 77(5): 821-826.
[27] Vander Kooi C W, Ren L, Xu P, et al. The Prp19 WD40 domain contains a conserved protein interaction region essential for its function[J]. Structure, 2010, 18(5): 584-593.
[28] Ritterhof S, Farah C M, Grabitzki J, et al. The WD40-repeat protein Han11 functions as a scaffold protein to control HIPK2 and MEKK1[J]. Embo J, 2010, 29(22): 3750-3761.
[29] Tan Q, Liu Q, Chen X, et al. Growth performance, biochemical indices and hepatopancreatic function of grass carp, Ctenopharyngodon idellus, would be impaired by dietary rapeseed meal [J]. Aquaculture, 2013, 414(15): 119-126.
[30] Nolten L A, Steenbergh P H, Sussenbach J S, et al. Hepatocyte nuclear factor 1 alpha activates promoter 1 of the human insulin-like growth factor I gene via two distinct binding sites [J]. Mol Endocrinol, 1995, 9(11): 1488-1499.
[31] Koutsakia M, Sifakis S, Zaravinos A, et al. Decreased placental expression ofhPGH,IGF-IandIGFBP-1 in pregnancies complicated by fetal growth restriction [J]. Growth Horm IGF Res, 2011, 21(1): 31-36.
[32] Jing W Q, Li F C. Effects of Dietary Lysine on Growth Performance, Serum Concentrations of Insulin-Like Growth Factor-I (IGF-I) andIGF-ImRNA Expression in Growing Rabbits[J]. Arg Sci China, 2010, 9(6): 887-895.
[33] Carnevali O, Vivo L, Sulpizio R, et al. Growth improvement by probiotic in European sea bass juveniles (Dicentrarchus labrax, L.), with particular attention toIGF-1, myostatin and cortisol gene expression[J]. Aquaculture, 2006, 258(1): 430-438.
[34] Small B C, Peterson B C. Establishment of a time-resolved fluoro immunoassay for measuring plasma insulin-like growth factor I (IGF-I) in fish: effect of fasting on plasma concentrations and tissue mRNA expression ofIGF-Iand growth hormone (GH) in channel catfish (Ictalurus punctatus) [J]. Dommest Anim Endocrin, 2005, 28(2): 202-215.
[35] Schmid A C, Lutz A, Kloas W, et al. Thyroid hormone stimulates hepaticIGF-ImRNA expression in a bony fish, the tilapia Oreochromis mossambicus, in vitro and in vivo [J]. Gen Comp Endocr, 2005, 142(1): 22-24.
责任编辑 朱宝象
The Polymorphism in the Coding Region ofIGF1 Related to mRNA Expression Pattern and Growth Traits of Half-Smooth Tongue Sole (Cynoglossussemilaevis)
HUANG Zheng-Ju, HE Feng, WEN Hai-Shen, LI Ji-Fang, SI Yu-Feng, ZHAO Jun-Li, REN Yuan-Yuan, XING De, XU Jie-Kai
(College of Fishery, Ocean University of China, Qingdao 266003, China)
Insulin-like growth factor 1 (IGF1) is involved in the growth endocrine regulation of many fish species. The purpose of this study was to detect the single nucleotide polymorphism (SNP) in the coding region ofIGF1 and analyze the relationships among genotypes, growth traits, serum levels of physiological and biochemical indexes and gene expression in half smooth tongue sole (Cynoglossussemi-laevis). A mutation at 884 bp position was detected in exon 5 ofIGF1, which was named C884A. This mutation occurred after termination codon in the structure of WD40 domain, thus influenced the transcription, growth characteristics among others. This mutation has significant correlations with body weight (P<0.05) and viscera weight (P<0.05). AA genotype was significantly higher than AB genotype in weight (P<0.05) and viscera weight (P<0.05). The UERA content of AA genotype was significantly higher than the AB genotype (P<0.05). At the same time, the expression of AA genotype was also significantly higher than AB genotype (P<0.05). These results indicated that the polymorphism ofIGF1 in encoding region was significantly associated with the growth traits, blood physiological and biochemical indexes and gene expression in half smooth tongue. The mutation can be used as a molecular marker for selection breeding. Our findings may assist molecular breeding of good varieties from a genetic perspective and improve the production in half smooth tongue sole.
IGF1 gene; half-smooth tongue sole; SNPS; biochemical index; growth trait; gene expression
国家高技术研究发展计划项目(2012AA10A403);国家大学生创新创业训练计划项目(201310423043)资助
2014-06-17;
2014-09-25
黄政举(1987-),女,硕士生,研究方向:鱼类生理与繁育。
❋❋ 通讯作者: E-mail:hefengouc@ouc.edu.cn
S917.4
A
1672-5174(2015)08-019-07
10.16441/j.cnki.hdxb.20140194
