产超广谱β-内酰胺酶大肠杆菌耐药性分析及耐药基因检测
2015-03-16周翼,魏威
周 翼,魏 威
(1.四川省乐山市中医医院检验科 614000;2.南方医科大学生物技术学院,广州 5105155)
·临床探讨·
产超广谱β-内酰胺酶大肠杆菌耐药性分析及耐药基因检测
周 翼1,魏 威2
(1.四川省乐山市中医医院检验科 614000;2.南方医科大学生物技术学院,广州 5105155)
目的 分析产超广谱β-内酰胺酶(ESBLs)大肠杆菌的耐药性,并检测相关耐药基因,为临床合理用药提供参考。方法 采用纸片扩散法对乐山市中医医院的产ESBLs大肠杆菌分离、确认;采用纸片扩散法和自动化仪器法对筛选出来的菌株进行药敏试验,探讨产ESBLs大肠杆菌菌株对临床常用药物的耐受情况;采用聚合酶链反应(PCR)检测耐药基因TEM、SHV 和CTX-M-1、CTX-M-2,了解分离得到的菌株的耐药遗传学特征,获得医院耐药菌株的主要基因型。结果 经患者的痰液、消化液、血液及切口脓液等处分离得到大肠杆菌164株,其中产ESBLs 104株。产ESBLs大肠杆菌对头孢类抗菌药物的耐药率较高,其中头孢他啶、头孢拉啶、头孢噻啶的耐药率均为100.0%;对β-内酰胺类抗菌药物耐药率较低,且对亚胺培南、美罗培南的耐药率均为0,产ESBLs菌株对常见抗菌药物的耐药率明显高于非产ESBLs菌株的耐药率;产ESBLs菌中检出CTX-M-2型41株(39.5%)、CTX-M-1型30株(28.9%)、SHV型18株(17.3%)和TEM型15株(14.4%)。结论 产ESBLs大肠杆菌在感染患者病原菌中占据一定的比重,其对常用抗菌药物的耐药率明显高于非产ESBLs大肠杆菌,临床应加强对产ESBLs大肠杆菌的认识,以指导临床治疗。
β-内酰胺酶;大肠杆菌; 耐药分析; 耐药基因
随着抗菌药物的广泛使用,大肠杆菌对常用抗菌药物的耐药性正在不断增加,耐药性大肠杆菌所致感染也已经成为抗感染治疗的巨大挑战[1-2]。由于大肠杆菌目前为三甲医院分离率第一的临床菌株,其产生的超广谱β-内酰胺酶(ESBLs)由质粒介导,易在同种属甚至不同种属细菌间传递造成暴发流行,是患者感染治愈困难的主要原因[3]。近年来,随着医院检验技术及检验设备的不断完善,乐山市中医院亦分离出大量产ESBLs大肠杆菌。本研究旨在通过对乐山市中医医院产ESBLs大肠杆菌耐药性及耐药基因的检测,为临床用药治疗提供参考。耐药基因中TEM、SHV和CTX-M基因是ESBLs大肠杆菌中最常见的3个基因家族,具有极佳的代表性,故选择这3个基因进行检测分析[4]。现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2009年2月至2010年5月乐山市中医医院收治的门诊及住院感染患者256例,所有患者均符合感染诊断标准。从患者的痰液、消化液、血液及切口脓液等部位连续分离病原菌,并采用美国BD公司生产的全自动细菌鉴定仪对病原菌进行鉴定,将其中的大肠杆菌作为研究标本进行收集。质控菌株:大肠杆菌ATCC25922,均购自成都生物研究所。
1.2 方法
1.2.1 药敏试验 用头孢他啶、头孢噻肟和含克拉维酸的头孢他啶、头孢噻肟纸片验证产ESBLs大肠杆菌,用包含头孢菌素类、碳青酶烯类、喹诺酮类、氨基糖苷类、磺胺类和氯霉素等18种药敏纸片探讨菌株对临床常用药物的耐受情况。采用K-B纸片扩散法及全自动仪器法,操作和结果判定按NCCLS标准进行。中介、敏感在本研究中判定为耐药[5]。
1.2.2 聚合酶链反应(PCR)检测耐药基因 采用PCR检测耐药基因家族TEM、SHV 和CTX-M,确定分离得到的菌株中含有的基因,初步了解其耐药的遗传学特征。针对3个耐药基因设计相应的特异性引物,总共设计引物3对;使用商业化质粒提取试剂盒从筛选分离的菌株中提取得到质粒作为 PCR 扩增反应的模板;利用 PCR 技术,应用设计的3对引物对每个模板进行检测,看菌株中是否存在TEM、SHV 和CTX-M基因。

2 结 果
2.1 产ESBLs菌株耐药性 经患者的痰液、消化液、血液及切口脓液分离得到大肠杆菌164株,其中产ESBLs 104株。产ESBLs大肠杆菌对头孢类抗菌药物的耐药率较高,其中头孢他啶、头孢拉啶、头孢噻啶的耐药率均为100.0%;对β-内酰胺类抗菌药物耐药率较低,且对亚胺培南、美罗培南的耐药率均为0,产ESBLs菌株对常见抗菌药物的耐药率明显高于非产ESBLs菌株的耐药率(P<0.05),见表1。
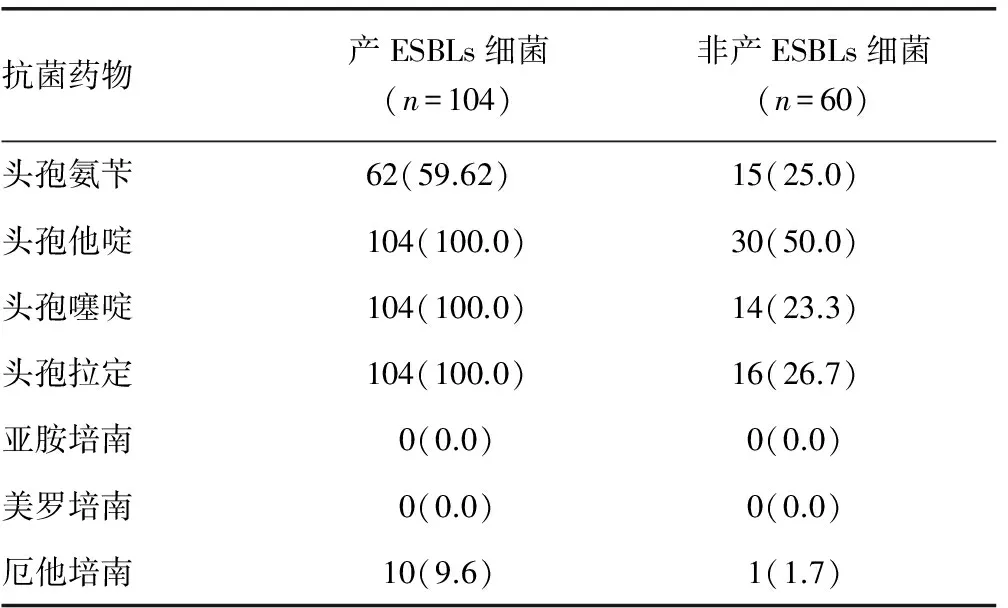
表1 大肠杆菌产ESBLs菌株与非ESBLs菌株耐药率比较[n(%)]
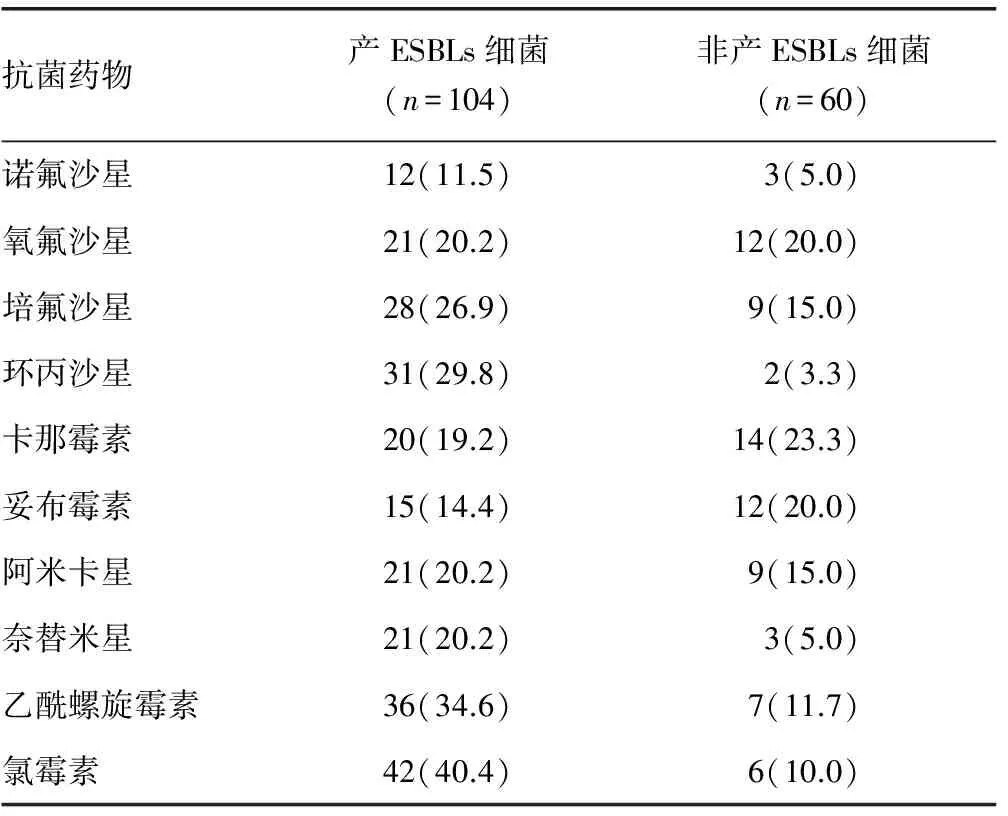
续表1 大肠杆菌产ESBLs菌株与非ESBLs菌株耐药率比较[n(%)]
2.2 产ESBLs菌耐药基因分型 产ESBLs菌中检出CTX-M-2型41株(39.5%)、CTX-M-1型30株(28.9%)、SHV型18株(17.3%)和TEM型15株(14.4%)。
3 讨 论
ESBLs又称氧亚氨β-内酰胺酶,是指由细菌质粒介导的、能水解甲氧亚氨基β-内酰胺类抗菌药物如头孢他啶、头孢噻肟,以及氨曲南等的一类酶[6-7]。产ESBLs菌可以通过结合、转化、转导等形成耐药基因在细菌间扩散,从而造成严重的交叉感染。目前,大肠杆菌、肺炎克雷伯菌是最常见产ESBLs菌株的细菌。其次,阴沟肠杆菌、黏质沙雷氏菌、弗劳地枸橼酸菌、铜绿假单胞菌也可出现产ESBLs菌株的细菌。细菌所产生的重要抗菌药物灭活酶主要有β-内酰胺酶和氨基糖苷类抗菌药物钝化酶。β-内酰胺酶能裂解青霉素族和头孢菌素族抗菌药物的基本结构β-内酰胺环,从而使其丧失抗菌活性。
根据基因同源性的不同,目前将ESBLs分为5类,即TEM型、SHV型、CTX-M型、OXA型和其他类型如Toho、PER、VEB等基因型。其中CTX-M型又可以分为4组(Ⅰ组包括CTX-M-1、3、10、11、12、15、22、23、28、29、30;Ⅱ组包括CTX-M-2、4、5、6、7、20、Toho-1;Ⅲ组包括CTX-M-8、25、26;Ⅳ组包括CTX-M-9、13、14、16、17、18、19、21、27、Toho-2)。TEM和SHV型是目前世界上大多数国家如美国、英国、法国等欧美国家流行的主要基因型,而我国则以CTX-M型为主并兼有SHV、TEM型报道。本组资料中,经患者的痰液、消化液、血液及切口脓液等处分离得到大肠杆菌164株,其中产ESBLs 104株。产ESBLs菌中检出CTX-M-2型41株(39.5%)、CTX-M-1型30株(28.9%)、SHV型18株(17.3%)和TEM型15株(14.4%)。这和国内其他地区医院报道的耐药基因型比例类似。产ESBLs大肠杆菌对头孢类抗菌药物的耐药率较高,其中头孢他啶、头孢拉啶、头孢噻啶的耐药率均为100.0%;对β-内酰胺类抗菌药物耐药率较低,且对亚胺培南、美罗培南的耐药率均为0,产ESBLs菌株对常见抗菌药物的耐药率明显高于非产ESBLs菌株的耐药率。这和其他国内学者报道的抗菌药物耐药性存在较大差异,可能和不同地区经济发展水平及所使用的抗菌药物谱存在较大差异有关。因此,加强对本地区本医院产ESBLs大肠杆菌耐药性的认识,采用针对性的抗菌药物进行治疗,才具有实际意义,其他地区和医院产ESBLs大肠杆菌耐药情况不能作为本地区本医院用药参考。
综上所述,产ESBLs大肠杆菌在感染患者病原菌中占据一定的比重,其对常用抗菌药物的耐药率明显高于非产ESBLs大肠杆菌,临床应加强对产ESBLs大肠杆菌的认识,以指导临床治疗。
[1]熊杰,杨继勇,邹自英,等.临床血液分离大肠埃希菌株耐药性及生物被膜形成分析[J].重庆医学,2012,41(35):3699-3701.
[2]李佩波,蔡敏泓,黄永茂,等.Ⅰ类整合子在耐多药产ESBLs大肠埃希菌中的分布探讨[J].重庆医学,2012,41(6):547-549.
[3]刘勇,曹霖.ICU产ESBLs肺炎克雷伯菌与大肠埃希菌医院内感染临床危险因素分析[J].重庆医学,2012,41(26):2762-2764.
[4]Shahin NP,Majid E,Mojtaba M,et al.High prevalence of bla CTX-M-1 group extended-spectrum β-lactamase genes in escherichia coli isolates from tehran[J].J Micr,2013,6(7):366-370.
[5]Zhang CH,Zhang XG,Shen YS,et al.Study on the resistance of extended spectrum β-Lactamases[J].J Ani Veter Advan,2013,10(8):36-42.
[6]Egea P,Lopez-Cerero L,Torres E,et al.Increased raw poultry meat colonization by extended spectrum beta-lactamase-producing Escherichia coli in the south of Spain[J].Int J Food Microbiol,2012,159(2):69-73.
[7]Akpaka PE,Legall B,Padman J,et al.Detection of CTX-M-1 beta lactamase gene in Escherichia coli isolated from clinical samples by Polymerase Chain Reaction (PCR)[J].West Indian Med J,2011,69(1):591-596.
四川省教育厅科研项目(13ZB0308)。
10.3969/j.issn.1672-9455.2015.13.051
A
1672-9455(2015)13-1935-03
2015-01-22
2015-03-18)
