大黄素对大鼠肝脏毒性的实验研究*
2015-03-15闵晓春韩宗儒张晓雨沈启刚上海市嘉定区中心医院感染科200018
闵晓春,韩宗儒,张晓雨,姚 勤,沈启刚(上海市嘉定区中心医院感染科 200018)
大黄素对大鼠肝脏毒性的实验研究*
闵晓春,韩宗儒△,张晓雨,姚 勤,沈启刚(上海市嘉定区中心医院感染科 200018)
目的 探讨不同剂量的大黄素对大鼠肝脏的损害程度。方法 给予SD大鼠不同剂量的大黄素灌胃(依次为3、6、12 mg/(kg·g),每日1次,连续2个月,分别于用药后20、40、60 d观察其一般状况、体质量,检测大鼠血常规、生化指标及肝脏组织病理情况。结果 大鼠各剂量组与对照组间一般状况及体质量,差异无统计学意义(P>0.05);各剂量组与对照组间血常规及谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL),差异也无统计学意义(P>0.05)。肝脏病理显示各组肝小叶结构完整,中央静脉未见扩张,汇管区无增生,未见炎性细胞浸润,部分剂量组大鼠肝细胞可见脂肪变性及细胞水肿,但差异无统计学意义(P>0.05)。结论 大黄素长期、大剂量灌胃对大鼠无明显肝损害。
何首乌; 大黄素; 肝损害; 毒性实验
何首乌是常用补益中药,近年来有关何首乌引起肝脏损伤的不良反应时有报道。有研究表明,何首乌对肝脏的毒性可能与其中的蒽醌类物质有关,而大黄素是主要的蒽醌化合物[1]。体外细胞实验显示,随着浓度增高、作用时间延长,大黄素对健康者肝细胞有明显的抑制作用[2]。目前动物体内实验少有报道,本研究将健康远交群(SD)大鼠作为研究对象,检测其摄入不同剂量大黄素后的状况及相关指标,以进一步探讨大黄素对肝脏的损伤情况及其量-毒规律,报道如下。
1 资料与方法
1.1 一般资料 无特定病原体(SPF)级SD大鼠(120~140 g)140只,雌雄各半,购自上海西普尔-必凯实验动物有限公司,合格证号为SCXK(沪)2008001628882。动物饲养于上海海军医学研究所,许可证号为SYXK(沪)2012-0033。饲养环境:温度20~25 ℃,湿度40%~70%,雌雄分开,每笼5只。
1.2 仪器与试剂 美国雅培AEROSET全自动生化分析仪;法国ABX pentra60 血细胞分析仪;德国Zeiss公司MICROM-340M切片机;英国Shandon 公司Hypereonler XP 型组织脱水机。大黄素、羧甲基纤维素钠粉末购自南京泽朗医药有限公司;肝功能检测试剂盒购自罗氏诊断产品(上海)有限公司。
1.3 分组及药物剂量 将大鼠随机分成5组,每组27只,为大黄素大剂量[12 mg/(kg·g)]、中剂量[6 mg/(kg·g)]、小剂量[3 mg/(kg·g)]组、溶剂对照组(等体积羧甲基纤维素钠溶液)、空白对照组(等体积蒸馏水),3个水平剂量组,分别是临床用药的10、20、40倍;每日灌胃给药1次(1 mL/100 g大鼠体质量),每周称体质量1次,根据体质量调整药量,连续给药60 d。
1.4 实验方法 (1)一般状况观察:每周称体质量1次,每天观察用药后大鼠精神状态、毛色、进食、排泄物、活动等情况。(2)血常规及肝功能检测:分别于用药后20、40、60 d采集大鼠血液,检测其血常规及谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)。(3)病理检测:分别于给药后20、40、60 d处死部分大鼠,摘取肝脏,观察其形态、颜色、质地,并进行肝脏组织病理检查。

2 结 果
2.1 一般情况 用药期间,大鼠进食、排泄物、活动情况正常,毛色无异常变化,各组无病死例数。
2.2 大鼠体质量 雄、雌大鼠在给药20、40、60 d时体质量均在正常范围,各组之间比较,差异无统计学意义(P>0.05)。表1、2。
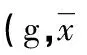
表1 各组雄性大鼠给药60 d体质量变化±s)
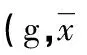
表2 各组雌性大鼠给药60 d体质量变化±s)
2.3 血常规检测 大鼠在给药20、40 d时血常规各指标均在正常范围内,各剂量组与对照组之间比较,差异无统计学意义(P>0.05);给药60 d时血常规各指标也在正常范围内,各剂量组与对照组之间,差异也无统计学意义(P>0.05)。见表3。
2.4 肝功能检测 大鼠在给药20、40 d时ALT、AST、TBIL各剂量组与对照组之间比较,差异无统计学意义(P>0.05);给药60 d时各剂量组与对照组之间比较,差异也无统计学意义(P>0.05)。见表4。
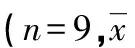
表3 大鼠给药60 d时血常规检测结果比较±s)
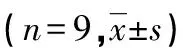
表4 大鼠给药60 d时肝功能检测结果比较
2.5 肝脏组织病理学检测 (1)肉眼观察:对照组及各剂量组大鼠肝脏,其形态正常,质地柔软,红润光泽,未见结节、包块、囊肿等。(2)HE染色后光镜下观察:20、40 d时,对照组及各剂量组大鼠肝小叶结构正常,肝细胞未见肿胀、坏死,中央静脉未见扩张,汇管区无增生,未见炎性细胞浸润,部分肝细胞可见小泡性脂肪变性,40 d时部分肝细胞出现轻度浊肿,但各组之间比较,差异无统计学意义(P>0.05);60 d时肝小叶结构完整,肝细胞边界清晰,中央静脉未见扩张,汇管区无增生,未见炎性细胞浸润,部分肝细胞可见大、小泡性脂肪变性,部分肝细胞出现轻、中度水样变性,但各组之间比较,差异无统计学意义(P>0.05)。(3)MASSON染色后光镜下观察:对照组及各剂量组肝小叶及汇管区未见异常纤维增生。见图1。

A:空白对照组;B:溶剂对照组;C:小剂量组;D:中剂量组;E:大剂量组。
3 讨 论
孙震晓和张力[3]研究结果提示,何首乌中可能存在少量对肝细胞有直接毒性或经肝脏转化的有毒化学成分,临床症状与急性黄疸型肝炎相似。现代药理研究表明,何首乌主要含有蒽醌类化合物、二苯乙烯苷、磷脂等成分。目前的研究未发现何首乌肝脏毒性与磷脂类及二苯乙烯苷成分有关。有研究表明何首乌肝脏毒性与蒽醌类物质有关,而大黄素是其中主要的蒽醌化合物[1]。相关研究发现大黄素存在低剂量促进肝细胞生长、高剂量抑制肝细胞生长的特性,说明大黄素对肝细胞的作用具有双重性[4]。体外细胞实验显示,随着作用时间的延长、浓度的增高,大黄素对健康者肝细胞L02有明显的抑制作用[2]。临床上何首乌引起的肝损害表现为累积效应,当大剂量短时间或小剂量长时间服用何首乌均可能导致急性肝损害[1]。体内大黄素浓度累计达到一定阈值,就有可能引起肝脏损伤,如果患者存在相关代谢酶缺失、功能障碍或敏感体质就更容易造成[1]。目前的研究表明,药物性肝损伤的过程是多因素参与的复杂过程,其中自由基和脂质过氧化物在肝损伤中起着重要作用,经药物代谢酶产生自由基等毒性产物,引发细胞膜过氧化物及细胞结构和功能的破坏,最终导致肝细胞变性、坏死、凋亡等。其次为机体对药物的变态反应,药物剂量与疾病严重程度之间无肯定联系。然后可能与遗传因素有关,药物通过诱导或抑制肝P450酶系,从而导致治疗浓度下降或药物代谢减少,使毒性代谢产物增强或直接延长药物的作用而引起不良反应。目前临床提示何首乌引起的肝损害与用药剂量成一定的相关性,未发现药物的变态反应,并且有一定的家族性发病倾向,结合相关研究[1,5],初步推测是何首乌中的蒽醌类化合物或其毒性产物对肝脏的直接损害,并可能对肝细胞P450酶系统产生一定影响[6-7]。
本研究以不同剂量的大黄素给大鼠灌胃用药(分3个水平的剂量组,以制首乌成人用药每日30 g计[8],经折算分别相当于临床用药的10、20、40倍),观察大黄素对大鼠肝脏的损伤程度。本组一般毒性观察结果显示,在整个用药期间,大鼠进食、活动正常,毛色无异常变化,各组无动物病死例数。与对照组比较,大鼠各剂量组之间体质量在用药各个阶段点,差异无统计学意义(P>0.05),提示大黄素连续灌胃给药无明显系统性毒性。血常规多次检测结果与对照组比较,差异无统计学意义(P>0.05)。肝功能检测表明,与对照组比较,不同剂量大黄素用药的大鼠血清ALT、AST、TBIL水平,差异无统计学意义(P>0.05),提示大黄素对大鼠肝功能无明显损伤。肝脏病理结果显示,对照组及各剂量组大鼠肝小叶结构正常,肝细胞未见坏死,中央静脉未见扩张,汇管区无增生,未见炎性细胞浸润,部分肝细胞可见大小泡性脂肪变性及细胞水肿,但各组之间比较,差异无统计学意义(P>0.05),这与ALT、AST水平结果一致,显示长期较大剂量大黄素用药对大鼠肝脏无明显损害。
综上所述,长期较大剂量大黄素灌胃用药未见明显肝损害,符合大黄素对肝细胞双重作用的特性[4]。有关研究报道小剂量大黄素可以对四氯化碳(CCl4)等引起的大鼠肝脏损伤具有保护作用,可直接抑制大鼠肝星状细胞增殖、细胞外基质的合成。还有实验表明,大鼠体内的CCl4可诱导细胞色素P450酶活性及超微结构的改变,而小剂量范围内的大黄素可逆转这种改变[9-10]。尽管体外实验提示随着作用时间延长、浓度增高,大黄素对健康者肝细胞有明显抑制作用,但在实际应用中大黄素是否对动物肝细胞有损伤尚不明确,本研究结果提示目前临床常用剂量的使用较安全,至于剂量用多大、持续时间将对肝脏造成损害尚不能确定。关于其引发肝细胞损伤的机制有待进一步研究。
[1]方红玫,朱廷焱.何首乌有效成分、毒性作用和相关研究进展[J].国际药学研究杂志,2010,37(4):283-286.
[2]孙向红,孙玉维,李红,等.何首乌主要成分大黄素、大黄酸和二苯乙烯苷对肝细胞、肝癌细胞的影响[J].现代中西医结合杂志,2010,19(11):1315-1319.
[3]孙震晓,张力.何首乌及其制剂相关肝损害国内文献回顾与分析[J].药物不良反应杂志,2010,12(1):26-30.
[4]张瑞晨,刘斌,孙震晓,等.何首乌提取物对人正常肝细胞L02周期阻滞及凋亡的影响[J].中西医结合学报,2010,8(6):554-561.
[5]卫培峰,党艳丽,焦晨莉.何首乌不同成分与肝细胞凋亡的相关性研究[J].陕西中医,2009,30(2):238-239.
[6]Bhadauria M,Shrivastava S,Nirala SK,et al.Emodin reverses CCl4 induced hepatic cytochrome P450(CYP)enzymatic and ultrastructuralchanges.The in vivo vidence[J].Hepatol Res,2009,39(11):290-300.
[7]胡锡琴,林飞,李娅琳.何首乌、制何首乌与茯苓配伍对大鼠肝微粒体细胞色素P450的影响[J].陕西中医,2009,30(2):240-241.
[8]田代华.实用中药辞典[M].北京:人民卫生出版社,2003:952-954.
[9]展玉涛,李定国,沈礼勇,等.大黄素抗肝纤维化的细胞学机制[J].临床肝胆病杂志,2006,22(1):43-44.
[10]张欣,党双锁,程延安,等.大黄素和黄芪多糖对实验性肝损伤大鼠肝脏超微结构的影响[J].西安交通大学学报:医学版,2009,30(4):502-505.
Experimental study on the tocicology of emodin in polygonum multiflorum to the rats′liver*
MINXiao-chun,HANZong-ru△,ZHANGXiao-yu,YAOQin,SHENQi-gan
(DepartmentofInfectiousDisease,JiadingDistrictCentralHospital,Shanghai201800,China)
Objective To study different doses of emodin injuring effects on rats′liver.Methods The SD rats were infused with emodin,different dosages [3,6,12 mg/(kg·g)]once a day,60 days.The general condition of rats and weight were observed.The rats′blood samples were taken on the 20 d,40 d and 60 d for hematology and liver functional examination.Meanwile,liver tissue and liver homogenate were taken for histopathology examination.Results Compared with the control groups,the experimental groups which were given different dosages have no significant difference on the general condition,weight,indexes of hematology and liver function.Pathologic examination displayed that the structure of hepatic lobule was complete without expansion of central vein.There are no hyperplasia and infiltration of inflammatory cells in the portal area.Hepatic steatosis and edema is shown in the part of experimental groups,but show no statistical significance.Conclusion Long term use of high dose emodin for intragastric administration does no injure to SD rats′ liver.
polygonum multiflorum; emodin; liver injury; toxicity test
上海市卫生局资助项目(20114052)。
闵晓春,男,硕士,主治医师,主要从事感染性疾病的诊治研究。
△通讯作者,E-mail:zqmxcaexshq@126.com。
10.3969/j.issn.1672-9455.2015.11.011
A
1672-9455(2015)11-1522-03
2014-12-20
2015-02-18)
