栀子苷治疗糖尿病及其并发症的分子机制研究进展
2015-03-15朱迪娜辛文锋张文生
朱迪娜 辛文锋 张文生
栀子苷治疗糖尿病及其并发症的分子机制研究进展
朱迪娜 辛文锋 张文生
糖尿病是一种以慢性高血糖为特征的代谢性疾病,可引起多种并发症,主要表现在全身微循环的障碍,如肾、眼、心血管及神经等慢性损伤。栀子苷是栀子的主要有效成分,其水解苷元为京尼平。有研究报道,栀子苷具有降低血糖,改善糖尿病并发症病理变化的作用,有望成为糖尿病治疗的潜在药物。本文对近年来栀子苷和京尼平治疗糖尿病的相关研究进行总结,以期为深入研究其治疗糖尿病的分子机制提供思路。
糖尿病; 栀子苷; 京尼平; 分子机制
糖尿病(diabetes mellitus,DM) 是一类由糖代谢紊乱而引起的以长期高血糖为主要特征的代谢性疾病,可导致多种并发症,包括肾衰竭、视网膜病变、心血管疾病、足溃疡以及神经损伤等[1-3]。临床上根据糖尿病发生的病因,将糖尿病分为四类,即胰岛素依赖型( I型糖尿病) 、非胰岛素依赖型( II型糖尿病)、继发性糖尿病以及妊娠糖尿病,其中II型糖尿病占所有糖尿病患者比例的90%以上,成为当前危害人类健康的最主要疾病之一[4]。目前,治疗和控制糖尿病的主要药物仍以西药为主,包括双胍类、磺酰脲类、噻唑烷酮类、格列奈类和α-糖苷酶抑制剂等,严重时也可直接选用胰岛素治疗[5]。长期口服上述药物,不良反应明显,尤其不适于肝、肾功能不全的患者。因此,从天然药物中筛选和发现治疗糖尿病安全有效的活性成分已引起了国内外学者的广泛关注[6-9]。
栀子苷,也称栀子甙 (Geniposide) ,是一种环烯醚萜葡萄糖苷,易溶于水,是栀子中主要活性成分,含量在 5% 左右,经β-葡萄糖苷酶水解后,可得其苷元京尼平(Genipin) 。其药理作用研究较为深入,对抗炎、降血糖、中枢神经系统、抗肿瘤、抗血栓、保肝利胆等均有明显作用[10-15]。体内外实验表明,栀子苷具有抗氧化应激、抗炎症反应以及降血糖等作用,有望成为糖尿病治疗的潜在药物。本文对近年来栀子苷和京尼平治疗糖尿病的相关研究进行总结,以期为深入研究其治疗糖尿病的分子机制提供思路。
1 降血糖作用
糖尿病是以慢性高血糖为主要特征的内分泌代谢性疾病。日本学者Kimura在1982年报道了从栀子中提取得到的栀子苷具有降低血糖的作用[16]。颜静恩等[11]发现栀子苷通过激活过氧化物酶增殖体激活受体(peroxisome proliferator activated receptor,PPAR)γ,增强下游基因对胰岛素的响应,减少胰岛β细胞的凋亡,并在葡萄糖消耗试验中发现栀子苷能显著促进前脂肪细胞对葡萄糖的吸收,从而阻止II型糖尿病向I型糖尿病的转变和发展。有研究表明激活PPARγ受体信号通路可增加外周组织对胰岛素的敏感性,改善胰岛素抵抗,很可能与β细胞的生存和功能保护、修复方面存在着某种程度上的联系[17-19],提示栀子苷的降糖功效可能与PPARγ的激活密切有关。
糖尿病是一种因体内胰岛素绝对或者相对不足所导致的一系列临床综合症,目前对胰岛β细胞功能失调还没有积极的治疗方法,而该种功能失调很可能是与一种叫“解偶联蛋白2 (uncou plingprotein 2, UCP2 ) ”的过表达密切相关。UCP2是胰岛素分泌的负性调节因子,可使胰岛素分泌功能受损,造成胰岛素分泌减少[20]。京尼平具有抑制胰岛β细胞UCP2的作用,当高糖或肥胖引起胰岛β细胞功能失调时,加入京尼平即逆转此种失调,使培养液中胰岛素增加,同时用敲除UCP2基因的ob/ob小鼠胰岛细胞作对比,却无此作用,说明该作用的产生与UCP2 密切相关[21]。
Wu等[12]研究表明栀子苷能显著降低糖尿病大鼠的血糖、胰岛素和甘油三酯水平,认为其机制可能是栀子苷能降低糖原磷酸化酶(glycogenPhosphrylase, GP)和葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)的mRNA和蛋白表达水平及其酶活性水平,对控制血糖稳定起到重要作用。Liu等[22]研究发现栀子苷具有潜在的预防和改善胰岛β细胞中胰岛素分泌障碍,可能与调节β细胞中的丙酮酸羧化酶介导的葡萄糖代谢,促进葡萄糖的摄取并提高细胞内ATP的水平有关。栀子苷还可以通过激活胰高血糖样肽-1(glucagon-likepeptide1, GLP-1)受体信号通路促进胰岛素的分泌,从而改善糖代谢紊乱症状[23]。
综上,栀子苷降血糖的作用机制可能是:(1)通过激活PPARγ信号通路,增强外周组织对胰岛素的敏感性,改善β细胞功能,促进葡萄糖的吸收利用;(2)通过抑制胰岛β细胞UCP2的作用,促进胰岛素分泌,改善胰岛β细胞功能障碍;(3)通过降低GP和G6Pase的mRNA和蛋白表达水平及其酶活水平,控制糖原分解代谢,起到维持血糖稳态的重要作用;(4)通过调节β细胞中的丙酮酸羧化酶介导的葡萄糖代谢,促进葡萄糖的摄取并提高细胞内ATP的水平;(5)通过激活GLP-1受体信号通路促进胰岛素的分泌,减少β细胞凋亡,促进β细胞增殖,改善β细胞功能。
2 改善血管病变
临床研究表明,糖尿病患者易并发血管病变,为糖尿病患者死亡和致残的主要原因。细胞黏附分子(cell adhesion molecules, CAMs)如血管细胞黏附分子-1(vascular cell adhesion molecule 1, VCAM-1)和E-选择素的表达增加,以及白细胞黏附到血管内皮细胞是糖尿病血管内皮功能障碍的早期表现[24]。
Koo等[25]用鸡胚绒毛尿囊膜法检测显示,栀子苷显示出潜在的抗血管增生的活性。栀子苷能明显抑制高糖诱导的脐静脉内皮细胞与单核细胞的VCAM-1和E-选择素的表达,这种抑制作用可能与抑制内皮细胞活性氧族(reactive oxygen species,ROS)产生和内皮细胞核转录因子(nuclear transcription factor-κB, NF-κB)的活性有关[26]。栀子苷这种抑制高糖诱导的内皮细胞及单核细胞的黏附分子基因表达、以及抗血管增生的特性表明它有可能作为治疗糖尿病血管并发症的药物。栀子苷及其代谢产物京尼平能够显著延迟生化反应中大鼠股动脉血栓闭塞时间,影响体内血栓因子及血小板的聚集,抑制磷脂酸酶A2(phospholipase A2, PLA2)的活性,达到抗血栓作用[15]。同时栀子苷能显著降低高糖高脂大鼠的总胆固醇和甘油三酯的含量,通过促进胆汁分泌而达到降脂的效果,改善脂代谢紊乱[27]。
因此,栀子苷改善血管病变的作用机制可能是:(1)抑制内皮细胞中CAMs,如VCAM-1和E-选择素的表达,改善血管内皮功能紊乱;(2)抗血栓作用,通过抑制PLA2的活性进而抑制血小板聚集,改善凝血机制异常;(3)降血脂作用,改善脂质代谢紊乱。
3 抗炎作用
1993年Hotamisligil在大鼠实验中最早发现了肿瘤坏死因子-α(tumor necrosis factor, TNF-α)与糖尿病的关系[28],揭示了炎症标志物与糖尿病具有某种联系。之后研究发现,Ⅱ型糖尿病(type2 diabetes mellitus,T2DM)患者血清中唾液酸、C-反应蛋白(C-reactive protein,CRP)、TNF-α、白细胞介素(interleukin,IL)-6、VCAM-1、E-选择素、血清淀粉样蛋白A等炎症因子水平增加,可预测低度炎症和内皮细胞的活化与T2DM的发生有关[29-30]。
方尚玲等[31]研究表明,栀子苷12.5 mg/kg剂量组和25 mg/kg剂量组对二甲苯致小鼠耳肿胀均有明显的抑制作用,栀子苷大剂量(50 mg/kg)可显著降低腹腔毛细血管的通透性,对急性炎症渗出有较明显的抑制作用,均表明栀子苷具有一定抗炎作用。姚全胜等[32]认为京尼平苷发挥其抗炎作用不同于肾上腺素类激素药物,腹腔注射氢化可的松幼鼠免疫器官可出现萎缩,而京尼平苷腹腔注射对幼鼠免疫器官重量则没有影响。京尼平可有效抑制大鼠脑胶质瘤细胞中脂多糖(lipopolysaccharide,LPS)诱导的一氧化氮(nitricoxide, NO)释放,降低TNF-α、IL-1β、前列腺素E2、ROS含量和NF-κB活性,也可抑制干扰素γ和β淀粉样变性所致的NO释放,同时京尼平还能有效抑制小鼠小胶质细胞的活性,具有抗脑部炎症活性[33]。Liu等[13]研究发现栀子苷能够有效抑制由LPS诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)中 IL-6及IL-8转录和翻译水平,抑制了NF-κB的活性,减少NF-κB抑制因子(inhibitor of NF-κB, IκB-α)的降解以及丝裂原活化蛋白激酶P38(mitogen-activated protein kinase,MAPK P38)和细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK1/2)的磷酸化,表明栀子苷抑制炎症的产生可能是通过阻断P38和ERK1/2信号通路实现的。同时栀子苷能通过抑制p38和 ERK1/2磷酸化以及IκB-α的解离,减少LPS诱导的细胞中NO和ROS的生成以及诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)的表达,从而发挥抗炎活性[34]。Deng等[14]研究表明栀子苷可以降低小鼠肺中IL-4,IL-5以及IL-13的水平,减少嗜酸性粒细胞趋化因子及VCAM-1的表达抑制了炎症反应。Wang等[35]发现栀子苷可以通过抑制Toll样受体(toll-like receptor,TLR)4信号通路抑制缺氧缺糖(oxygen-glucose deprivation,OGD)诱导的大鼠小胶质细胞的炎症反应,减少了TNF-α,IL-1β,IL-6, IL-8和IL-10的水平。
因此,栀子苷的抗炎作用机制:一方面可能是通过阻断分裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)家族成员,如 MAPK P38和ERK1/2信号通路,减少IκB-α的解离,抑制了NF-κB的活性,使前炎症因子TNF-α 、IL-1β、IL-6、IL-8以及细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)、VCAM-1和单核细胞趋化因子(monocyte chemotactic protein-1,MCP-1)等的表达下降,即通过直接阻断NF-κB通路发挥抗炎作用;另一方面可能通过抑制NF-κB活性进一步抑制iNOS表达和NO合成而间接达到抗炎目的。
4 抗氧化应激
近年来,越来越多的研究表明氧化应激与糖尿病及其并发症的发生、发展关系密切。胰岛β细胞抗氧化酶水平较低,对ROS较为敏感,ROS通过损伤胰岛β细胞,促进β细胞凋亡和降低外周组织对胰岛素的敏感性,从而产生胰岛素抵抗,引起胰岛素分泌不足或相对不足,导致糖尿病的发生发展[36]。
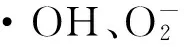
因此,栀子苷抗氧化的作用机制可能是:(1)通过捕获自由基,直接清除活性氧自由基;(2)抑制产生自由基酶的活性,提高抗氧化酶的活性,增强抗氧化能力;(3)抑制脂质过氧化反应,减少脂质过氧化物生成;(4)络合金属离子起到抗氧化作用。
5 结语
迄今为止,化学合成药物仍是糖尿病治疗最常用的药物,长期应用多具有不良反应。近年来研究表明,栀子苷和京尼平在糖尿病治疗上均取得了一定的改善作用。目前对栀子苷的提取、分离、合成研究较多,技术已较为成熟,应进一步研究栀子苷在治疗糖尿病及其并发症的作用效果与机理,为开发治疗糖尿病的药物奠定基础。
[1] Boussageon R, Bejan-Angoulvant T, Saadatian-Elahi M, et al. Effect of intensive glucose lowering treatment on all cause mortality, cardiovascular death, and microvascular events in type 2 diabetes: meta-analysis of randomised controlled trials[J]. BMJ, 2011,343:d4169.
[2] Krein S L, Bernstein S J, Fletcher C E, et al. Improving eye care for veterans with diabetes: an example of using the QUERI steps to move from evidence to implementation: QUERI Series[J]. Implement Sci, 2008,(3):18.
[3] S R J, Sa-Roriz T M, Rosset I, et al. (Pre)diabetes, brain aging, and cognition[J]. Biochim Biophys Acta, 2009,1792(5):432-443.
[4] Shaw J E, Sicree R A, Zimmet P Z. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010,87(1):4-14.
[5] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2010年版)[J]. 中国医学前沿杂志(电子版), 2011,3(6):54-109.
[6] Shieh J P, Cheng K C, Chung H H, et al. Plasma glucose lowering mechanisms of catalpol, an active principle from roots of Rehmannia glutinosa, in streptozotocin-induced diabetic rats[J]. J Agric Food Chem, 2011,59(8):3747-3753.
[7] Kim H L, Jeon Y D, Park J, et al. Corni Fructus Containing Formulation Attenuates Weight Gain in Mice with Diet-Induced Obesity and Regulates Adipogenesis through AMPK[J]. Evid Based Complement Alternat Med, 2013,2013:423741.
[8] Yamabe N, Kang K S, Matsuo Y, et al. Identification of antidiabetic effect of iridoid glycosides and low molecular weight polyphenol fractions of Corni Fructus, a constituent of Hachimi-jio-gan, in streptozotocin-induced diabetic rats[J]. Biol Pharm Bull, 2007,30(7):1289-1296.
[9] 杨春辉, 马莉, 魏振平. 环烯醚萜类化合物在防治糖尿病方面研究进展[J]. 化学工业与工程, 2011,28(6):68-73.
[10] 王磊, 辛文锋, 张文生. 栀子苷治疗阿尔采末病及神经保护的分子机制研究进展[J]. 中国药理学通报, 2012,28(5):604-607.
[11] 颜静恩, 李晚忱, 吕秋军, 等. 栀子苷的降糖作用和对PPARγ受体的激活[J]. 四川农业大学学报, 2007,25(4):415-418.
[12] Wu S Y, Wang G F, Liu Z Q, et al. Effect of geniposide, a hypoglycemic glucoside, on hepatic regulating enzymes in diabetic mice induced by a high-fat diet and streptozotocin[J]. Acta Pharmacol Sin, 2009,30(2):202-208.
[13] Liu H T, He J L, Li W M, et al. Geniposide inhibits interleukin-6 and interleukin-8 production in lipopolysaccharide-induced human umbilical vein endothelial cells by blocking p38 and ERK1/2 signaling pathways[J]. Inflamm Res, 2010,59(6):451-461.
[14] Deng Y, Guan M, Xie X, et al. Geniposide inhibits airway inflammation and hyperresponsiveness in a mouse model of asthma[J]. Int Immunopharmacol, 2013,17(3):561-567.
[15] Suzuki Y, Kondo K, Ikeda Y, et al. Antithrombotic effect of geniposide and genipin in the mouse thrombosis model[J]. Planta Med, 2001,67(9):807-810.
[16] Kimura Y, Okuda H, Arichi S. Effects of geniposide isolated from Gardenia jasminoides on metabolic alterations in high sugar diet-fed rats[J]. Chem Pharm Bull (Tokyo), 1982,30(12):4444-4447.
[17] Mulholland D J, Dedhar S, Coetzee G A, et al. Interaction of nuclear receptors with the Wnt/beta-catenin/Tcf signaling axis: Wnt you like to know[J]. Endocr Rev, 2005,26(7):898-915.
[18] Prestwich T C, Macdougald O A. Wnt/beta-catenin signaling in adipogenesis and metabolism[J]. Curr Opin Cell Biol, 2007,19(6):612-617.
[19] Welters H J, Kulkarni R N. Wnt signaling: relevance to beta-cell biology and diabetes[J]. Trends Endocrinol Metab, 2008,19(10):349-355.
[20] Robson-Doucette C A, Sultan S, Allister E M, et al. Beta-cell uncoupling protein 2 regulates reactive oxygen species production, which influences both insulin and glucagon secretion[J]. Diabetes, 2011,60(11):2710-2719.
[21] Zhang C Y, Parton L E, Ye C P, et al. Genipin inhibits UCP2-mediated proton leak and acutely reverses obesity- and high glucose-induced beta cell dysfunction in isolated pancreatic islets[J]. Cell Metab, 2006,3(6):417-427.
[22] Liu J, Guo L, Yin F, et al. Geniposide Regulates Glucose-Stimulated Insulin Secretion Possibly through Controlling Glucose Metabolism in INS-1 Cells[J]. PLoS One, 2013,8(10):e78315.
[23] Liu J, Yin F, Xiao H, et al. Glucagon-like peptide 1 receptor plays an essential role in geniposide attenuating lipotoxicity-induced beta-cell apoptosis[J]. Toxicol In Vitro, 2012,26(7):1093-1097.
[24] Xu J, Zou M H. Molecular insights and therapeutic targets for diabetic endothelial dysfunction[J]. Circulation, 2009,120(13):1266-1286.
[25] Koo H J, Song Y S, Kim H J, et al. Antiinflammatory effects of genipin, an active principle of gardenia[J]. Eur J Pharmacol, 2004,495(2-3):201-208.
[26] Wang G F, Wu S Y, Xu W, et al. Geniposide inhibits high glucose-induced cell adhesion through the NF-kappaB signaling pathway in human umbilical vein endothelial cells[J]. Acta Pharmacol Sin, 2010,31(8):953-962.
[27] 费曜, 朱丹平, 刘凡, 等. 栀子对 STZ 诱导的 2 型糖尿病大鼠血糖及血脂的影响[J]. 中药药理与临床, 2011,27(6):49-52.
[28] Hotamisligil G S, Shargill N S, Spiegelman B M. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance[J]. Science, 1993,259(5091):87-91.
[29] Pickup J C, Crook M A. Is type II diabetes mellitus a disease of the innate immune system[J]. Diabetologia, 1998,41(10):1241-1248.
[30] Duncan B B, Schmidt M I, Pankow J S, et al. Low-grade systemic inflammation and the development of type 2 diabetes: the atherosclerosis risk in communities study[J]. Diabetes, 2003,52(7):1799-1805.
[31] 方尚玲, 刘源才, 张庆华, 等. 栀子苷镇痛和抗炎作用的研究[J]. 时珍国医国药, 2008,19(6):1374-1376.
[32] 姚全胜, 周国林. 栀子抗炎,治疗软组织损伤有效部位的筛选研究[J]. 中国中药杂志, 1991,16(8):489-493.
[33] Nam K N, Choi Y S, Jung H J, et al. Genipin inhibits the inflammatory response of rat brain microglial cells[J]. Int Immunopharmacol, 2010,10(4):493-499.
[34] Zhang G, He J L, Xie X Y, et al. LPS-induced iNOS expression in N9 microglial cells is suppressed by geniposide via ERK, p38 and nuclear factor-kappaB signaling pathways[J]. Int J Mol Med, 2012,30(3):561-568.
[35] Wang J, Hou J, Zhang P, et al. Geniposide reduces inflammatory responses of oxygen-glucose deprived rat microglial cells via inhibition of the TLR4 signaling pathway[J]. Neurochem Res, 2012,37(10):2235-2248.
[36] Ceriello A, Motz E. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes, and cardiovascular disease The common soil hypothesis revisited[J]. Arterioscler Thromb Vasc Biol, 2004,24(5):816-823.
[37] 丁嵩涛, 刘洪涛, 李文明, 等. 栀子苷对氧化应激损伤血管内皮细胞的保护作用[J]. 中国药理学通报, 2009,25(6):725-729.
[38] 苏伟, 赵利, 刘建涛, 等. 栀子总皂苷抗氧化能力的研究[J]. 食品科学, 2009,30(15):75-77.
[39] Kuo W H, Chou F P, Young S C, et al. Geniposide activates GSH S-transferase by the induction of GST M1 and GST M2 subunits involving the transcription and phosphorylation of MEK-1 signaling in rat hepatocytes[J]. Toxicol Appl Pharmacol, 2005,208(2):155-162.
[40] Liu J, Yin F, Zheng X, et al. Geniposide, a novel agonist for GLP-1 receptor, prevents PC12 cells from oxidative damage via MAP kinase pathway[J]. Neurochem Int, 2007,51(6-7):361-369.
[41] 袁俊芳, 赵明. 糖尿病血管内皮祖细胞活性氧和钙离子浓度的改变及栀子苷的保护作用[J]. 医学临床研究, 2011,28(12):2245-2248.
[42] 李青岭, 于超, 李春莉, 等. 栀子苷抗H2O2诱导人脐静脉内皮细胞凋亡的实验研究[J]. 中国药理学通报, 2010,26(10):1367-1371.
(本文编辑:蒲晓田)
Research progress on the molecular mechanism of geniposide for diabetes and its complications treatment
ZHUDi-na,XINWen-feng,ZHANGWen-sheng.
ProtectionandUtilizationofChineseMedicineResourcesofBeijingKeyLaboratory,BeijingNormalUniversity,Beijing100875,China
ZHANGWen-sheng,E-mail:zws@bnu.edu.cn
Diabetes mellitus is a group of metabolic diseases characterized by chronic hyperglycemia. Untreated, diabetes can cause many complications. It mainly reflects in systemic microcirculation disorder, including kidney, eyes, cardiovascular system and nerves damage. Geniposide is the main effective components of traditional Chinese medicine Gardenia jasminoides Ellis,and its hydrolysed aglycon is genipin.Pharmacological studies showed that geniposide and genipin could result in blood glucose decrease, treat diabetic complication and be expected to become the new drugs for the treatment of diabetes mellitus. This review summarizes studies of geniposide and genipin for diabetes therapy recently, in order to further research on the molecular mechanism for the treatment of diabetes.
Diabetes mellitus; Geniposide; Genipin; Molecular mechanism
国家自然科学基金(81274118,81230010);国家科技重大专项重大新药创制专项(2012ZX09103-201)
100875 北京师范大学中药资源保护与利用北京市重点实验室[朱迪娜(博士研究生)、张文生];北京师范大学教育部天然药物工程研究中心[朱迪娜(博士研究生)、张文生];云南省三七生物技术与制药工程研究中心(辛文锋、张文生)
朱迪娜(1985- ),女,2012级在读博士研究生。研究方向:神经退行性疾病分子机制及神经药理学。E-mail:zhudina1011@163.com
张文生(1966- ),博士,教授,博士生导师。研究方向:神经退行性疾病分子机制及神经药理学。E-mail: zws@bnu.edu.cn
R285
A
10.3969/j.issn.1674-1749.2015.05.035
2015-03-21)
