吉西他滨对胰腺癌外周血调节性T细胞影响的研究
2015-03-15寇晓霞丁永梅袁振刚钱其军东方肝胆外科医院生物治疗科上海200438
寇晓霞,丁永梅,黄 耀,袁振刚,钱其军(东方肝胆外科医院生物治疗科,上海200438)
・生物治疗・
吉西他滨对胰腺癌外周血调节性T细胞影响的研究
寇晓霞,丁永梅,黄 耀,袁振刚,钱其军(东方肝胆外科医院生物治疗科,上海200438)
目的探讨吉西他滨对胰腺癌外周血调节性T细胞的影响,为进一步提高过继免疫治疗的疗效提供依据和参考。方法本研究入选2012年1月至2014年10月收治的32例胰腺癌患者,分为吉西他滨组(吉西他滨+过继免疫治疗)和对照组(单纯过继免疫治疗),观察两组患者治疗前后外周血调节性T细胞水平、化疗不良反应,并对两组患者的生存时间进行分析比较。结果吉西他滨组患者治疗后外周血调节性T细胞水平较治疗前显著降低,与对照组相比亦显著降低,两组比较有统计学差异(P<0.05),吉西他滨组中位生存时间较对照组延长1.3个月(10.0个月与8.7个月比较)。结论吉西他滨化疗可以显著降低胰腺癌患者外周血调节性T细胞水平,有效调节患者的肿瘤免疫耐受,提高过继免疫治疗的疗效。
吉西他滨;胰腺癌;调节性T细胞;过继免疫治疗
胰腺癌是一种发病隐匿、进展快、预后差、恶性程度极高的消化系统肿瘤,其发病率呈逐年升高的趋势。手术切除仍是目前唯一的根治手段,但是超过80%的患者确诊时已属晚期,难以进行手术切除,即使接受手术的患者,其中位生存期也仅有15~19个月[1]。对于手术无法切除的局部晚期或远处转移的患者,其中位生存期仅6个月左右[2]。以化疗为主的综合治疗目前仍是晚期胰腺癌的主要治疗手段,而吉西他滨则是晚期胰腺癌的标准一线化疗药物[3]。随着分子生物学和免疫学的快速发展,肿瘤微环境成为目前研究的热点,其中调节性T细胞(regulatory T cells,Tregs)是肿瘤微环境中一种重要的免疫抑制性细胞,通过直接和间接作用调控机体的抗肿瘤免疫功能。胰腺癌患者外周血和肿瘤微环境中的Tregs明显增多,并且随着肿瘤的进展,Tregs数量逐渐增多[4,5],那么,清除或干预Tregs对免疫功能的抑制在胰腺癌的治疗中就显得至关重要。本课题主要研究吉西他滨对胰腺癌患者外周血中Tregs的影响,进一步评价其对免疫功能的影响。
1 材料和方法
1.1研究对象及一般资料 选自2012年1月至2014年10月东方肝胆外科医院生物治疗科收治的32例胰腺癌患者,21例经病理证实,11例经临床资料及影像学明确诊断。分为2组,一组为吉西他滨组(n=16),行吉西他滨化疗联合过继免疫治疗,另一组为对照组(n=16),单纯行过继免疫治疗。两组患者的一般资料见表1。
1.2化疗方案 采用吉西他滨单药方案:盐酸吉西他滨(批号:C273987A,法国礼来有限公司)1 000 mg/m2静脉滴注30 m in,每周1次,3周为一疗程。在治疗过程中给予预防性止吐、补液及对症支持治疗。
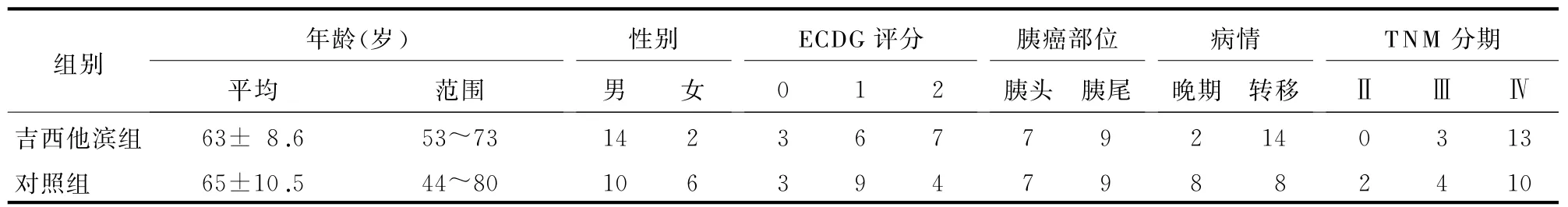
表1 两组患者一般资料比较(n=16,例)
1.3过继免疫治疗方案 ①外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的采集:在治疗周期的当天用FRESENIUS COM.TEC血细胞分离机(FRESENIUS KABI公司)进行外周血单个核细胞采集,采用auto MNC程序,P1YA耗材,采集数量约为2×108/L。②树突状细胞-细胞因子诱导的杀伤细胞(dendritic cells&cytokineinduced killer cells,DC-CIK)的分离及培养:采集出的PBMC用不含血清的AIM-V培养液(Gibco,Invitrogen)洗涤2次后,稀释浓度至4×106/L。将细胞转移至培养袋中培养2 h,收集非贴壁细胞,用于培养CIK细胞,贴壁细胞用于制备DC细胞,向其中加入含有GM-CSF(1 000 ng/m l)、IL-4(1 000 U/m l)、和FLT-3(50 ng/m l)的培养液,每2 d更换1/2培养液,补充细胞因子,第6天用包含多种肿瘤抗原(TAA)的腺病毒(血清35型)进行转染,收集DC细胞,培养24 h后,向其中加入TNF-α(100 ng/m l)和CD40L(50 ng/m l),然后继续培养2 d。非贴壁细胞收集后将浓度调整至2×109/m l,然后放入37℃、5%CO2孵箱中,加入IFN-γ(1 000 U/m l)培养,每天更换1/2培养液,加入CD3多克隆抗体(m Ab)(50 ng/m l)和IL-2(1 000 U/m l)。第9天将经过多抗原刺激的DC加入CIK培养液中,在上述条件下共同培养2 d。经细菌、真菌及内毒素检测阴性后分别于第11、15天收集悬浮的、经表型鉴定的成熟DC,溶于1 m l生理盐水中,皮内注射于腹股沟淋巴结;分别于第11、13、15天收集CIK细胞,细胞总数>2×1010/L,离心、洗涤后,溶于含0.25%人血白蛋白的300 m l生理盐水溶液中,静脉滴注,30 m in回输入患者体内。化疗及生物免疫治疗结合的方法见图1。
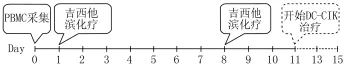
图1 化疗与DC-CIK治疗结合的方法
1.4观察指标及检测方法 化疗前3 d及化疗结束后3 d检测研究对象外周血调节性T细胞CD4+CD25+FoxP3+(Tregs),Tregs的检测方法:清晨空腹抽取EDTA抗凝静脉血3 m l,用流式细胞仪(Beckman Coulter公司,CytomicsTMFC500)检测外周血单个核细胞膜表面CD4+CD25+FoxP3+细胞,记录数据,采用CXP软件分析数据。同时观察吉西他滨组患者化疗后不良反应,并于每月对全部研究对象进行随访(随访时间至2014年12月),比较两组生存时间差异。
1.5统计学处理 采用SPSS 17.0统计软件进行处理,计量资料采用均数±标准差(¯x±s)表示,组间比较采用t检验,两组治疗前后及组间比较采用重复测量数据的两因素两水平方差分析,以P<0.05为有统计学意义,生存分析采用Kaplan-Meier分析,绘制生存曲线,计算中位生存时间,两组生存率的比较采用Log-Rank检验。
2 结果
2.1外周血调节性T细胞变化 见表2。
2.2中位生存时间 对全部研究对象进行随访,绘制生存曲线,并比较中位生存时间,见图2及表3。
2.3吉西他滨化疗后的不良反应 见表4。

表2 两组治疗前后Tregs变化的比较(¯x±s,n=16)

图2 两组患者生存曲线

表3 两组中位生存时间比较(月)
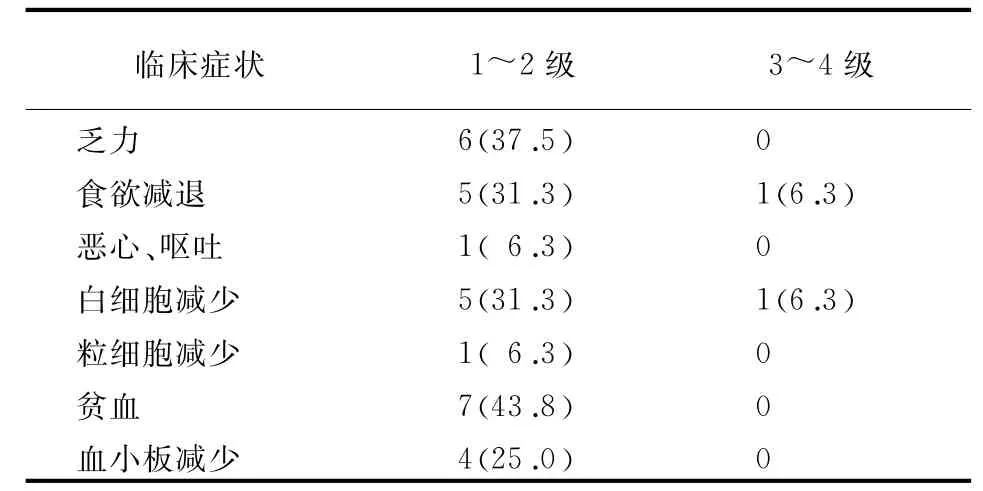
表4 吉西他滨化疗中相关的不良反应[例(%)]
3 讨论
胰腺癌目前仍是肿瘤治疗的难点之一,其死亡率在恶性肿瘤中居第4位[6]。文献报道在胰腺癌患者外周血中检测出多种免疫抑制性细胞,使得其侵袭性增强[7],其中包括Tregs,通过抑制抗肿瘤效应细胞应答来发挥作用[8]。Tregs在肿瘤免疫中起负调节作用,它的增加有利于肿瘤的生长和转移,肿瘤局部Tregs可通过不同的机制抑制免疫反应,促使肿瘤细胞免疫耐受、逃逸。TCR信号所激活的Tregs能够抑制CD4+和CD8+T细胞的活化、增殖,并且这种抑制作用是非抗原特异性的。除此之外,Tregs还能抑制NK细胞的增殖、细胞因子分泌和细胞毒作用,并对单核/巨噬细胞、树突状细胞、B细胞等免疫活性细胞同样有抑制作用[9]。化疗药物可通过抑制肿瘤微环境中相关环节,促进Tregs凋亡,使Tregs数目减少[10]。吉西他滨作为一种抗代谢药物,主要通过抑制DNA的合成和修复,起到干预肿瘤细胞脱氧核苷酸合成的作用,药理性质独特,毒副作用低,目前仍是治疗局部晚期或转移性胰腺癌的基石性药物。吉西他滨对Tregs的抑制作用国外已有多篇文献报道,如Homma等[11]报道了32例胰腺癌患者经过以吉西他滨为主的联合化疗后外周血Tregs较治疗前明显下降(P=0.032),但其他淋巴细胞亚群及NK细胞数则无明显改变。Bunt等[12]也报道了吉西他滨可降低胰腺癌患者Tregs及髓系抑制性细胞(myeloid-derived suppressor cells,MDSC),改善免疫逃逸及耐受。但国内的相关报道目前仍较少。
本研究发现,两组治疗后Tregs均较治疗前下降,但吉西他滨组下降程度更明显,且较对照组相比,有统计学差异(P<0.05),这也说明,经过吉西他滨化疗后可显著降低患者体内及肿瘤组织内聚集的Tregs,可对过继免疫治疗起到增效作用,类似结果Shindo等[6]也曾有报道。本研究还发现,吉西他滨通过降低Tregs水平,调节免疫耐受,联合免疫治疗可明显延长晚期胰腺癌患者生存时间,较单纯免疫治疗组效果更好,中位生存时间延长1.3个月,虽未达到统计学差异,但患者仍可明显获益,且未达到统计学差异的原因考虑可能与样本量较小,随访时间短,删失数据较多有关,需大样本随机对照试验来进行远期疗效的比较。本研究中吉西他滨化疗后不良反应较小,其中贫血、乏力、食欲减退、白细胞减少及血小板减少出现的比例稍高,但也均为轻度,无须特殊处理,耐受性好。由此可见,吉西他滨化疗安全可靠。
过继免疫治疗目前已取得了较满意的结果,但在晚期肿瘤患者中,肿瘤负荷过大,Tregs聚集过多,可通过杀伤作用影响效应细胞的疗效,这也是影响过继免疫治疗效果的重要原因之一。本研究通过对比两组患者治疗前后Tregs水平及生存时间,发现晚期胰腺癌患者通过吉西他滨化疗后明显降低外周血中Tregs水平,改善其抗肿瘤免疫抑制,与过继免疫治疗相结合,可以进一步提高过继免疫治疗的疗效,延长生存期,为晚期胰腺癌的治疗提供可靠、有效的方法。
[1] Trouilloud I,DubreuilO,Boussaha T,etal.Medical treatment pancreatic cancer:new hopes after 10 years of gemcitabine[J].Clin Res Hepatol Gastroenterol,2011,35(5):364-374.
[2] ShevchenkoI,Karakhanova S,Soltek S,etal.Low-dose gem cetabine depletes regulatory T cells and imp roves survival in the orthotopic Panc02 model of pancreatic cancer[J].Int J Cancer,2013,133(1):98-107.
[3] Burris HA,M oore M J,Andersen J,etal.Imp rovement in survival and clinical benefit w ith gem citabine as first-line therapy for patients w ith advanced pancreas cancer:a random ized trial[J].JClin Oncol,1997,15(6):2403-2413.
[4] Hiraoka N,Onozato K,Kosuge T,et al.Prevalence of FOXP3+regulatory T cells increases during the progression of pancreatic ductal adenocarcinoma and its p remalignant lesions[J].Clin Cancer Res,2006,12:5423-5434.
[5] Ikemoton T,Yamaguchi T,M orine Y,et al.Clinical roles of increased populations of Foxp3+CD4+T cells in peripheral blood from advanced pancreatic cancer patients[J].Pancreas,2006,33:386-390.
[6] Shindo Y,Hazama S,Maeda Y,etal.Adoptive immunotherapy w ith MUC1-m RNA transfected dend ritic cells and cy totoxic lymphocytes plus gemcetabine for unresectable pancreatic cancer[J].J Translat Med,2014,12:175.
[7] Gabitass RF,Annels NE,Stocken DD,etal.Elevated myeloidderived suppressor cells in pancreatic,esophageal and gastric cancer are an independent prognostic factor and are associated w ith significant elevation of the Th2 cytokine interleukin-13[J].Cancer Immunol Immunother,2011,60:1419-1430.
[8] Ghansah T,Vohra N,Kinney K,et al.Dend ritic cell immunotherapy combined w ith gem citabine chemotherapy enhances survival in amurinemodel of pancreatic carcinoma[J].Cancer Immunol Immunother,2013,62:1083-1091.
[9] 高 强,邱双健,樊 嘉.CD4+CD25+FOXP3+调节性T细胞在肿瘤免疫逃逸中的作用研究进展[J].中国癌症杂志,2007,17(8):657-662.
[10] 卢晓婷,刘俊田.CD4+CD25+调节性T细胞在肿瘤免疫及化疗方面的研究进展[J].中国肿瘤临床,2008,35(11):656-660.
[11] Homma Y,Tangiguchi K,Nakazawa M,et al.Changes in the immune cell population and cell proliferation in peripheral blood after gemcitabine-based chemotherapy for pancreatic cancer[J].Clini Translat Oncol,2014,16:330-335.
[12] Bunt SK,Mohr AM,Bailey JM,et al.Rosiglitazone and gemcitabine in combination reduces immune suppression andmodulates T populations in pancreatic cancer[J].Cancer Immunol Immunother,2013,62:225-236.
Changes of regulatory T cells in peripheral blood after gemcitabine chemotherapy for pancreatic cancer patients
KOU Xiaoxia,DING Yongmei,HUANG Yao,YUAN Zhengang,QIAN Qijun(Department of Biotherapy,Eastern Hepatobiliary Surgical Hospital,Shanghai200438,China)
ObjectiveTo investigate the influence of gemcitabine chemotherapy on levels of regulatory T cells(Tregs)in peripheral blood for patientsw ith pancreatic cancer and provide evidence and reference for improving the efficacy of adoptive immunotherapy.Methods 32 patients were enrolled in this study from January 2012 to October 2014,among whom 16 received gemcitabine chemotherapy combined w ith adoptive immunotherapy(gemcitabine group),the other 16 patients received adoptive immunotherapy only(control group).The level of Tregs in peripheral blood,side effect and overall survivalwere observed before and after the therapy.ResultsThe number of Tregs in peripheral blood was significantly decreased after gemcitabine chemotherapy,and itwas also lower than that of the control group.The overall survival time of the gemcitabine group was 1.3 mo longer than the control group(10.0 mo vs8.7 mo).ConclusionTherapeutic regimen of gemcitabine can remarkly deplete Tregs in peripheralblood of patientsw ith pancreatic cancer,effectively regulate tumor immune tolerance,and improve the efficacy of adoptive immunotherapy.
gemcitabine;pancreatic cancer;regulatory T cells(Tregs);adoptive immunotherapy
R979.1,R935
A
] 1006-0111(2015)03-0258-04
10.3969/j.issn.1006-0111.2015.03.018
2015-01-11
2015-04-17
[本文编辑] 顾文华
第二军医大学青年启动基金课题(2012QN18)
寇晓霞,医师,硕士研究生.研究方向:恶性肿瘤的化疗及生物治疗.
钱其军,博士,研究员,博士生导师.研究方向:免疫细胞过继治疗及肿瘤的基因、病毒治疗的研究.E-mail:13311850698@163.com
