Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料的合成与性能
2015-03-15刘熙林钟盛文梅文捷陈鹏金柱王春香
刘熙林, 钟盛文, 梅文捷, 陈鹏, 金柱, 王春香
(江西理工大学材料科学与工程学院,江西 赣州341000)
Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料的合成与性能
刘熙林, 钟盛文, 梅文捷, 陈鹏, 金柱, 王春香
(江西理工大学材料科学与工程学院,江西 赣州341000)
采用共沉淀法结合高温固相法制备Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料,利用SEM,XRD对所得试样的形貌和晶体结构进行表征,并研究材料的电化学性能.结果表明,少量Al的掺入减小材料的颗粒尺寸,降低材料的放电比容量,但可以提高材料的循环稳定性和倍率性能.其中x=0.01时所得试样在25℃,2.75~4.2 V,0.5 C倍率下的首次放电比容量为125.1 mAh/g,100次循环后的容量保持率达到99.5%.此外,掺入适量Al后可以降低Li+在材料中的电荷传递阻抗,改善材料的低温放电性能.
锂离子电池;正极材料;Li1.07(Ni0.4Mn0.53)1-xAlxO2;Al掺杂;低温放电性能
富锂锰基正极材料因具有放电比容量高,循环寿命长,价格低廉,对环境友好等诸多优点而得到广泛关注[1-7],富锂锰基正极材料主要是由Li2MnO3与具有层状结构特性的LiMO2(M=Ni、Co、Mn等)材料所形成的固溶体系.Kim等[8]通过燃烧法制备的Li(Li1/6Mn1/2Ni1/6Co1/6)O2在2.0~4.8 V内0.2 C下首次放电比容量为225 mAh/g,50次循环后材料的放电比容量降为175 mAh/g;Young等[9]采用燃烧法合成了Li[Li0.2Ni0.2Mn0.6]O2正极材料,在20 mA/g的电流密度,2.0~4.8 V电压范围内材料的首次放电比容量为288 mAh/g,30次循环后降低至213 mAh/g;Lee等[10]采用溶胶凝胶法制备的Li(Li0.2Mn0.55Co0.1Ni0.15)O2正极材料在 2.0~4.8 V,20 mA/g首次放电比容量可达240 mAh/g,50次循环后材料的容量保持率仅为58.33%.可见富锂锰基正极材料的循环稳定性仍有待提高,而掺杂改性是改善其电化学性能的有效途径. Kang等[11]研究发现,采用Li-Ni-PO4对0.5Li2MnO3· 0.5LiNi0.44Co0.25Mn0.31O2进行包覆后,材料的倍率性能得到明显改善,包覆试样在1 C倍率下的放电容量达200 mAh/g,而未包覆试样仅为170 mAh/g;Park等[12]采用Al对Li[Li0.15Ni0.275Mn0.575]O2正极材料进行掺杂改性,发现掺入少量Al后可以降低材料的面积比电阻,提高材料的循环稳定性;Jiao等[13]研究了Cr掺杂对Li[Li0.2Ni0.2Mn0.6]O2电化学性能的影响,通过溶胶凝胶法合成了Li[Li0.2Ni0.2-x/2Mn0.6-x/2Crx]O2正极材料,研究发现当x=0.04时所制备试样的电化学阻抗相比于未掺杂试样得到明显的降低,材料的放电比容量得到提高,倍率性能得到改善.本文将采用共沉淀法制备Ni0.43Mn0.57(OH)2前驱体,再将前驱体同Li2CO3和Al(OH)3混合均匀后经高温固相反应合成了Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料,考察了不同Al掺入量对材料的结构,形貌以及循环稳定性,低温放电性能等电化学性能的影响.
1 实 验
1.1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的合成
采用MnSO4·H2O(分析纯),NiSO4·6H2O(分析纯),Al(OH)3(分析纯),NaOH(分析纯)和Li2CO3(电池级)为原料.首先将MnSO4·H2O、NiSO4·6H2O按化学计量比n(Mn)∶n(Ni)=53∶40(物质的量比)称取一定的量配制成2 mol/L的混合盐溶液,另称取一定量的NaOH配制成4 mol/L的碱溶液.通过恒流泵将混合盐溶液和碱溶液同时均匀地滴加到反应釜中,通入氮气进行气氛保护,以NH3·H2O为络合剂,控制反应的pH=10.9~11,在55℃下共沉淀反应24 h制得前驱体 Ni0.43Mn0.57(OH)2.将前驱体进行洗涤,过滤,真空干燥24 h后与Al(OH)3和Li2CO3按化学计量比进行均匀混合后置于箱式电阻炉中,空气气氛下,在550℃下保温4 h,再升温至950℃下保温16 h,自然冷却至室温,取出研末过筛后即得Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料.
1.2 Li1.07(Ni0.4Mn0.53)1-xAlxO2的表征
实验采用荷兰PANalytical X’Pert PRO型转靶X射线衍射仪对产物进行结构分析,测试条件如下:Cu-Kα辐射,40 kV管电压,40 mA管电流,扫描范围为2θ=10°~80°,步长为0.02°,扫描速度为10(°)/min;采用德国ZEISS EVO/MA10型扫描电镜对产物的表面形貌进行分析;采用丹东百特BT-9300ST型激光粒度分布仪对产物进行粒度分析.
1.3 Li1.07(Ni0.4Mn0.53)1-xAlxO2的电化学性能测试
将制备好的Li1.07(Ni0.4Mn0.53)1-xAlxO2作为正极材料,Super-P和KS-6为导电剂,聚偏氟乙烯为黏结剂,四者按质量比90∶2.5∶2.5∶5,加入溶剂N-甲基吡咯烷酮,制成黏度适宜的浆料,涂敷在铝箔上,制成正极片;采用MCMB为负极材料,Super-P和KS-6为导电剂,聚偏氟乙烯为黏结剂,四者按质量比90∶1.5∶1.5∶7,加入溶剂N-甲基吡咯烷酮,配制黏度适宜的浆料,涂覆在铜箔上,制成负极极片.采用深圳新宙邦生产的1 mol/L LiPF6/DMC+EMC+EC(体积比为 1∶1∶1)电解液,Celgard2300隔膜,在通有流动干燥的除湿房中,卷绕组装成软包电池.
采用NEWARE BTS 5V3A型电池测试系统对装配好的电池进行电性能测试,充放电电压范围为2.75~4.2 V,测试温度为-20℃和25℃;采用SOLARTRON 1287+1260型电化学工作站对装配好的电池进行电化学阻抗测试,测试温度为25℃,频率范围为10 mHz~1 MHz,交流电压振幅为5 mV.
2 结果与讨论
2.1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的晶体结构
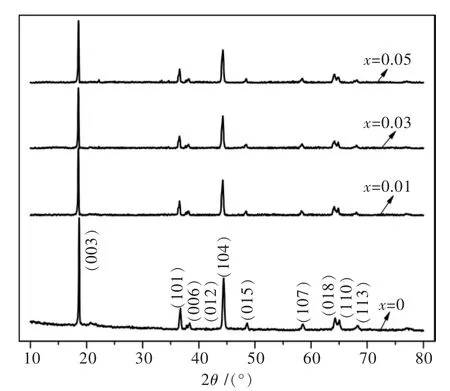
图1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的XRD图谱Fig.1 XRD patterns of Li1.07(Ni0.4Mn0.53)1-xAlxO2
图1 为Li1.07(Ni0.4Mn0.53)1-xAlxO2的XRD图谱.由图1可以看出,不同掺Al量下所得试样的主要衍射峰均为层状α-NaFeO2的特征峰,材料归属于六方晶系,空间群为R3m.掺入不同量的Al后所得各试样的衍射图谱相比于未掺杂时的Li1.07Ni0.4Mn0.53O2的衍射图谱中的峰形、峰位接近且无其它杂相峰的出现,表明Al3+成功进入材料的晶格中形成固溶体结构,而且Al的掺杂并不会改变Li1.07Ni0.4Mn0.53O2的本体晶型结构.各试样XRD图谱中(006)和(012),(018)和(110)2组峰都存在明显的分裂,表明所制备各试样的层状结构较好[14].
表1列出了Li1.07(Ni0.4Mn0.53)1-xAlxO2的路径与晶胞参数值.由表1可以看出,相比与未掺Al时Li1.07Ni0.4Mn0.53O2的晶胞参数,Li1.07(Ni0.4Mn0.53)1-xAlxO2的a,c和晶胞体积(V值)均更小,且随着Al掺入量的增加,所制备材料的晶胞体积越来越小.这是由于Al3+的离子半径(0.535 Å)与Mn4+的离子半径(0.53 Å)相近,却明显小于Ni2+的离子半径 (0.69 Å).Al掺入后所得各试样的c/a值均大于4.899,表现出试样较好的层状结构.此外,I(003)/I(104)值可以用来衡量材料中阳离子混排程度,其数值越大,表明阳离子混排程度越小[15].一般认为,当I(003)/I(104)值大于1.2时,材料的阳离子混排程度较小,离子有序度较好.各试样的I(003)/I(104)值均大于1.87,表明所制备试样较弱的阳离子混排程度.
2.2 Li1.07(Ni0.4Mn0.53)1-xAlxO2的表面形貌
图2为Li1.07(Ni0.4Mn0.53)1-xAlxO2的SEM图.由图2可以看出,各试样均呈现明显的层状岩盐形貌,且试样的晶粒形态并不随掺Al量的增加而出现较为明显的变化,说明Al的掺杂并不会改变材料的形态结构.各试样颗粒均是由多个一次颗粒聚集形成的二次颗粒,颗粒间存在较多空隙.随着Al的掺入,材料颗粒间的团聚现象越为明显,当Al掺入量为0.05时,试样团聚严重.结合表1可知,Al的掺入可以降低材料的中位径.正极材料颗粒粒径减小可以缩短充放电过程中Li+的迁移路径,从而降低材料的内阻,提升材料的电化学性能.但材料粒径太小致使颗粒的表面能增大,材料团聚严重.综合对比可知,Al掺入量为0.03所得试样的颗粒分布较为均匀,粒径较为适中.
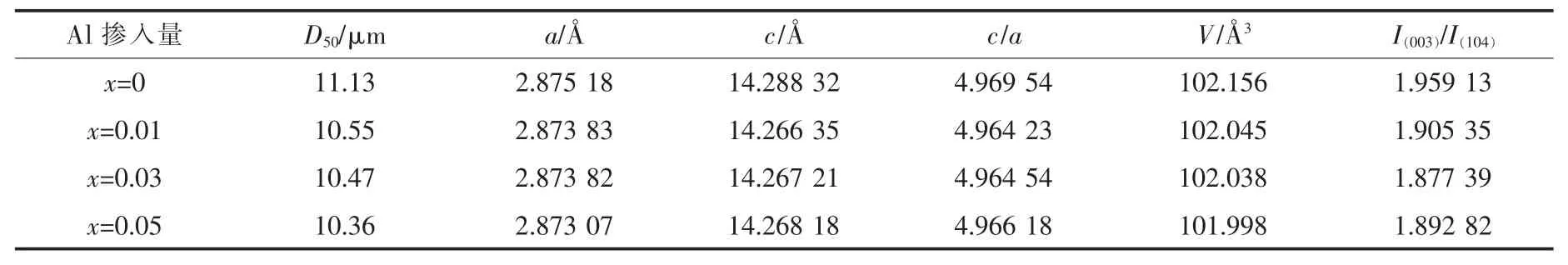
表1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的粒径与晶胞参数Table 1 Particle size and lattice parameters of Li1.07(Ni0.4Mn0.53)1-xAlxO2

图2 Li1.07(Ni0.4Mn0.53)1-xAlxO2的SEM像Fig.2 SEM images of Li1.07(Ni0.4Mn0.53)1-xAlxO2
2.3 Li1.07(Ni0.4Mn0.53)1-xAlxO2的电化学性能
图3为Li1.07(Ni0.4Mn0.53)1-xAlxO2在 25℃,2.75~4.2 V电压范围内,0.5 C倍率下的循环曲线图,表2为Li1.07(Ni0.4Mn0.53)1-xAlxO2在0.5 C倍率不同循环周次下的放电比容量表.由图3和表2可以看出,未掺杂Al所得Li1.07(Ni0.4Mn0.53)1-xAlxO2材料的首次放电比容量为127.0 mAh/g,100次循环后的容量保持率为98.7%.随着Al掺入量的增加,材料的放电比容量逐渐降低,但掺铝后所得材料在0.5 C下,经100次循环之后的容量保持率有所提高,其中x=0.01时所得试样的首次放电比容量为125.1 mAh/g,100次循环后的容量保持率达到99.5%.这主要是因为Al3+在材料结构中不具有电化学活性,不能贡献电化学容量,而材料中的活性Ni2+的含量随着Al掺入量的增加而减小,使得材料的放电比容量降低.同时正是在材料结构中不变价态的Al3+,其离子半径较小,离子间的作用力较大而起着稳定材料结构的作用,使得Li+能在Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料中的顺利脱嵌,增强了材料的循环稳定性能.Al掺杂量不宜太大,否则将带来较大的放电比容量的降低,当x=0.03时,材料的放电比容量相比于未掺杂时下降较为明显,0.5 C下的首次放电比容量仅为117.1 mAh/g.

图3 Li1.07(Ni0.4Mn0.53)1-xAlxO2的循环曲线Fig.3 Cycle performance curves of Li1.07(Ni0.4Mn0.53)1-xAlxO2

表2 Li1.07(Ni0.4Mn0.53)1-xAlxO2在0.5 C不同循环次数下的放电比容量表Table 2 Discharge specific capacity of Li1.07(Ni0.4Mn0.53)1-xAlxO2after different cycles with 0.5 C
图4为Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料在25℃,2.75~4.2 V内不同倍率下的循环曲线图.由图4可以看出,随着放电倍率的增加,材料的放电比容量均呈现不同程度的降低,这主要是因为放电倍率越大,单位时间内材料结构中Li+的脱嵌量越大,对材料结构的冲击和破坏的程度就越严重.同时,大倍率充放电下电极材料的极化程度加剧,电池内阻增加,致使放电比容量的降低.Li1.07(Ni0.4Mn0.53)1-xAlxO2在1 C和2 C倍率下的放电比容量分别为0.2 C放电比容量的92.8%和87.8%,x=0.01所得试样在1 C和2 C倍率下的放电比容量分别为其0.2 C放电比容量的93.4%和88.3%.由此说明少量Al的掺入可以在一定程度上提高材料的倍率性能.

图4 Li1.07(Ni0.4Mn0.53)1-xAlxO2在不同倍率下的循环曲线Fig.4 Rate capacity of Li1.07(Ni0.4Mn0.53)1-xAlxO2cycled at different rates
将Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料装配成电池,在25℃,2.75~4.2 V内以0.2 C倍率循环5次,记录稳定后电池的放电容量为室温放电容量,之后以0.2 C恒流充电至4.2 V,在4.2 V下恒压充电至电流下降到0.02 C,将电池转入低温箱中,在-20℃下放置16 h后,以0.2 C倍率进行放电所得的容量记为低温放电容量,低温放电效率为电池的低温放电容量与室温放电容量的百分比.图5为Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料在-20℃,2.75~4.2 V,0.2 C倍率下的放电曲线图,由图5可以看出,对于纯相的Li1.07Ni0.4Mn0.53O2而言,其在-20℃,2.75~4.2 V,0.2 C倍率下的放电容量仅为 25℃,2.75~4.2 V,0.2 C倍率下放电容量的36.7%,随着Al掺入量的增加,材料的低温放电效率呈现先增大后减小的变化规律.其中x=0.03时所得试样在-20℃,2.75~4.2 V,0.2 C倍率下的放电容量为25℃,2.75~4.2 V,0.2 C倍率下放电容量的41.1%.表明少量Al的掺入可以改善材料的低温放电性能.
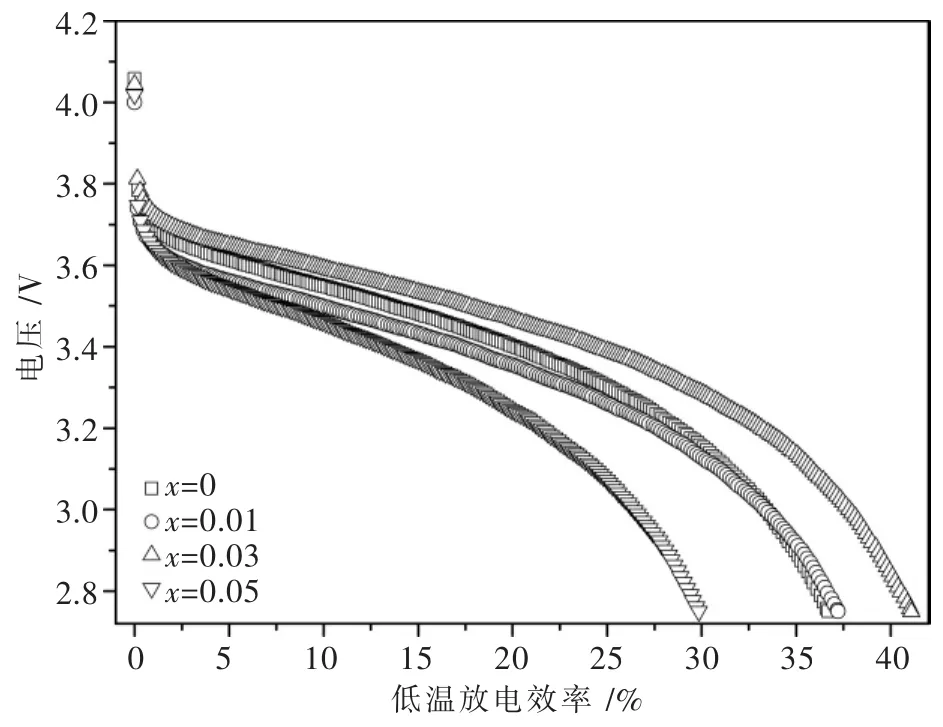
图5 Li1.07(Ni0.4Mn0.53)1-xAlxO2在-20℃,0.2 C倍率下的放电曲线图Fig.5 Discharge efficiency curves of Li1.07(Ni0.4Mn0.53)1-xAlxO2cycled at-20℃with 0.2 C
为进一步考察Al掺入后材料电化学性能得到改善的原因,对所制备的Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料装配成软包电池后先以0.2 C循环5次,再以0.2 C恒流充电至电压为4.0 V后用于电化学阻抗测试.图6为不同掺Al量下所得Li1.07(Ni0.4Mn0.53)1-xAlxO2的EIS图谱及其等效电路图.

图6 Li1.07(Ni0.4Mn0.53)1-xAlxO2的EIS图谱及其等效电路图Fig.6 EIS patterns and equivalent circuit of Li1.07(Ni0.4Mn0.53)1-xAlxO2
由图6可以看出,各试样的EIS图谱均由4部分组成:3个半圆加一直线.高频区压缩的扁半圆所对应的是Li+在材料表面SEI膜层中的迁移过程,中高频区的半圆对应为Li+通过SEI膜层后进入材料内部的输运过程,中频区的半圆对应的是电荷传递过程,低频区的直线对应的是Li+在材料中的扩散过程[16-17].在EIS等效电路图中,Rb代表材料的欧姆电阻,Rsei代表Li+通过SEI膜时产生的阻抗,Re代表材料的电子传输电阻,是表征电子在材料颗粒内部输运过程的基本参数,Rct代表材料的电荷传递阻抗,Zw代表Li+扩散过程中产生的Warburg阻抗,CPEsei和CPEe分别为与Li+在SEI膜迁移过程和Li+在材料内部颗粒输运过程有关的恒相位角元件,Cdl为双电层电容[18-20].
表3为EIS图谱拟合数据.由表3可以看出,少量Al的掺入可以降低Li+在正极材料中的电荷传递阻抗(Rct),从而改善材料的低温放电性能.随着Al掺入量的增加,材料的Rct值先减小后增大,其中x=0.03所对应试样的Rct值最小,低温放电效率最高,随着Al的掺入量的进一步增加,材料的Rct值又变大,低温放电效率也开始降低.这与Al掺入后材料的低温放电效率的变化规律一致.

表3 EIS图谱拟合数据Table 3 The fitting data of EIS patterns
3 结 论
采用共沉淀法制备出Ni0.43Mn0.57(OH)2前驱体,将其与Li2CO3和Al(OH)3按化学计量比均匀混合后,经高温固相烧结合成了Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料.结果表明,少量Al的掺入并不会改变材料的晶体结构,Al掺杂后所得材料的颗粒粒度有所减小,放电比容量相比于未掺杂试样有所降低,但掺Al后所得试样循环的稳定性和倍率性能得到了改善.其中x=0.01所得试样在25℃,2.75~4.2 V,0.5 C倍率下的首次放电比容量为125.1 mAh/g,100次循环后的容量保持率达到99.5%.此外,掺入少量Al后,试样的电荷传递阻抗有所降低,低温放电性能有所改善,其中x=0.3时所合成材料的低温性能最好,材料在-20℃,0.2 C下的放电效率由未掺杂试样的36.7%提升到41.1%.
[1]Lu Z H,Beaulieu L Y,Donaberger R A,et al.Synthesis,structure,and electrochemical behavior of Li[NixLi1/3-2x/3Mn2/3-x/3]O2[J].J Electrochem Soc,2002,149(6):A778-A791.
[2]Johnson C S,Li N,Lefief C,et al.Synthesis,characterization and electrochemistry of lithium battery electrodes:xLi2MnO3·(1-x)LiMn0.333Ni0.333Co0.333O2(0≤x≤0.7)[J].Chem Mater,2008,20(19):6095-6106.
[3]Castel E,Berg E J,Kazzi M E,et al.Differential electrochemical mass spectrometry study of the study of the interface of xLi2MnO3·(1-x)LiMnO2(M=Ni,Co,and Mn)material as a positive electrode in Li-ion batteries[J].Chem Mater,2014,26:5051-5057.
[4]钟盛文,徐宝和,吴甜甜,等.Mg2+掺杂对富锂锰基材料性能的影响[J].电源技术,2013,37(1):32-34.
[5]钟盛文,吴甜甜,徐宝和,等.层状锰基材料Li[Li0.2Mn0.54Ni0.13Co0.13]O2的固相合成及电化学性能[J].电源技术,2012,36(1):59-62.
[6]徐宝和,吴甜甜,钟盛文,等.Si4+掺杂对富锂Li[Li0.15Mn0.575Ni0.275]1-xSixO2材料性能的影响[J].有色金属科学与工程,2012,3(2):24-27.
[7]Hy S,Felix F,Rick J,et al.Direct in situ observation of Li2O evolution on Li-rich high capacity cathode material,Li[NixLi(1-2x)/3Mn(2-x)/3]O2(0≤x≤0.5)[J].J Am Chem Soc,2014,136(3):999-1007.
[8]Kim G Y,Yi S B,Park Y J,et al.Electrochemical behaviors of Li[Li(1-x)/3Mn(2-x)/3Nix/3Cox/3]O2cathode series(0<x<1)synthesized by sucrose combustion process for high capacity lithium ion batteries[J]. Materials Research Bulletin,2008,43:3543-3552.
[9]Young S H,Yong J K,Kwang S R,et al.Charge/discharge behavior of Li[Ni0.20Li0.20Mn0.60]O2and Li[Co0.20Li0.27Mn0.53]O2cathode materials in lithium secondary batteries[J].Solid State Ionics,2005,176:1035-1042.
[10]Lee S H,Koo B H,Kim J C,et al.Effect of Co3(PO4)2coating on Li[Co0.1Ni0.15Li0.2Mn0.55]O2cathode material for lithium rechargeable batteries[J].J Power Sources,2008,184(1):276-283.
[11]Kang S H,Thackeray M M.Enhancing the rate capability of high capacity xLi2MnO3·(1-x)LiMO2(M=Mn,Ni,Co)electrodes by Li-Ni-PO4treatment[J].Electrochem Commun,2009,11(4):748-751.
[12]Park S H,Sun Y K.Synthesis and electrochemical properties of layered Li[Li0.15Ni(0.275-x/2)AlxMn(0.575-x/2)]O2materials prepared by sol-gel method[J].J Power Sources,2003,119/120/121:161-165.
[13]Jiao L F,Zhang M,Yuan H T,et al.Effect of Cr doping on the structural,electrochemical properties of Li[Li0.2Ni0.2-x/2Mn0.6-x/2Crx]O2(x=0,0.02,0.04,0.06,0.08)as cathode materials for lithium secondary batteries[J].J Power Sources,2007,167(1):178-184.
[14]Liu H S,Li J,Zhang Z R,et al.Structural,electrochemical and thermal properties of LiNi0.8-yTiyCo0.2O2as cathode materials for lithium ion battery[J].Electrochim Acta,2004,49(7):1151-1159.
[15]Hwang B J,Santhanam R,Chen C H.Effect of synthesis conditions on electrochemical properties of LiNi1-yCoyO2cathode for lithium rechargeable batteries[J].J Power Sources,2003,114(2):224-252.
[16]Chen Y,Chen Z,Xie K.Effect of annealing on the first-cycle performance and reversible capabilities of lithium-rich layered oxide cathodes[J].J Phys Chem C,2014,118(22):11505-11511.
[17]Liu J,Jayan R,Manthiram A.Conductive surface modification with aluminum of high capacity layered Li[Li0.2Mn0.54Ni0.13Co0.13]O2cathodes[J].J Phys Chem C,2010,114(20):9528-9533
[18]庄全超,徐守冬,邱祥云,等.锂离子电池化学阻抗谱分析[J].化学进展,2010,22(6):1044-1057.
[19]Deng Y H,Liu S Q,Liang X X.Study of carbon surface-modified Li[Li0.2Mn0.54Ni0.13Co0.13]O2for high-capacity lithium ion battery cathode[J].J Solid State Electrochem,2013,17(4):1067-1075.
[20]Guo S H,Yu H J,Liu P,et al.Surface coating of lithium-manganese-rich layered oxides with delaminated MnO2nanosheets as cathode materials for Li-ion batteries[J].J Mater Chem A,2014(2):4422-4428.
Synthesis and properties of Li1.07(Ni0.4Mn0.53)1-xAlxO2as cathode materials for lithium ion batteries
LIU Xilin,ZHONG Shengwen,MEI Wenjie,CHEN Peng,JIN Zhu,WANG Chunxiang
(School of Material Science and Engineering,Jiangxi University of Science and Technology,Ganzhou 341000,China)
Li1.07(Ni0.4Mn0.53)1-xAlxO2cathode materials were synthesized by co-precipitation method and high temperature solid-state method.The morphologies and crystal structure of Li1.07(Ni0.4Mn0.53)1-xAlxO2were characterized by SEM and XRD,respectively.The electrochemical properties were also investigated.The results show that the particle size and the discharge specific capacity are reduced by doping appropriate amount of Al with the improvement of the cycling stability and rate capability for the Al-doped cathode materials.When cycled at 25℃with 0.5 C in the voltage range of 2.75-4.2 V,the sample with x=0.01 delivers an initial discharge specific capacity of 125.1 mAh/g with capacity retention rate of 99.5%after 100 cycles. Besides,the charge transfer resistance is observed in a decreased tendency accompanied with low-temperature discharge performance applied with appropriate doped Al amount.
lithium ion batteries;cathode materials;Li1.07(Ni0.4Mn0.53)1-xAlxO2;Al-doped;low-temperature discharge performance
TF114.1;TM911.14
A
1674-9669(2015)05-0063-06
10.13264/j.cnki.ysjskx.2015.05.012
2015-04-09
国家自然科学基金资助项目(51372104);江西省科技计划项目(20141BBE50019)
刘熙林(1990- ),男,硕士研究生,主要从事锂离子电池正极材料方向研究,E-mail:liuxilin2012@163.com.
钟盛文(1963- ),男,教授,主要从事锂离子电池及相关材料方向研究,E-mail:zhongshw@126.com.
