纯化水管道分配系统设计探讨及其系统消毒
2015-03-14王永忠
王永忠
(厦门朝阳生物工程有限公司,福建厦门361024)
0 引言
《中国药典》中制药工艺用水包括饮用水、纯化水、注射用水、无菌注射用水。纯化水作为制药生产过程中大量使用的工艺用水,对药品生产和用药者的安全至关重要。制药工艺用水是制备注射用水、洁净蒸汽的原料水,可用于各种化学试剂、诊断试剂的配制;用于各种仪器、设备、容器的清洗等。
纯化水分配系统经过多年发展和企业的应用实践,从单一向各用水点供水,发展到一整套纯化水的分配系统设计方案,包括:供水设计、流量设计、管道设计、无菌设计、温度设计以及各种理化指标、微生物指标的控制设计等。
1 法规要求
1.1 《中国药典》
《中国药典》中对纯化水的质量要求如表1所示[1]。
1.2 GMP
药品生产质量管理规范(2010年修订)中有关纯化水的规定(第5章第6节)[2]:
第97条:水处理设备及其输送系统的设计、安装、运行和维护应当确保制药用水达到设定的质量标准。水处理设备的运行不得超出其设计能力。
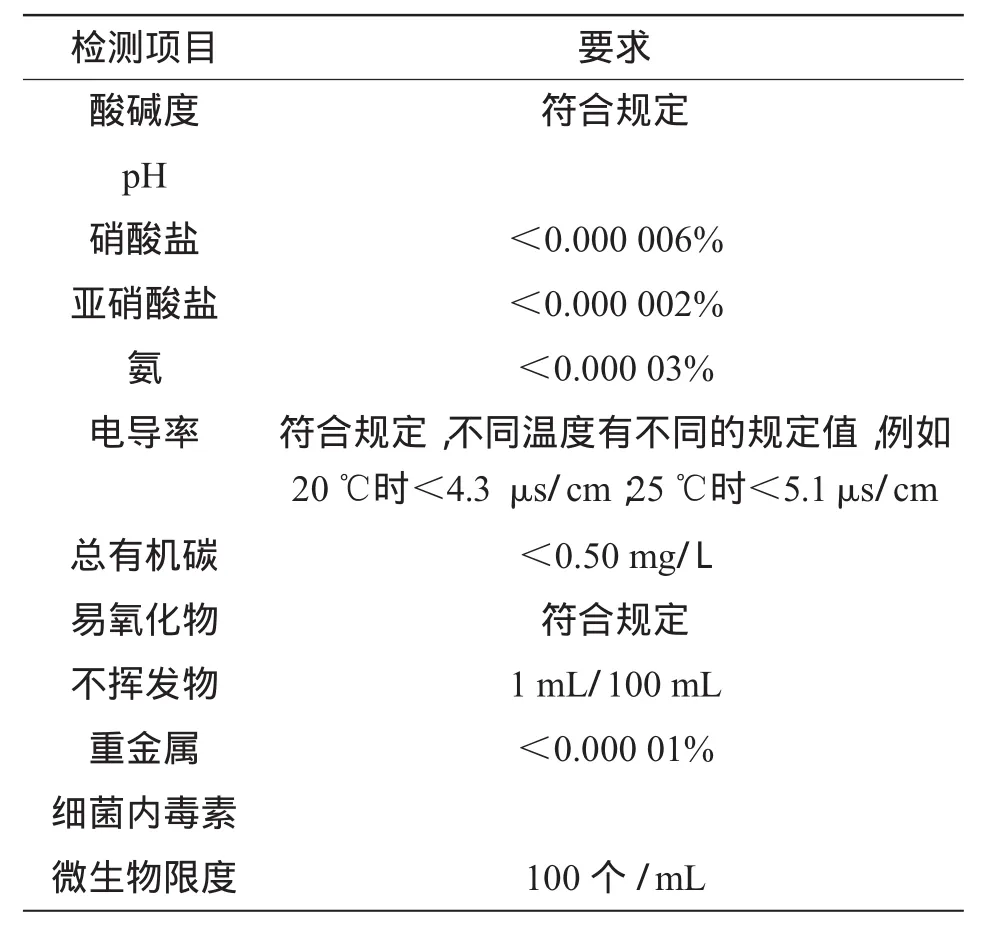
表1 《中国药典》对纯化水的质量要求
第98条:纯化水、注射用水储罐和输送管道所用材料应当无毒、耐腐蚀;储罐的通气口应当安装不脱落纤维的疏水性除菌滤器;管道的设计和安装应当避免死角、盲管。
第99条:纯化水、注射用水的制备、贮存和分配应当能够防止微生物的滋生。纯化水可采用循环模式,注射用水可采用70℃以上保温循环。
第100条:应当对制药用水及原水的水质进行定期监测,并有相应的记录。
第101条:应当按照操作规程对纯化水、注射用水管道进行清洗消毒,并有相关记录。发现制药用水微生物污染达到警戒限度、纠偏限度时应当按照操作规程处理。
2 方案设计
参照2010版《药品GMP指南》厂房与设备章节的分配系统设计[3]和ASMEBPE—2005的Part MJ Material Joining[4]。
2.1 系统描述
纯化水储存和分配系统描述如下:纯化水由纯化水设备生产,并接入纯化水储罐,储罐作为满足系统要求用水量缓冲之用。纯化水电导率通过在线仪表检测,如果纯化水电导率高于标准要求,监控仪表发出警报信号并反馈PLC,同时PLC控制在线的组合阀门,将不合格水排放,或者进行重新处理。
合格的纯化水输入储罐,通过分配系统,供给各纯化水使用点。
纯化水循环回路中安装有双板热交换器,热源介质为工业蒸汽。为了保证整个系统微生物含量,管路系统应定期进行灭菌。通过纯水循环回路的换热器将纯化水加热至80℃以上,并在80℃的状态下,保持2 h。在灭菌过程中,管路和罐内的温度、电导率等参数将被自动记录;所有使用点的阀门必须保持关闭状态。灭菌过程完成之后,通过换热器冷却纯化水至一定温度后排放。
2.2 技术描述
纯化水分配循环系统供应生产车间的纯化水使用点。
纯化水采用变频恒压输送泵根据瞬间用水量的大小实现自动变频控制,当监测到管道回路末端的流速<1.0 m/s时,增大循环水泵的频率。
在纯化水系统循环泵出口设有在线隔膜式压力表,便于直观地看到泵的运行状况是否正常。
在纯化水管道系统的出水和回水口均设计了取样口,以便随机检测水质情况。
在循环的末端设有气动隔膜阀来根据在线电导的检测情况作出回罐与排放的切换,当电导率合格时,打开进水阀,关闭排放阀,水流回储罐;当电导率不合格时,打开排放阀,关闭进水阀,水排放并发出报警信号。
在纯化水主回路设有一台换热器进行巴氏灭菌并维持生产循环温度。
所有水平管道均设计有0.5%~1%的坡度,以便于管道排尽。
所有的选型设备将满足每年24 h/d、7 d/周的工作强度要求。系统的主要设备如下:卫生级纯化水循环泵、双板式换热器、各类阀门、控制系统及各类仪表。
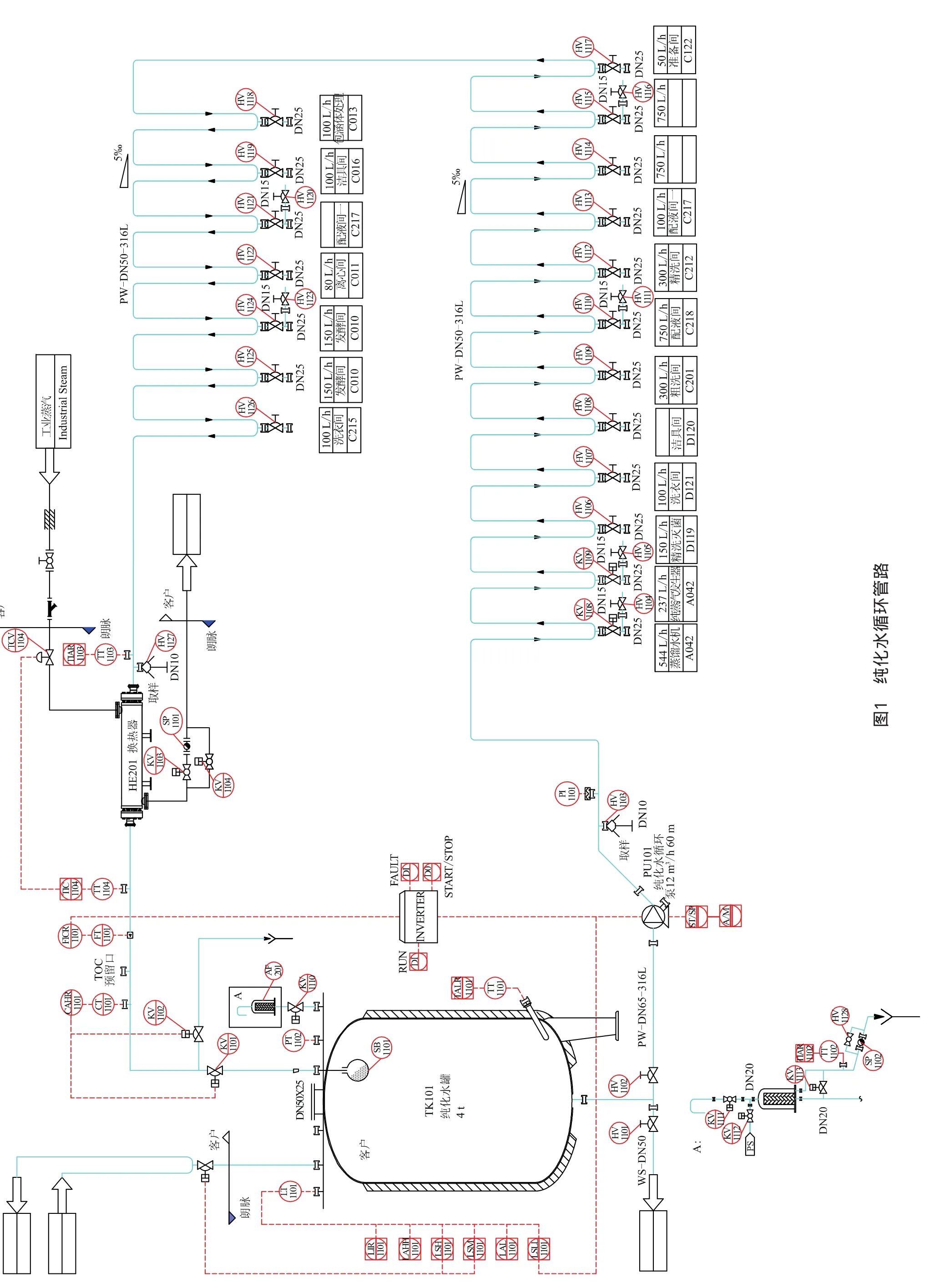
2.3 纯化水循环管路
纯化水循环管路如图1所示。
3 纯化水水质控制指标
按照2010版《中国药典》要求,制药企业纯化水水质指标控制项目包括:总有机碳、细菌内毒素、微生物限度、pH、电导率、易氧化物、重金属、硝酸盐、亚硝酸盐和氨。除了微生物、细菌内毒素2个指标以外,其他可以通过制水工艺来得到控制。
GMP认证检查条款3401:纯化水的制备、储存和分配应能防止微生物的滋生和繁殖,并且该项为“关键项”,可以看出在符合质量标准的同时,更强调了对微生物的控制。
4 纯化水的使用特点
纯化水作为制药生产过程中的重要原辅料,其使用特点主要有:
(1)通常是连续生产的原料。(2)难以在使用前安排批次发放。(3)微生物检查结果滞后于水的使用。
5 系统设计
在系统设计方面,除了在制水设备上可控制的项目外,在贮存和分配系统中有效控制微生物方面应考虑的措施有:(1)尽量维持高的管道流速;(2)使用表面光滑的管道;(3)安装在线紫外消毒和周期性消毒装置;(4)使用卫生级阀门;(5)将死角和隐蔽处减到最少;(6)以ASMEBPE的标准进行施工。
5.1 管径对水质的影响及利弊
纯化水在管道内的流速与不锈钢管道的直径有直接的关系。一般采用的管径有:同一管径、渐变缩小管径、送回水不同管径。各种管径对水质的影响及利弊如下:
5.1.1 同一管径的管道
水到各个使用点后,越到管道后端,其管道内的流量就越小,其流速也越小,有可能会<1 m/s,有微生物滋生的风险。
5.1.2 渐变缩小管径
采用这种方式设计的管道,保证其后段管道也有较高的流速,但在管路上增加使用点时,不能满足使用点流量的需求。
5.1.3 送、回水不同管径
较大直径的送水管,较小直径的回水管。对使用点的用水量和管道内流速皆能满足,微生物的风控最小。
5.2 流速的设计
5.2.1 流体的流动状态与雷诺数
纯化水在管道内流动,一般有层流、湍流以及混合流状态,一般以雷诺数为指标来判定流动状态。
雷诺数较小时,黏滞力对流场的影响大于惯性力,流场中流速的扰动会因黏滞力而衰减,流体流动稳定,为层流,Re<2 300;若雷诺数较大,惯性力对流场的影响大于黏滞力,流体流动较不稳定,流速的微小变化容易发展、增强,形成紊乱、不规则的紊流流场,其Re>4 000;当Re>10 000时,所有流体都处于湍流状态。
只有流体真正处于稳定的湍流状态下,流体中的质点才不至于停留在管壁上。因此,在设计时,Re>10 000是设计纯化水管道管径必须达到的条件。
5.2.2 设计流速的确定
在流速的设计确定上,各国的规范不尽相同,但一般都在1 m/s以上。
ISPE推荐流速大于3 ft/s。防止营养物聚集和细菌黏附在管壁所需要的流速要超过3 ft/s或雷诺数大于湍流值,并指出清除生物薄膜所需的流速高于15ft/s。相关文献“循环的干管流速宜大于1.5 m/s[5]”。
因此,目前大多数制药企业在设计管道时,普遍采用雷诺数Re>20 000来设计,并能保证管道中不利微生物附着生长的状态,送回水管道的管径和流量更符合实际需要。
5.2.3 分配系统设计实例
某用水车间最大供水量为45 m3/h,最大耗水量为35 m3/h,回水量为10 m3/h,出水流速为3 m/s。共有19个用水点,系统采用变频供水泵供水。根据相关文献给水进行计算[6]。
5.2.3.1 管径的计算
送水管径D的计算:
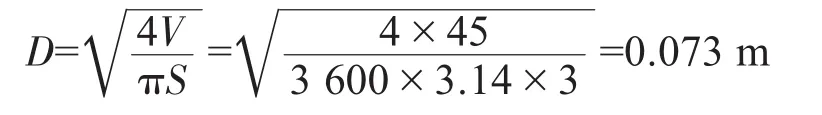
式中D——送水管直径,m;
V——供水量,m3/h;
S——流速,m/s。
送水管选用外径76 mm、内径72.8 mm,符合设计条件。
同样,回水管选用外径50.8 mm、内径47.5 mm。
5.2.3.2 回水管流速的计算
回水管流速S的计算:
式中S——流速,m/s;
V——回水量,m3/h;
D——回水管直径,m。
5.2.3.3 雷诺数Re的校验
当不用水时,循环管道中的流量最小,送回水管道流量V=10 m3/h。
此时送水管道的流速:
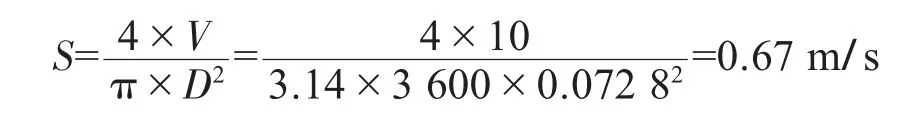
式中S——流速,m/s;
V——回水量,m3/h;
D——送水管直径,m。
水在25℃时的运动黏度为0.905 5×10-6m2/s。
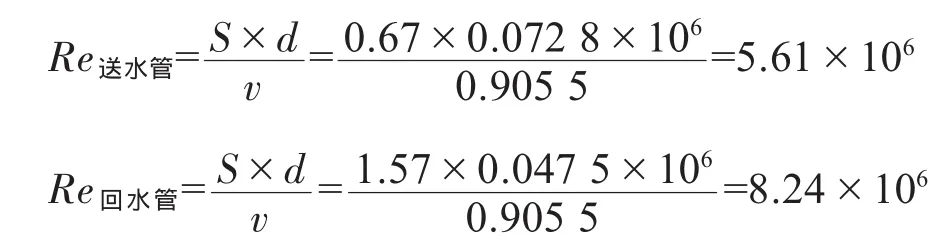
式中S——流速,m/s;
d——水管直径,m;
v——运动黏度,m2/s。
结论:设计能满足对微生物控制的设计要求。
6 系统消毒
6.1 系统周期性消毒装置
6.1.1 消毒分类
目前,各药厂周期性杀菌装置主要分类如下:(1)化学消毒:臭氧、双氧水消毒等;(2)热水消毒(80℃巴氏消毒)。
6.1.2 巴氏消毒的特点
因化学消毒在操作上较麻烦,化学残留较难测定,故使用的厂家不多。目前,主流的消毒方式是采用热水消毒(80℃巴氏消毒)。
巴氏消毒有以下特点:
(1)在线监控灭菌温度。
(2)连续的温度记录,简化了消毒确认。
(3)消毒以后无需进行消毒介质残留的测定。
(4)清毒过程能自动操作。
(5)热具有很强的空穿透能力,能传递到垫圈、隔膜阀片的小缝隙等化学消毒剂难以有效到达的部位。
(6)消毒以后微生物不易反弹。有文献记载:用双氧水消毒以后5~6 d,微生物数目开始不断反弹,用热水消毒(1次/30 d),微生物数目7个月后保持在0或接近于0。
6.2 硬件设计
按纯化水的工艺要求,选用卫生级双管板换热器,为巴氏消毒提供热源。安装在循环管路回水入贮罐前,系统配置相应的自动温度控制元件。
卫生级双管板换热器特点如下:
(1)换热器采用无缝钢管,316 L材质;(2)双管板设计,杜绝交叉污染;(3)产品接触的内腔能全排空,换热管内无死角;(4)与产品接触部位表面粗糙度<0.5μm。
6.3 某项目纯化水分配系统的巴氏消毒与微生物的监测情况
时间:2012年10月—2013年12月。
取样口:总回水口、贮罐。
检测方法:微生物限度法(2010版《中国药典》)。
6.3.1 薄膜过滤法
采用薄膜过滤法,滤膜孔径应不大于0.45μm,直径一般为50 mm,若采用其他直径的滤膜,冲洗量应进行相应的调整。选择滤膜材质时应保证供试品及其溶剂不影响微生物的充分被截留。滤器及滤膜使用前应采用适宜的方法灭菌。使用时,应保证滤膜在过滤前后的完整性。水溶性供试液过滤前先将少量的冲洗液过滤以润湿滤膜。为发挥滤膜的最大过滤效率,应注意保持供试品溶液及冲洗液覆盖整个滤膜表面。供试液经薄膜过滤后,若需要用冲洗液冲洗滤膜,每张滤膜每次冲洗量不超过100 mL,总冲洗量不得超过1 000 mL,以避免滤膜上的微生物受损伤。
取相当于每张滤膜含1 g、1 mL或10 cm2供试品的供试液。用pH7.0无菌氯化钠—蛋白胨缓冲液或其他适宜的冲洗液冲洗滤膜。冲洗后取出滤膜,菌面朝上贴于营养琼脂培养基或玫瑰红钠琼脂培养基或酵母浸出粉胨葡萄糖琼脂培养基平板上培养。每种培养基至少制备一张滤膜。
6.3.2 阴性对照试验
取试验用液1 mL照上述薄膜过滤法操作,作为阴性对照。阴性对照不得有菌生长。
6.3.3 培养和计数
培养条件和计数方法同平皿法(此处略),每片滤膜上的菌落数应不超过100个。
6.3.4 菌数报告规则
以相当于1 g、1 mL或10 cm2供试品的菌落数报告菌数。若滤膜上无菌落生长,以<1报告菌数(每张滤膜过滤1 g、1 mL或10 cm2供试品),或<1乘以最低稀释倍数的值报告菌数。
6.3.5 微生物检测数据
微生物检测数据如表1所示,微生物趋势如图2所示。
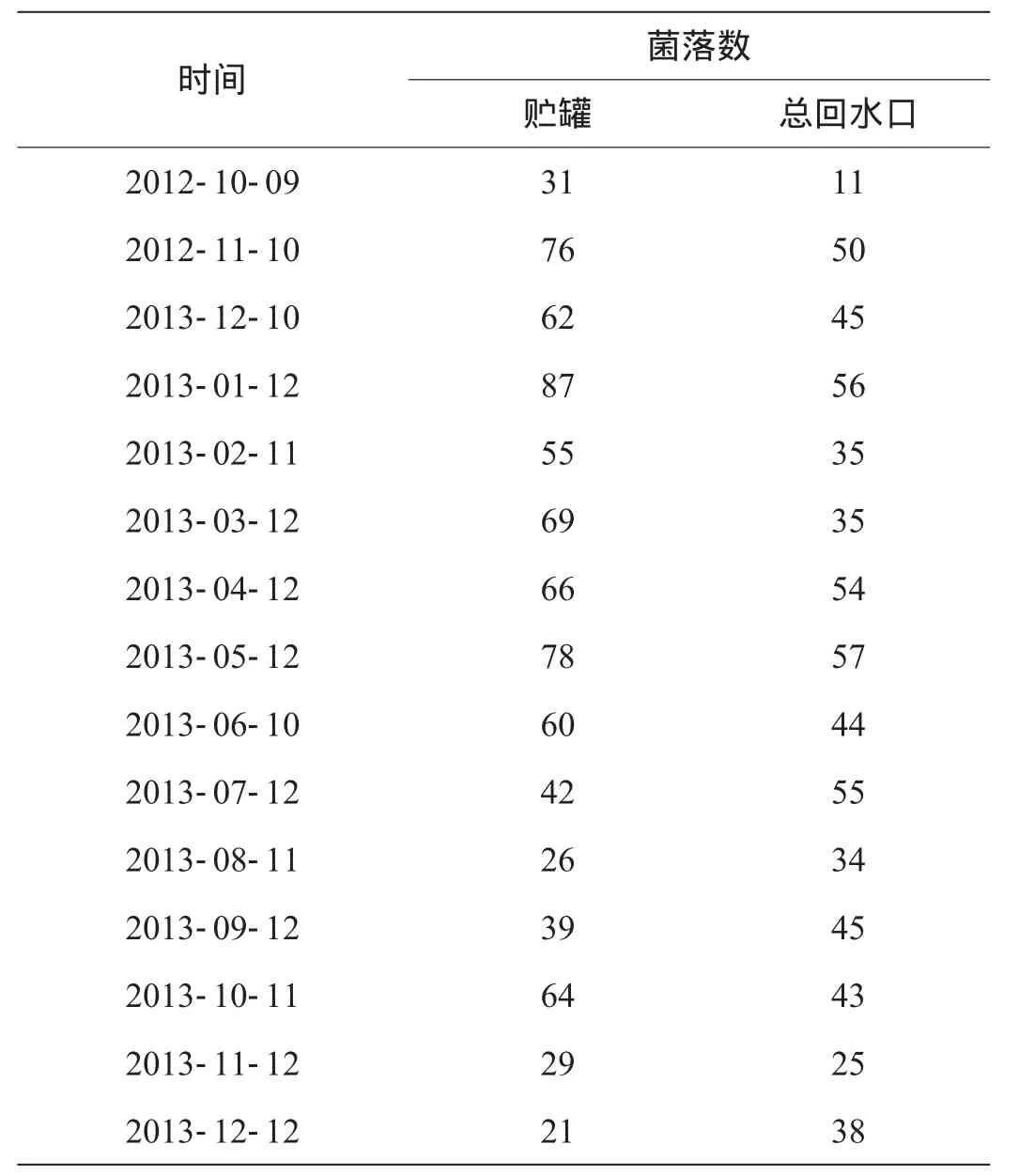
表1 微生物检测数据 单位:cf u/mL

图2 微生物趋势图
6.3.6 结论
经过15个月的跟踪检测,在跟踪期内2个取样口的样品水的微生物都在规定的限度内(100 cfu/mL以内),采用每个月1次的巴氏灭菌能有效控制微生物的滋生和发展。
7 结语
医药纯化水管道分配系统的前期设计非常关键,整个系统的设计质量,直接影响到工程项目的投资、运行稳定性和微生物的可控性以及GMP法规的符合性。一套良好的分配系统是制药企业工艺用水水质良好的保证和基础。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
[2]国家食品药品监督管理局.药品生产质量管理规范(2010年修订)[S].
[3]国家食品药品监督管理局药品认证管理中心.药品GMP指南:厂房设施与设备[M].北京:中国医药科技出版社,2011.
[4]ASME BPE—2005[S].
[5]GB50457—2008医药工业洁净厂房设计规范[S].
[6]GB50073—2001 洁净厂房设计规范[S].
