红嘴相思鸟热应激及壳聚糖抗应激效应研究
2015-03-14王夕龙袁施彬周材权
刘 明,王夕龙,袁施彬,周材权
(西华师范大学生命科学学院珍稀动植物研究所,西南野生动植物资源保护教育部重点实验室,四川 南充 637009)
红嘴相思鸟热应激及壳聚糖抗应激效应研究
刘 明,王夕龙,袁施彬,周材权
(西华师范大学生命科学学院珍稀动植物研究所,西南野生动植物资源保护教育部重点实验室,四川 南充 637009)
为了探讨人工驯繁条件下高温对红嘴相思鸟Leiothrixlutea生理机能的影响及壳聚糖的抗应激效应,本研究采用单因子实验设计,将80只成年健康红嘴相思鸟(♀)随机分到5个处理中(处理1为常温对照组,处理2、3、4、5为急性高温应激组,处理温度35℃,持续3h),分别在其基础日粮中添加0%,0%,0.1%,0.5%,和1%的壳聚糖,检测血浆中IgG、IgM和IgA的浓度,组织中抗氧化酶活力和脂质过氧化指标丙二醛(MDA)的含量.结果发现:与常温对照组相比,各热应激对照组红嘴相思鸟免疫球蛋白(除IgA)含量降低,体内抗氧化酶活力下降(3种组织中T-SOD酶活均显著降低,肝脏中GSH-PX及CAT酶活显著降低),脂质过氧化产物含量升高(肝脏和肌肉中MDA含量显著升高);而壳聚糖又能不同程度的提高免疫球蛋白(除IgA)的含量,增强体内抗氧化酶活力,缓解体内脂质过氧化状况,且壳聚糖的添加剂量在0.5%时,机体表现出最佳的抗应激能力.
红嘴相思鸟;壳聚糖;热应激;抗应激
红嘴相思鸟Leiothrixlutea又名红嘴玉、五彩相思鸟、红嘴鸟等,隶属于雀形目画眉科相思鸟属[1].因其羽色华丽,体态优美,鸣声婉转而受到人们的普遍追捧,是享誉世界的观赏鸟.近年来,由于国内外市场的巨大需求,导致红嘴相思鸟的猎捕压力与日俱增,野外种群及其栖息地遭到极大破坏[2],为了可持续合理的利用野生鸟类资源,减少野外种群的生存压力,突破红嘴相思鸟人工驯繁关键技术已迫在眉睫.有研究表明,红嘴相思鸟雏鸟体温调节能力极差[3],成鸟怕热,夏季易发病[4],高温已成为制约其人工驯繁的关键因素之一.然而,在全球气候变暖的背景之下,我国多地夏季多发极端高温天气,且有进一步增温的趋势[5],驯繁地的极端高温极易使这种被覆羽毛,散热困难的名贵鸟类陷入热应激状态(所谓应激,即机体对外界或内部的各种非常刺激所产生的非特异性应答反应的总和[6],而热应激是指环境温度超过动物体舒适区上限所致的应激反应),对攻克其人工驯繁关键技术形成掣肘之势,亟待解决.
如何抵御或缓解人工驯繁条件下高温对其的影响已成为业内人士普遍关注的问题.有研究表明,壳聚糖(Chitosan)作为一种来源于甲壳类动物外壳的天然碱性多糖,具有良好的抗氧化能力[7,8],及明显的抗高温应激效应[9].同时,相关的食性研究发现,野外红嘴相思鸟主要以鞘翅目等富含甲壳素的昆虫为食[10].那么,在人工驯繁条件下,在其日粮中添加不同剂量的壳聚糖会对红嘴相思鸟产生怎样的生理效应呢?本研究正是致力于探究热应激对红嘴相思鸟造成的生理影响,旨在寻找抗红嘴相思鸟热应激的有效办法,为攻克红嘴相思鸟人工驯繁关键技术提供健康保障.
1 材料与方法
1.1 试验动物及基础日粮
试验动物为西华师范大学鸟类驯繁室人工饲养的80只健康成年红嘴相思鸟(♀).基础日粮参照NCR(1994)推荐的鹌鹑营养需要,基础日粮组成及营养水平见表1.
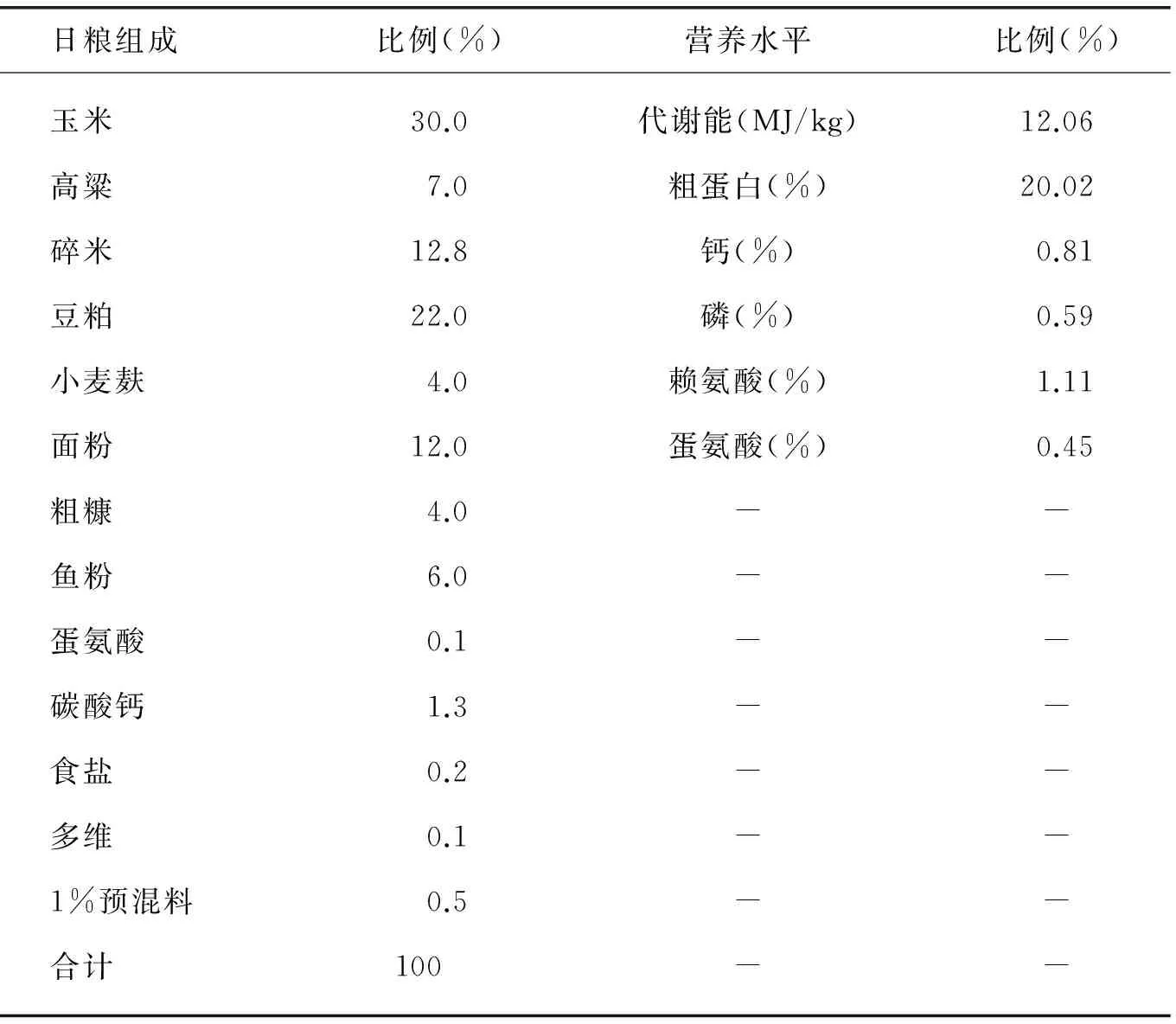
表1 基础日粮组成及营养水平
注:1%预混料为每千克日粮提供:铁100mg,锌25mg,铜6mg,猛90mg,硒0.2mg,碘0.3mg,镁0.05mg.
1.2 试验设计
采用单因子试验设计,将80只红嘴相思鸟随机分为5个处理组,每个处理4个重复,每个重复4只鸟.其中设常温对照组1个,饲喂基础日粮,热应激组4个,分别饲喂在基础日粮中添加0%,0.1%,0.5%,和1%壳聚糖(脱乙酰度>90%,黏度60mpa.s-100mpa.s,山东济南海德贝生物工程有限公司)的日粮.自由采食和饮水,常温饲养(温度18℃-25℃,湿度50%-70%)30d后,将热应激组饲养温度上升至35℃持续3h.见表2.
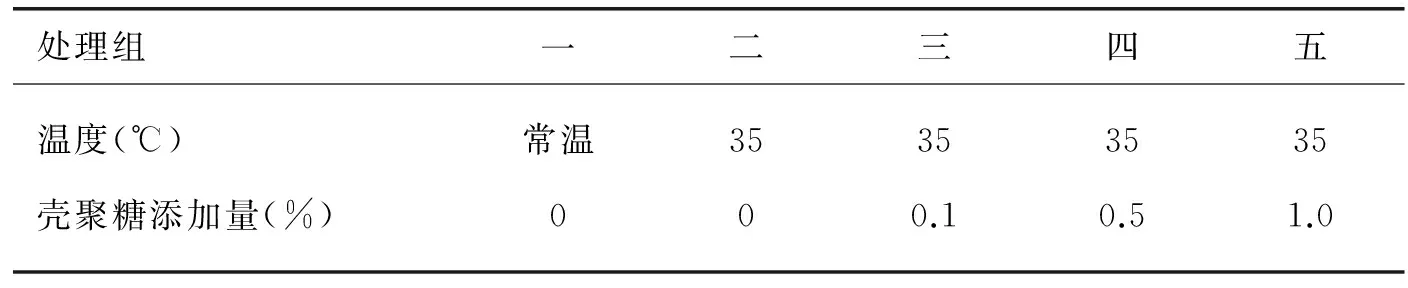
表2 试验设计表
1.3 样品采集与制备
1.3.1 血浆的采集与制备
饲喂试验结束后,从每个重复中随机选取1只红嘴相思鸟,翅静脉采血于肝素抗凝管中,轻摇抗凝管,收集抗凝血,4 000r/min冷冻离心10min,分离血浆,保存于-80℃冰箱中备用.
1.3.2 组织样品的采集与制备
应激实验结束后,每组随机选取一只红嘴相思鸟经氨基甲酸乙酯麻醉,解剖,取肝脏和左侧同一位置胸肌,液氮速冻后,置-80℃冰箱中保存.
分别取冷冻的肝脏和胸肌,4℃解冻后用滤纸吸干表面的水分,后称重(精确至0.01g),将肝脏或胸肌放于玻璃匀浆器中,加9倍该重量的预冷生理盐水,0-4℃匀浆,之后在4℃条件下2500r/min或3000r/min离心10min,取上清液用于各抗氧化指标的测定.
1.4 检测指标和方法
采用酶联免疫吸附法(ELISA)检测血浆免疫球蛋白G、免疫球蛋白A和免疫球蛋白M,检测试剂盒均购自浙江伊利康生物技术有限公司.
采用紫外分光光度法检测谷胱甘肽-过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA),测试盒均购自南京建成生物工程研究所.
1.5 数据处理
试验所得数据用Microsoft Excel整理,后用IBM SPSS Statistics 19.0进行方差分析,对差异性显著的,用Duncan’s法进行多重比较分析,试验结果以平均数±标准误的形式表示.
2 结 果
2.1 热应激对红嘴相思鸟及壳聚糖对热应激红嘴相思鸟免疫球蛋白的影响
除IgA外,各处理组基本表现为热应激对照组免疫球蛋白浓度较常温对照组有所下降,添加壳聚糖组免疫球蛋白浓度较热应激对照组又有不同程度的提高.现详述如下:热应激对照组血浆IgG浓度较常温对照组低7.48%,差异不显著(P>0.05),各壳聚糖组IgG浓度均有提高,其中1%壳聚糖组IgG浓度比热应激对照组高12.7%,差异显著(P<0.05);各处理组间IgA浓度无显著差异;热应激对照组血浆IgM浓度较常温对照组低,各壳聚糖组IgM浓度均高于热应激对照组,其中0.5%壳聚糖组IgM浓度最高,达到显著水平.此外,0.5%和1%壳聚糖组IgG及IgM浓度均已高于常温对照组,但差异不显著.见表3.
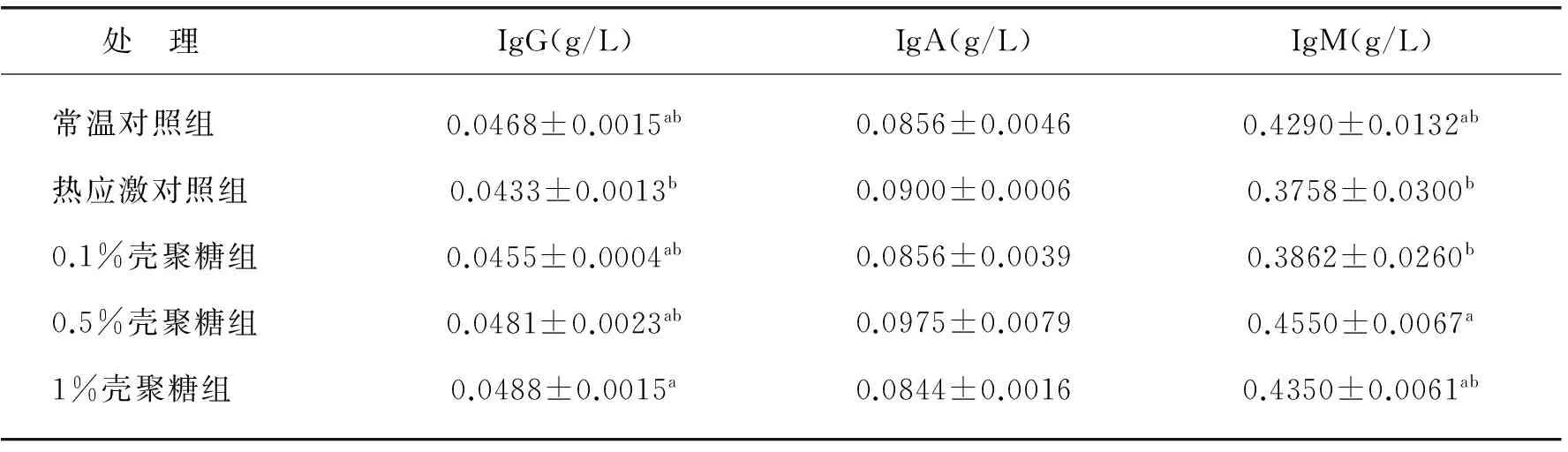
表3 壳聚糖对热应激红嘴相思鸟血浆免疫球蛋白的影响(g/L)
注:各组值均为平均数±标准误,n=4.同列之间标注不同小写字母表示差异显著(P<0.05).以下表4-5同.
2.2 热应激对红嘴相思鸟及壳聚糖对热应激红嘴相思鸟抗氧化酶活性的影响
就总体趋势而言,热应激对照组抗氧化酶活均小于常温对照组,而各壳聚糖组抗氧化酶活又较热应激对照组有不同程度的提高.此外,0.5%和1%壳聚糖组血浆T-SOD酶活高于常温对照组,且以0.5%壳聚糖组最高,达到显著水平(P<0.05).现按不同抗氧化酶顺序分述如下:
T-SOD酶活的变化表现为:血浆中,0.5%和1%壳聚糖组T-SOD酶活分别比热应激对照组高33.55%和29.83%,达到显著水平(P<0.05),而0.1%壳聚糖组T-SOD酶活比热应激对照组高18.39%,差异不显著;肝脏中,热应激对照组T-SOD酶活比常温对照组小21.7%,差异显著(P<0.05),0.1%、0.5%和1%壳聚糖组T-SOD酶活分别比热应激对照组高14.27%、17.20%和8.56%,但差异不显著(P>0.05);肌肉中,热应激对照组T-SOD酶活显著低于常温对照组,0.1%、0.5%和1%壳聚糖组T-SOD酶活分别比热应激对照组高5.00%、22.63%和25.58%,其中1%壳聚糖组较热应激对照组差异显著(P<0.05).
GSH-PX酶活的变化表现为:肝脏中热应激对照组GSH-PX酶活显著低于常温对照组(P<0.05),而各壳聚糖处理组间无显著差异(P>0.05);血浆和肌肉中GSH-PX酶活在各处理组间均无显著差异.同时,各壳聚糖GSH-PX酶活均以0.5%壳聚糖组最高.
CAT酶活的变化表现为:肝脏中热应激对照组CAT酶活显著低于常温对照组(P<0.05),而各壳聚糖处理组间无显著差异(P>0.05),但分别比热应激对照组高20.09%、23.26%和7.55%;血浆和肌肉中CAT酶活在各处理组间均无显著差异.
详见表4.
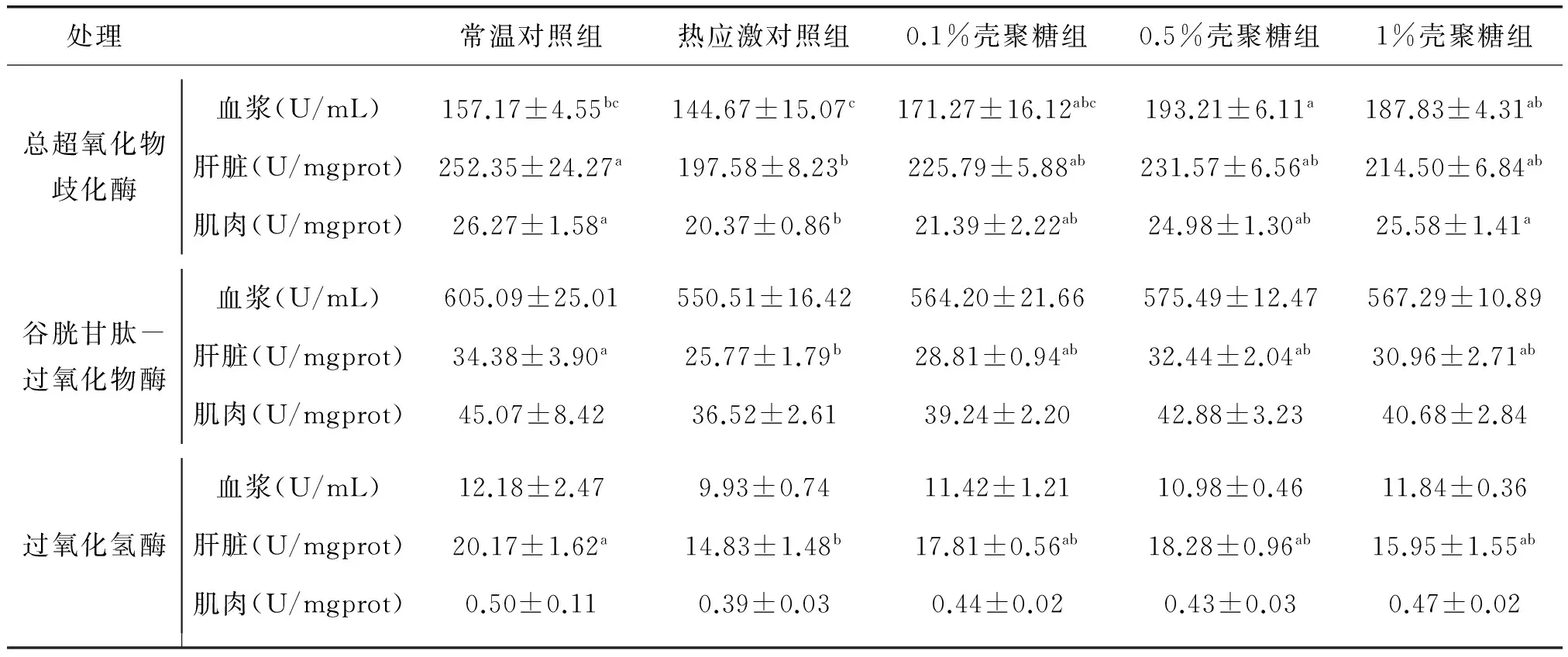
表4 壳聚糖对热应激下红嘴相思鸟抗氧化酶活的影响
2.3 热应激对红嘴相思鸟及壳聚糖对热应激红嘴相思鸟MDA含量的影响
总体趋势表现为:热应激对照组MDA含量均高于常温对照组,各壳聚糖组MDA含量又低于热应激对照组,且均高于常温对照组.具体表现为:血浆中,热应激对照组MDA含量显著高于常温对照组,各壳聚糖组间差异不显著,其中1%壳聚糖组MDA含量显著低于热应激对照组;肝脏中MDA含量在各处理组间差异不显著;肌肉中,热应激对照组MDA含量显著高于常温对照组(P<0.05),而各壳聚糖处理组间差异不显著(P>0.05).详见表5.
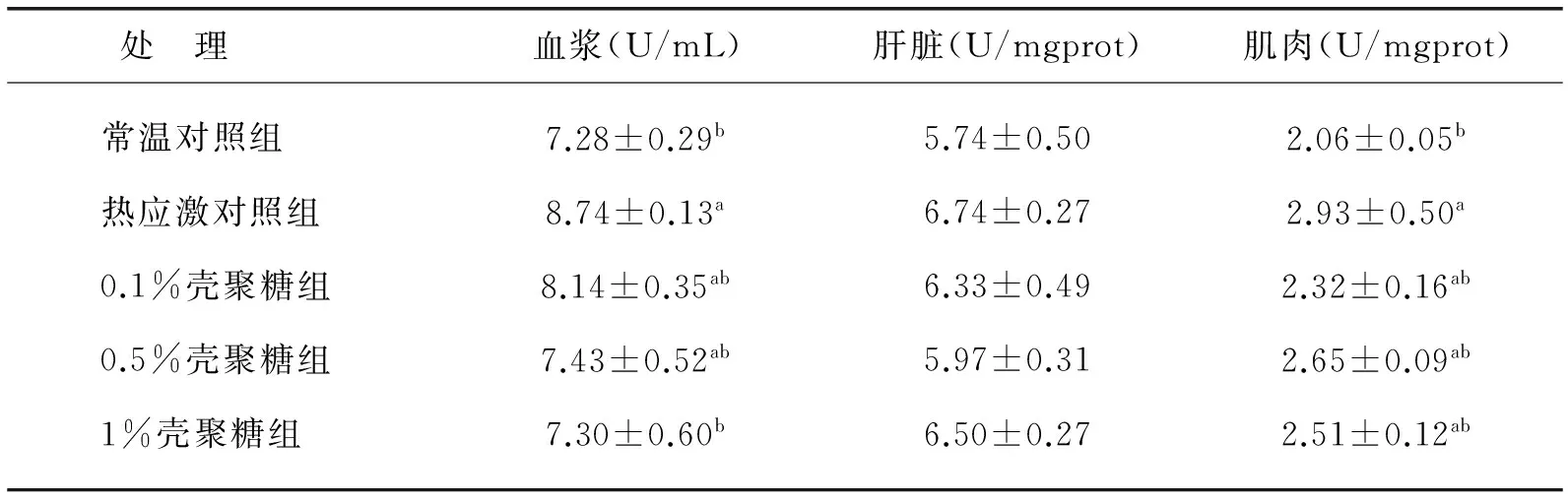
表5 壳聚糖对热应激红嘴相思鸟MDA含量的影响
3 讨 论
3.1 热应激对红嘴相思鸟及壳聚糖对热应激红嘴相思鸟免疫球蛋白的影响
大量研究表明,过度的热应激可降低血清免疫球蛋白的含量,抑制体液免疫和细胞免疫[11,12].1980年Kelley研究表明,犊牛暴露于高温下,其IgG显著降低,而IgM变化不明显[13];近年来,仲庆振等研究也发现,热应激会导致鹅血清白蛋白含量显著降低[14].同时,Lim等研究发现,壳聚糖可提高大鼠肠系膜淋巴结中淋巴细胞的IgA、IgG和IgM的含量[15].但是,截止目前尚无关于壳聚糖对热应激动物免疫功能影响的研究报道.本试验结果表明,热应激对照组与常温对照组相比免疫球蛋白有降低的趋势,说明热应激会导致红嘴相思鸟血清中免疫球蛋白含量降低,造成免疫抑制,这与前人研究结果一致;其次,各壳聚糖组IgG和IgM浓度均高于热应激对照组,这说明在热应激状态下,壳聚糖可以促进免疫球蛋白的产生,从而抑制由热应激引起的免疫球蛋白含量的降低,有缓解热应激的效应.同时,当壳聚糖的添加剂量在0.5%时,IgA和IgM的浓度均达到最大,且IgM浓度的增加量较热应激对照组达到显著水平(P<0.05),因此,当壳聚糖的添加剂量在0.5%时免疫球蛋白浓度的增加较为理想.
此外,热应激对照组IgA含量为何不降反升,以及壳聚糖抗应激效应的作用机理仍值得继续深入研究.
3.2 热应激对红嘴相思鸟及壳聚糖对热应激红嘴相思鸟抗氧化能力的影响
生物体内的抗氧化酶主要有SOD、GSH-PX、CAT等,SOD可清除超氧阴离子自由基;GSH-PX可催化还原性谷胱甘肽(GSH)和H2O2的反应,将H2O2还原成H2O;CAT同样能催化H2O2的还原.这三种酶的活性可以反映机体的抗氧化能力.而MDA是脂质过氧化产物,测定机体MDA的含量可反映机体脂质过氧化的程度,间接反映机体的抗氧化能力.因此,检测血液或组织中SOD、GSH-PX、CAT酶活及MDA含量,是研究机体抗氧化能力的有效办法.
有研究表明,热应激可打破机体自由基产生和清除之间的平衡,降低抗氧化酶(T-SOD、GSH-PX、CAT等)活力,导致机体组织氧化损伤[16].同时,Qiao等研究发现,壳聚糖可缓解大鼠由脂多糖(LPS)刺激引起的GSH-PX和CAT活性的降低,和MDA含量的升高,增强大鼠的抗氧化能力[17];袁春营等也研究发现,一定水平的低聚壳聚糖能够显著提高河蟹血清中超氧化物歧化酶、过氧化氢酶的活性,并明显提高其免疫保护率[18].但是,截止目前尚无关于壳聚糖对热应激动物抗氧化功能影响的研究报道.本试验结果表明:热应激对照组的T-SOD酶活、GSH-PX酶活和CAT酶活均不同程度的低于常温对照组,而MDA含量高于常温对照组,这与前人研究结果一致,说明热应激可以抑制红嘴相思鸟的抗氧化功能,进而造成红嘴相思鸟的氧化损伤;接下来,添加壳聚糖的实验表明:壳聚糖添加组的T-SOD酶活、GSH-PX酶活和CAT酶活均不同程度高于热应激对照组,而MDA含量均低于热应激对照组,表明壳聚糖可以抑制因热应激引起的抗氧化功能的降低,缓解热应激对系统造成的氧化损伤.进一步分析实验所得数据发现,抗氧化酶活表现出随壳聚糖添加剂量的增加先增加再降低的趋势,其中尤以GSH-PX酶活的变化最具代表性,血浆、肝脏、肌肉中均以0.5%壳聚糖组GSH-PX酶活性最高,并且当壳聚糖的添加剂量为0.5%时,血浆中T-SOD酶活比热应激对照组高33.55%,达到显著水平(P<0.05),因此,在热应激状态下,当壳聚糖的添加剂量为0.5%时机体的抗氧化能力最为理想.
此外,值得指出的是,近年来,有研究发现轻度热应激可通过对机体细胞增殖、分化的调节,使机体产生积极的正面效应[19].本研究与这一研究结果不符,究其原因,本试验所用的红嘴相思鸟种源采自四川老君山国家级自然保护区,该区域气候属亚热带湿润季风气候,年均温度12.0-14.7℃,极端高温29℃[20].35℃的热应激设定温度对于普通家养动物来说可能是轻度热应激,但是对于很好适应了12.0-14.7℃的红嘴相思鸟就又是重度热应激了.
4 结 论
热应激会导致红嘴相思鸟免疫球蛋白(除IgA)含量降低,体内抗氧化酶活力下降,脂质过氧化产物含量升高,造成红嘴相思鸟免疫功能抑制及机体氧化损伤.而壳聚糖又能不同程度的提高免疫球蛋白(除IgA)的含量,增强体内抗氧化酶活力,缓解体内脂质过氧化状况,从而抵御热应激对其造成的损伤.同时,壳聚糖的添加剂量在0.5%时,机体表现出最佳的抗应激能力.因而在人工驯繁红嘴相思鸟的过程中,可以通过营养调控的手段,在其日粮中添加合适浓度的壳聚糖或饲喂含壳聚糖较高的食物,以抵御热应激对其造成的损伤,从而加快其人工驯繁进程,进而有效缓解野外种群生存压力.
[1] 郑光美.中国鸟类分类与分布名录(第二版)[M].北京:科学出版社,2011.
[2] 郭文场,周淑荣,包秀芳,等.红嘴相思鸟饲养管理[J].特种经济动植物,2009,(9):9-11.
[3] 马 强,肖文发,苏化龙.湖北兴山红嘴相思鸟繁殖生态初报[J].动物学杂志,2010,45(2):46-51.
[4] 孙继和.红嘴相思鸟的笼养技术[J].中国家禽,1996,(5):37-38.
[5] 张 宁,孙照渤,曾 刚.1955—2005年中国极端气温的变化[J].南京气象学院学报,2008,31(1):123-128.
[6] SELYE H.The Stress Syndrome[J].The American Journal of Nursing,1965,65(3):97-99.
[7] KANATT S R,CHANDER R,SHARMA A.Chitosan Glucose Complex-A Novel Food Preservative[J].Food Chemistry,2008,106(2):521-528.
[8] YAO Q,SUN T,ZHOU D X,et al.Antoioxidant Activity of Carboxymethyl Chitosan with Different Substituted Degrees[J].Agricultural Science & Technology,2008,9(1):5-7.
[9] 李明春,付青姐,刘 旭.羧甲基壳聚糖抗应激损伤的作用[J].实用医药杂志,2008,25(2):221.
[10] 刘小华,龙国珍.红嘴相思鸟繁殖习性的初步研究[J].广西科学院学报,1986,2(1):17-21.
[11] 唐 嘉,谢 佳,李中文,等.热应激对鸡免疫系统的影响及预防研究进展[J].贵州农业科学,2011,39(12):170-173.
[12] 赵 楠,李光华.热应激对机体免疫系统影响研究的进展[J].宁夏医学杂志,2014,36(6):564-566.
[13] KELLEY K W.Stress and Immune Function:a Bibliographic Review[J].Annales de Recherches Veterinaires,1980,11(4):445-478.
[14] 仲庆振,王 丹,孙泽威,等.急性热应激期间鹅血清生化指标和相关激素变化规律的研究[J].中国畜牧杂志,2013,49(17):74-77.
[15] LIM B O,YAMADA K,NONAKA M,et al.Dietary Fibers Modulate Indices of Intestinal Immune Function in Rats[J].Nutrion,1997,127(5):663-667.
[16] 董淑丽,邓 雯,雷雪芹,等.热应激对动物理化特性及生产性能的影响[J].河南科技大学学报(农学版),2003,23(1):59-66.
[17] QIAO Y,BAI X F,DU Y G.Chitosan Oligosaccharides Protect Mice from LPS Challenge by Attenuation of Inflammation and Oxidative Stress[J].International Immunopharmacology,2011,1(11):121-127.
[18] 袁春营,张 艳,崔青曼.低聚壳聚糖对中华绒螯蟹免疫功能的影响[J].中国饲料,2014,(6):27-30.
[19] PARK H G,HAN S I,OH S Y,et al.Cellular Responses to Mild Heat Stress[J].Cellular and Molecular Life Sciences,2005,62(1):10-23.
[20] 周明强,袁施彬,周材权,等.四川老君山自然保护区红嘴相思鸟繁殖生态初报[J].四川动物,2012,31(6):965-1014.
Studies on Heat Stress and Effect of Chitosan Anti-stress of Leiothrix lutea
LIU Ming,WANG Xi-long,YUAN Shi-bin,ZHOU Cai-quan
(Institute of Rare Animals and Plants,College of Life Sciences,China West Normal University,Nanchong;Key Laboratory of Southwest China Wildlife Resources Conservation(Ministry of Education),Nanchong,637009,China)
In order to explore the effect of heat stress on the physiological function of red billed Leiothrix(Leiothrixlutea),and the anti-stress effect of chitosan,we used single factor experiment design to assign 80 healthy adult female red billed Leiothrixs to the five treatments,randomly(Treatment 1 is the normal control group,treatment 2,3,4,5 are acute heat stress group,treatment temperature is 35℃ for 3 h).And we added 0%,0%,0.1%,0.5%,and 1% of chitosan to the basic diet,respectively,to detect the concentration of IgG,IgM and IgA in plasma,the antioxidant enzyme activity in organization and the content of lipid peroxide malondialdehyde(MDA).The results showed that:the concentration of immunoglobulin(except IgA) decreased in the control group of heat stressed red billed Leiothrix,comparing with the normal temperature control group;the activity of anti-oxidative enzyme decreased(the activity of T-SOD was decreased significantly in three kinds of tissue,the activity of GSH-PX and CAT were significantly reduced in liver),the level of lipid per oxidation was increased(the content of MDA increased significantly in the liver and muscle);chitosan can improve the level of immune globulin to a variable extent(except for IgA),increase the activity of anti-oxidative enzyme,alleviate the status of lipid per oxidation,and the body of red billed Leiothrix showed the best anti-stress ability,when we added 0.5% of chitosan.
Leiothrixlutea;chitosan;heat stress;anti-stress
1673-5072(2015)01-0001-06
2014-09-25
国家自然科学基金(31470462).西华师范大学西南野生动植物资源保护教育部重点实验室开放基金项目(XNYB11-4)
刘 明(1988-),男,湖北随州人,野生动植物保护与利用专业硕士研究生,主要从事野生动物营养生态研究.
袁施彬(1971-),女,四川绵竹人,西华师范大学生命科学学院副教授,主要从事动物营养与动物保护生物学研究工作.
Q958.14
B
