幽门螺杆菌感染与胰腺癌相关性的累积Meta分析
2015-03-14曾维琼刘智力
邓 勇,曾维琼,詹 柱,刘智力
(重庆医科大学附属第二医院感染科 400010)
胰腺癌是消化系统常见的恶性肿瘤之一[1]。由于缺乏有效的筛查与早期诊断方法,患者在确诊时多属晚期或已发生转移,以手术为主的治疗方式对患者预后的影响并不显著。目前,胰腺癌尚无有效的治疗方案,其病死率位居所有癌症之首,且患者平均生存时间仅为3~6个月[2]。因此,探究胰腺癌相关危险因素与有效的防治措施,对减少这种恶性疾病的发病率具有重要意义。然而,对胰腺癌相关危险因素的研究仍有待进一步深入。年龄与吸烟是目前被公认的对胰腺癌发病有确定性作用的危险因素;此外,潜在的危险因素还包括慢性胰腺炎、肥胖、2型糖尿病等[3-4]。目前,研究已确认幽门螺杆菌为消化性溃疡的主要致病因素,并与胃癌、胃淋巴瘤密切相关[5-6]。相关流行病学研究显示,幽门螺杆菌可能参与胰腺癌的发病进程,但仍缺乏统一、充分的证据[7-12]。因此,本研究对相关临床研究进行累积Meta分析,旨在研究胰腺癌与幽门螺杆菌感染的相关性。
1 资料与方法
1.1 资料来源与检索 本文对研究幽门螺杆菌与胰腺癌潜在关系的文献进行系统回顾与分析。以 Medline、EMBASE、Cochrane、PubMed、维普数据库为主要来源,此外还检索相关参考文献与胃肠病学会议摘要,文献截止日期为2014年9月。中文检索词:胰腺癌、胰腺肿瘤、幽门螺杆菌、幽门弯曲杆菌、消化性溃疡等;英文检索词:pancreatic cancer、pancreatic tumor、pancreatic neoplasm、helicobacter pylori、幽门螺杆菌、campylobacter pylori、peptic ulcer disease等。
1.2 纳入标准 纳入已发表的研究幽门螺杆菌感染与胰腺癌相关性的临床对照研究。胰腺癌患者(病例组)与健康对照者(对照组)均为年龄18周岁以上的成年人;病例组患者通过组织学活检确证为胰外分泌性胰腺癌;采用血清学检验,包括ELISA法诊断幽门螺杆菌感染;研究数据包括病例组与对照组的幽门螺杆菌感染率,并对二者进行统计学分析。排除无对照、无原始数据、数据不全、综述性文献,以及病例报告等。
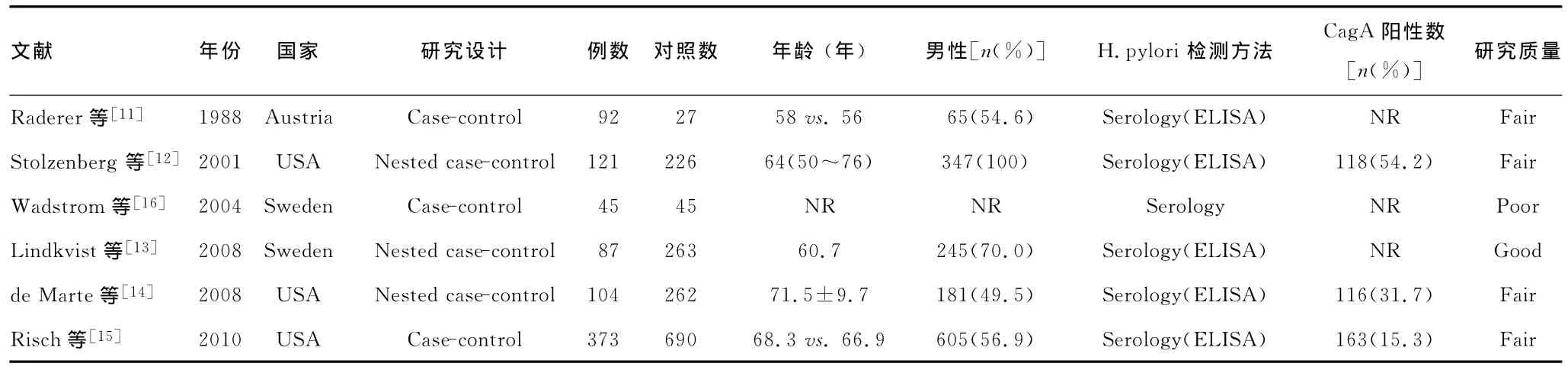
表1 纳入的研究文献的基本特征及质量评价
1.3 数据收集及质量评价 由2位研究人员分别按上述策略独立收集资料,严格按照纳入标准对新增研究进行筛选。从每个研究获得的数据包括研究设计、病例纳入情况、方法学质量标准、研究人群、患者基线特征、胰腺癌诊断方式、与主要结论相关的数据。对于难以决定是否纳入的研究,通过2位研究人员讨论解决分歧。由2位研究者独立地对所纳入的临床研究进行质量评价,评价项目包括研究基线相似性、研究对象的选择方法、暴露变量的测定方法、病例组与对照组研究中混杂因素的控制及其统计分析方法。每个纳入的临床研究根据上述评价标准分为高、中等与低质量3个等级。
1.4 观察指标 本研究首先比较病例组与对照组幽门螺杆菌的感染率。某些宿主或遗传因素可能改变幽门螺杆菌的易感性与感染持久性,从而影响幽门螺杆菌的致癌性。研究认为CagA阳性菌株更易导致感染患者发生炎症、溃疡与恶性转化,并被证实与胃癌的发病机制相关。感染这类幽门螺杆菌菌株,此外还包括vasA s1阳性菌株、vacA m1阳性菌株与babA2阳性菌株,均可能会增加具有胰腺癌阳性家族史或促炎因子IL-1、肿瘤坏死因子α(TNF-α)基因多态性患者的癌变风险。早期生活环境与幽门螺杆菌毒性菌株感染均可能影响胰腺癌患者5~8年后的疾病进程。因此,本研究进一步对CagA阳性与胰外分泌性胰腺癌的相关性进行了亚组分析。
1.5 统计学处理 采用CMA V2.0软件对文献进行Meta分析(Biostat)。采用随机效应模型(D-L法)计算合并调整后的及其95%CI。并对纳入的研究,按照发表的时间顺序进行累积Meta分析。采用I2统计量评价各项研究间的异质性,当I2<50%时,认为研究之间存在显著异质性。绘制漏斗图并采用Egger′s法检验纳入的研究是否存在发表偏倚。以P<0.05为差异有统计学意义。
2 结 果
2.1 研究特征及质量 初检获得32篇相关的研究文献,对标题与摘要进行初筛,排除25篇由于受试对象并非患者或健康者、非观察性研究或缺少幽门螺杆菌感染率数据等原因而不符合纳入标准的研究文献。余下的9篇研究文献中,其中1篇病例为非胰腺癌患者,1篇缺少可靠的分析数据,因此均予以排除。最终纳入6项观察性研究,共包括2 335例研究对象,其中病例组822例,对照组1 513例[11-16]。观察性研究的检索及纳入。纳入研究的特征见表1。各研究的患者数为90~1 063例,平均/中位年龄在47.5~68.0周岁,男性比例为49.5%~100.0%。6项研究均采用血清学分析确证幽门螺杆菌感染。Raderer等[11]、Risch等[15]及 Wadstrom 等[16]的研究均为病例对照研究,其余3项为巢式病例对照研究[12-14]。其中,4项研究的质量评价结果为中等[11-12,14-15],1项为高质量[13],1项为低质量[16]。各研究进行多因素分析时考察的协变量不尽相同。其中,5项研究考察吸烟对因变量的影响[11-15],4项研究考察年龄的影响[11-13,15],3项研究考察 性 别 的影响[11,13,15],此外,各 有1项研究分别考察 BMI[13]、饮酒[13]、教育水平[14]与 ELISA 板数[16]。异质性检验显示各研究间不存在异质性(I2=13.8%)。
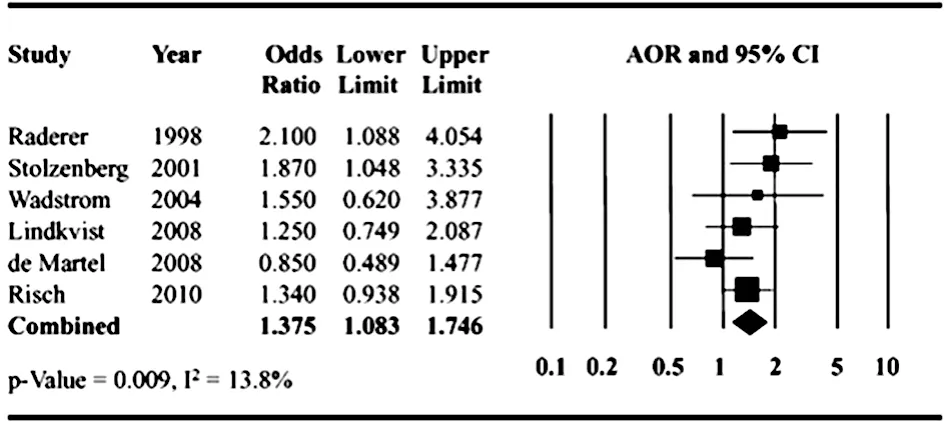
图1 合并调整后的AOR森林图

图2 漏斗图分析
2.2 Meta分析结果 Meta分析结果显示,幽门螺杆菌感染与胰腺癌的发展存在显著相关性(AOR=1.38,95%CI:1.08~1.75,P=0.009),见图1。异质性检验显示各研究间不存在异质性(I2=13.8%)。采用漏斗图评价发表偏移,结果显示并不排除存在发表偏倚,但Egger′s加权回归分析结果显示存在发表偏倚的可能性很低(P=0.662)。在4项质量评价结果为中等的研究中,其中3项报道了CagA阳性菌株感染,合并研究结果并进行Meta分析,结果显示血清幽门螺杆菌CagA抗体阳性与胰腺癌无显著相关性(AOR=1.14,95%CI:0.66~1.97,P=0.639)[12,14-15]。累积 Meta分析结果显示,随着新的研究文献的发表,虽然点估计值随时间不断减小,但幽门螺杆菌感染与胰腺癌之间的相关性始终差异有统计学意义(P<0.05),见图2~3。有研究结果显示,点估计值无显著变化,可能达到平台期,目前仍需要更多的研究进一步确证[12]。
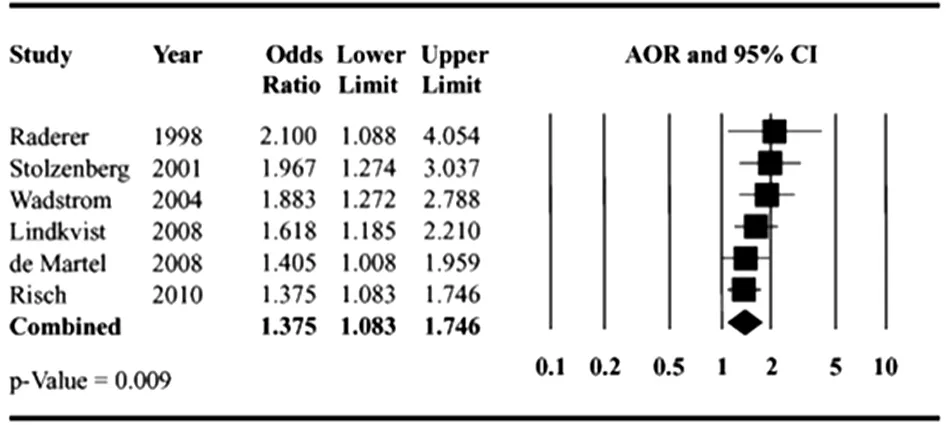
图3 累积Meta分析结果
3 讨 论
本研究采用Meta分析评价幽门螺杆菌感染这一可预防的危险因素与胰腺癌病原学之间的相关性。按文献发表年代顺序合并6项研究结果进行Meta分析,评估了共2 335例研究对象,结果显示幽门螺杆菌感染与胰腺癌之间存在显著相关性(AOR=1.38,95%CI:1.08~1.75,P=0.009)。本研究的结果与Risch等[15]报道的结果相似,并且本研究的方法学更为详细。此外,本研究的累积Meta分析结果表明虽然二者之间存在显著相关性,但显著性随时间不断降低。因此,仍需要具有不同患者人群与较大样本量的研究进一步验证本研究所获得的结果。值得注意的是,目前所纳入的6项研究结果仅能说明幽门螺杆菌感染与胰腺癌之间的相关性可能存在,需要对二者的因果关系做进一步研究。
此外,已发表的Meta分析结果显示幽门螺杆菌感染还与结直肠癌、肝细胞癌、肺癌及喉癌的发展相关[17-20]。然而,幽门螺杆菌感染增加癌变风险的具体机制有待进一步研究。目前研究者提出了一些理论解释幽门螺杆菌感染与胰腺癌之间可能的关联。Nilsson等[21]检测了来自胰腺癌患者组织样本中的胃幽门螺杆菌与其他肠螺杆菌的16S核糖体DNA,并与对照组进行比较。他们认为,与急性幽门螺杆菌感染相关的促炎因子、活性氧,以及其他炎症介质可能引发组织炎症、增加基因组DNA损伤并导致细胞恶性增殖,从而进一步导致抑癌基因失活、促进胰腺细胞癌变。Takayama等[22]认为人胰腺细胞感染幽门螺杆菌可能增加其癌变风险,并且与胃癌的发生机制类似。发生幽门螺杆菌感染的胃癌患者体内,血清中的IL-8与VEGF水平显著升高,而研究证实这些分子可促进血管生成和恶性肿瘤的生长、转移。此外,幽门螺杆菌感染可增加NF-κB、激活蛋白-1与人胰腺癌细胞血清反应元件的活性,并且还可使胰腺癌细胞表达CagA蛋白,从而进一步激活血清反应元件[22]。总体而言,研究者认为幽门螺杆菌感染可增加炎性细胞因子与血管生成因子的分泌,并最终导致胰腺细胞癌变。
在发展中国家、经济欠发达地区及老年人群中胃肠道幽门螺杆菌的感染率非常高。另一种假说认为幽门螺杆菌在胃窦部的感染增殖与胃酸分泌增加有关,并可进一步导致十二指肠促胰液素的分泌不受限制。因此,可增加胰腺碳酸氢盐分泌、促进DNA合成,从而导致胰腺导管增生与胰腺细胞癌变[23]。此外,一项以仓鼠为模型动物的研究显示,促胰液素的刺激可加速由亚硝胺类物质导致的胰腺癌的发生、发展。
第3种假说认为幽门螺杆菌在胃体的感染增殖可导致壁细胞减少、胃酸分泌减少,从而发生高胃泌素血症。胃酸过少促进细菌过度增殖,产生大量N-亚硝基化合物,并通过血液循环达到胰腺,激活胰腺导管上皮。此外,由幽门螺杆菌感染引起的胃炎可减少抗氧化剂的吸收,如维生素C。近来的研究显示,胃溃疡可增加胰腺癌发病风险,而十二指肠溃疡则不支持该假说。综合上述理论,胃癌与胰腺癌的流行病学特征及潜在的致病因子之间可能具有相似性,包括饮食结构不合理、吸烟与社会经济状况不佳等,并且这些因素也与幽门螺杆菌感染有关。
同时,本研究的分析评价尚存一些不足:(1)对各研究文献进行分析时,相关混杂因素难以有效控制,将影响Meta分析结论的可靠性;(2)纳入的研究文献较少无法进行详细的亚组分析;(3)本研究的汇总分析结果显示幽门螺杆菌感染与胰腺癌之间存在显著相关性,但是AOR值不高。一些流行病学家认为OR>2时才具有临床相关性,而本研究的AOR=1.38,因此幽门螺杆菌感染与胰腺癌之间的临床相关性尚存争议,仍需更多研究予以证明。
综上所述,现有证据表明幽门螺杆菌感染与胰腺癌之间呈正相关。但仍需要更多大样本量的高质量临床研究进一步证实这一结论并深入发掘潜在致病机制。
[1] Yadav D,Lowenfels AB.The epidemiology of pancreatitis and pancreatic cancer[J].Gastroenterology,2013,144(6):1252-1261.
[2] Cooperman AM.Pancreatic cancer:the bigger picture[J].Surg Clin North Am,2001,81(3):557-574.
[3] Hidalgo Pascual M,Ferrero Herrero E,Castillo FéMJ,et al.Epidemiology and diagnosis of the pancreatic cancer[J].Rev Esp Enferm Dig,2004,96(10):714-722.
[4]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[5] Wolfgang CL,Herman JM,Laheru DA,et al.Recent progress in pancreatic cancer[J].CA Cancer J Clin,2013,63(5):318-348.
[6] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[7] Li D,Xie K,Wolff R,et al.Pancreatic cancer[J].Lancet,2004,363(9414):1049-1057.
[8] Raimondi S,Maisonneuve P,Lowenfels AB.Epidemiology of pancreatic cancer:an overview[J].Nat Rev Gastroenterol Hepatol,2009,6(12):699-708.
[9] Correa P,Houghton JM.Carcinogenesis of helicobacter pylori[J].Gastroenterology,2007,133(2):659-672.
[10]Tonkic A,Tonkic M,Lehours P,et al.Epidemiology and diagnosis of helicobacter pylori infection[J].Helicobacter,2012,17Suppl 1:1-8.
[11]Raderer M,Wrba F,Kornek G,et al.Association between Helicobacter pylori infection and pancreatic cancer[J].Oncology,1998,55(1):16-19.
[12]Stolzenberg-Solomon RZ,Blaser MJ,Limburg PJ,et al.Helicobacter pylori seropositivity as a risk factor for pancreatic cancer[J].J Natl Cancer Inst,2001,93(12):937-941.
[13]Lindkvist B,Johansen D,Borgstrom A,et al.A prospective study of Helicobacter pylori in relation to the risk for pancreatic cancer[J].BMC Cancer,2008(8):321.
[14]de Martel C,Llosa AE,Friedmana GD,et al.Helicobacter pylori infection and development of pancreatic cancer[J].Cancer Epidemiol Biomarkers Prev,2008,17(5):1188-1194.
[15]Risch HA,Yu H,Lu LE,et al.ABO blood group,helicobacter pylori seropositivity,and risk of pancreatic cancer:a case-control study[J].J Natl Cancer Inst,2010,102(7):502-505.
[16]Wadstrom T,Fryzek J,Demirjan S,et al.Antibodies to helicobacter bilis in patients with pancreatic carcinoma[J].Helicobacter,2004,9:538-539.
[17]Kosunen TU,Pukkala E,Seppala K,et al.The effect of eradication therapy for Helicobacter pylori infection on the incidence of gastric and other cancers[J].Helicobacter,2006(11):362.
[18]Xuan SY,Xin YN,Chen AJ,et al.Association between the presence of H pylori in the liver and hepatocellular carcinoma:a meta-analysis[J].World J Gastroenterol,2008,4(2):307-312.
[19]Zhuo WL,Zhu B,Xiang ZL,et al.Assessment of the relationship between helicobacter pylori and lung cancer:a meta-analysis[J].Arch Med Res,2009,40(5):406-410.
[20]Zhuo XL,Wang Y,Zhuo WL,et al.Possible association of Helicobacter pylori infection with laryngeal cancer risk:an evidence-based meta-analysis[J].Arch Med Res,2008,39(6):625-628.
[21]Nilsson HO,Stenram U,Ihse I,et al.Helicobacter species ribosomal DNA in the pancreas,stomach and duodenum of pancreatic cancer patients[J].World J Gastroenterol,2006,12(19):3038-3043.
[22]Takayama S,Takahashi H,Matsuo Y,et al.Effects of helicobacter pylori infection on human pancreatic cancer cell line[J].Hepatogastroenterology,2007,54(80):2387-2391.
[23]Risch HA.Etiology of pancreatic cancer,with a hypothesis concerning the role of N-nitroso compounds and excess gastric acidity[J].J Natl Cancer Inst,2003,95(13):948-960.
