胃癌患者外周血Th17细胞相关因子检测及其临床意义*
2015-03-13张天勇王红羚
张天勇,王红羚
(1.重庆市沙坪坝区妇幼保健院检验科 400030;2.重庆市肿瘤医院 400030)
·临床探讨·
胃癌患者外周血Th17细胞相关因子检测及其临床意义*
张天勇1,王红羚2
(1.重庆市沙坪坝区妇幼保健院检验科 400030;2.重庆市肿瘤医院 400030)
目的 探讨胃癌患者外周血Th17细胞相关因子的临床价值。方法 收集该院2012年6月至2013年6月间30例胃癌患者的外周血,同时检测30例健康者外周血作为健康对照者,采用酶联免疫吸附试验检测血浆Th17细胞相关因子白细胞介素-1β(IL-1β)、白细胞介素-6 (IL-6)、白细胞介素-23 (IL-23)、白细胞介素-17 (IL-17)水平。结果 胃癌患者IL-1β、IL-6、IL-23、IL-17水平均显著高于健康对照者,差异有统计学意义(P<0.01);且晚期胃癌患者IL-6、IL-23、IL-17水平显著高于早期胃癌患者,差异有统计学意义(P<0.05)。结论 Th17细胞相关因子与胃癌密切相关,检测其水平有助于疾病的判断。
胃癌; Th17细胞相关因子; 进展
CD4+T细胞即辅助性T细胞(Th),其在机体介导的免疫应答和免疫调控中发挥重要作用。根据细胞因子表达谱和转录调控子的不同,Th 细胞可分为Th1、Th2、Th17和调节性T细胞[1]。调节性T细胞是免疫抑制性细胞,在多个肿瘤(如结直肠癌、肝癌和胃癌等患者)的外周血中显著增加并抑制效应性T细胞功能,进而介导肿瘤的免疫逃逸[2]。Th17细胞是新近发现的、以分泌白细胞介素-17(IL-17)为主要特征的辅助性T细胞,在细胞因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-23(IL-23)的共同作用下,初始CD4+T细胞可特异性地上调转录因子STAT3和RORγt表达,进而诱导Th17细胞的分化成熟[3]。早期研究显示Th17细胞可防御胞外菌感染、促进自身免疫性疾病的发展并介导免疫移植排斥反应[4]。后期研究发现,Th17细胞与肿瘤的发生、发展以及患者的预后密切相关[5]。胃癌患者的Th17细胞不仅在外周血中的比例显著高于健康者,还与胃癌患者生存时间呈显著负相关,提示Th17细胞可评价胃癌患者的预后[6]。为了进一步明确Th17细胞效应分子及其分化调控相关因子在胃癌外周血的变化情况,现收集胃癌患者外周血,检测其Th17细胞相关因子的水平,同时评价该类因子与不同分期胃癌患者的相关性,为研究胃癌免疫治疗提供临床指导。报道如下。
1 资料与方法
1.1 一般资料 收集重庆市肿瘤医院2012年6月至2013年6月进行胃癌切除手术的30例患者外周血(患者组),其中男14例,女16例,年龄34~65岁。患者临床分期根据最新国际TNM分期标准,其中Ⅰ期患者6例,Ⅱ期患者8例,Ⅲ期患者11例,Ⅳ期患者5例。同时收集重庆市肿瘤医院30例体检健康者的外周血作为健康对照者(健康对照组),其中男15例,女15例,年龄25~72岁。
1.2 方法 采集患者组术前和健康对照组当日外周血2 mL,置于肝素抗凝管,常规离心,收集上层血浆,所有研究对象的外周血均一次性获取,-80 ℃保存,备检。使用酶联免疫吸附试验(ELISA)进行细胞因子IL-1β、IL-6、IL-23、IL-17水平检测。ELISA 试剂盒购于北京嘉美诺斯生物科技有限公司,专人检测,酶标仪应用瑞士TECAN ferrdom Evolyzer 全自动酶免工作站。

2 结 果
2.1 2组研究对象Th17细胞相关因子的检测结果比较 患者组IL-17水平(86.4±14.5 pg/mL)显著高于健康对照组(32.3±8.6 pg/mL),差异有统计学意义(P<0.05);同时检测Th17细胞分化相关细胞因子水平结果显示,患者组IL-1β(66.8±6.2 pg/mL)、IL-6(189.7±19.4 pg/mL)、IL-23(234.6±18.8 pg/mL)均显著高于健康对照组(31.5±6.7、42.5±11.6、90.8±8.5 pg/mL),差异有统计学意义(P<0.05),见图1。
2.2 患者组不同分期胃癌患者外周血Th17细胞相关因子水平的检测结果比较 根据国际最新肿瘤TNM分期标准,将患者组分为早期(Ⅰ+Ⅱ期)和晚期(Ⅲ+Ⅳ期)2组。晚期胃癌患者IL-6、IL-23、IL-17水平(分别为254.9±16.4、287.3±14.2、106.4±9.9 pg/mL)均显著高于早期患者(分别为135.3±18.2、176.2±10.4、59.3±7.5 pg/mL),差异有统计学意义(P<0.05)。虽然早、晚期患者IL-1β水平差异无统计学意义(P>0.05),但与早期比较(56.7±5.6 pg/mL),晚期患者(78.8±6.4 pg/mL)呈增加趋势。见图2。
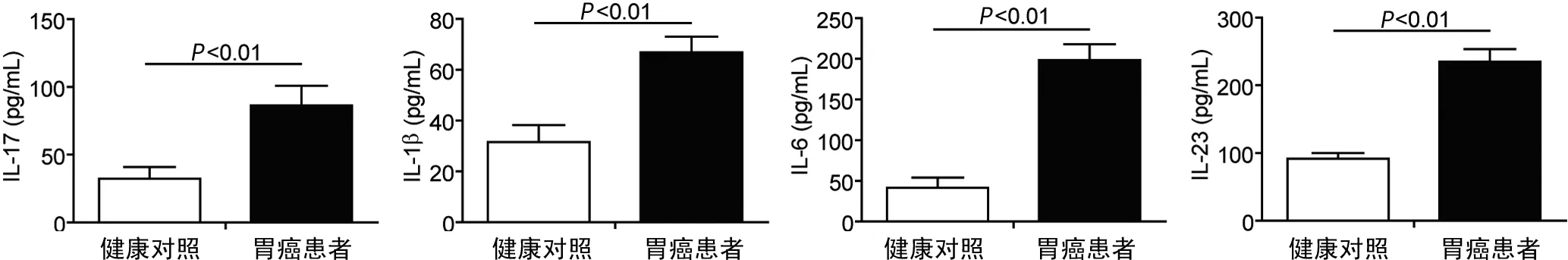
图1 2组研究对象外周血IL-17、IL-1β、IL-6、IL-23水平结果图
3 讨 论
肿瘤发生、发展过程中,机体会产生一系列复杂的抗肿瘤免疫应答,以抵抗肿瘤生长,但肿瘤的不断进展则表明效应性T细胞并不能有效清除肿瘤细胞;不仅如此,肿瘤微环境可诱导T细胞转变成具有促肿瘤活性的免疫抑制性T细胞,进一步导致肿瘤的恶性进程。有研究报道,肿瘤来源的转化生长因子-β(TGF-β)可通过诱导调节性T细胞而产生抑制效应性T细胞的免疫应答,经肿瘤活化的单核细胞则通过分泌细胞因子IL-1β、IL-6、IL-23从而诱导Th17细胞分化导致肿瘤新生血管的形成[7]。
目前,关于胃癌与Th17细胞的研究多集中在Th17细胞水平改变及其与临床的关系。胃癌患者外周血和肿瘤组织中均能检测到Th17细胞水平的显著增加,且晚期胃癌患者Th17水平显著高于早期胃癌患者;同时,高水平Th17细胞的胃癌患者生存时间要小于低水平Th17细胞的胃癌患者[6]。此外,免疫组织化学染色检测提示肿瘤IL-17的表达可独立预测胃癌患者的总体生存率,表明Th17细胞及其效应分子IL-17在胃癌中发挥免疫抑制作用[8]。
本研究结果显示,Th17细胞来源的效应分子IL-17除了在肿瘤组织中表达增加,其在胃癌患者外周血中的水平也显著增加,同时经临床分析统计表明,晚期胃癌患者外周血IL-17的水平显著高于早期胃癌患者,进一步证实Th17细胞及其效应分子IL-17在胃癌中的作用。IL-1β、IL-6、IL-23是协同诱导Th17细胞分化成熟的细胞因子,本组检测胃癌患者外周血中这3个细胞因子的水平,结果发现与健康对照组比较,IL-1β、IL-6、IL-23在患者组外周血中显著增加,且晚期胃癌患者外周血IL-6和IL-23水平明显高于早期胃癌患者,提示其不仅能诱导Th17细胞产生,而且可能与Th17细胞效应分子IL-17共同介导胃癌进展。然而,IL-17促进胃癌发生、发展的具体机制仍不明确。尽管有关研究报道IL-17经其受体促进胃癌细胞系的增殖和损伤修复,但是肿瘤微环境由多种不同类型细胞参与、组成,且单核-巨噬细胞也高表达IL-17受体[9-10]。IL-17是否通过巨噬细胞抑制抗肿瘤免疫应答仍不清楚。
综上所述,Th17细胞相关因子在胃癌患者外周血中发生显著变化并与肿瘤的进展密切相关,进一步明确胃癌Th17细胞促肿瘤调控机制,将为其临床免疫治疗提供新的实验室证据。
[1]Zhou L,Chong MM,Littman DR.Plasticity of CD4+T cell lineage differentiation[J].Immunity,2009,30(5):646-655.
[2]Zou W.Regulatory T cells,tumour immunity and immunotherapy[J].Nat Rev Immunol,2006,6(4):295-307.
[3]McGeachy MJ,Cua DJ.Th17 cell differentiation:the long and winding road[J].Immunity,2008,28(4):445-453.
[4]庄园,邹全明.Th17:新兴的辅助T细胞[J].细胞与分子免疫学杂志,2008,24(9):935-937.
[5]Zou W,Restifo NP.T(H)17 cells in tumour immunity and immunotherapy[J].Nat Rev Immunol,2010,10(4):248-256.
[6]Liu T,Peng L,Yu P,et al.Increased circulating Th22 and Th17 cells are associated with tumor progression and patient survival in human gastric cancer[J].J Clin Immunol,2012,32(6):1332-1339.
[7]Kuang DM,Peng C,Zhao Q,et al.Activated monocytes in peritumoral stroma of hepatocellular carcinoma promote expansion of memory T helper 17 cells[J].Hepatology,2010,51(1):154-164.
[8]Chen JG,Xia JC,Liang XT,et al.Intratumoral expression of IL-17 and its prognostic role in gastric adenocarcinoma patients[J].Int J Biol Sci,2011,7(1):53-60.
[9]Wu X,Zeng Z,Xu L,et al.Increased expression of IL-17A in human gastric cancer and its potential roles in gastric carcinogenesis[J].Tumour Biol,2014,35(6):5347-5356.
[10]Zhang JY,Zhang Z,Lin F,et al.Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B[J].Hepatology,2010,51(1):81-91.
2012年重庆市科委一般课题资助项目(cstc2012jja10046)。
10.3969/j.issn.1672-9455.2015.17.058
A
1672-9455(2015)17-2626-03
2015-06-15
2015-06-20)
